旋覆代赭汤对食管癌细胞干性的影响*
马 媛,荀 敬,王波涛,李棣华,张 琦,王震宇,吴 瑜
(1.天津医科大学研究生院,天津 300070;2.天津医科大学南开临床学院,天津市急腹症器官损伤与中西医修复重点实验室,天津 300100;3.天津医科大学南开临床学院,肝胆胰外科三,天津 300100;4.天津医科大学南开临床学院,胃肠外科三,天津 300100)
食管癌(esophageal cancer,EC)是我国高发的恶性肿瘤之一[1]。研究表明,肿瘤干细胞(cancer stem cells,CSCs)是肿瘤细胞中具有自我更新和分化潜能并具有起始肿瘤发生能力的细胞亚群,这种无限制的增殖和分化,且能够转移和侵袭其他器官和组织的特性,即为癌细胞干性,同时也是肿瘤发生发展的根本原因[2]。因此,探寻有效的抗CSCs药物,对于抑制食管癌进展具有重要的意义。
中医学认为,旋覆代赭汤(Xuanfu Daizhe decoction,XDD)具有“和胃降逆”之功效,旋覆代赭汤出自张仲景《伤寒论·辨太阳病脉证并治下》:“伤寒发汗,若吐若下,解后心下痞硬,噫气不除者,旋覆代赭汤主之”。全方由旋覆花、代赭石、半夏、生姜、人参、炙甘草、大枣7味药组成[3],主治胃虚痰阻气逆证,证见胃脘痞闷或胀满,按之不痛,频频嗳气,或见纳差、呃逆、恶心,甚或呕吐,舌苔白腻,脉缓或滑。此方为理气剂,具有降逆化痰,益气和胃之功效,根据中医“异病同治”理论,“胃失和降,胃气上逆”者,应用此方辨证论治均具有显著疗效,例如旋覆代赭汤在抗炎[4,5]、镇吐[6]、促胃动力上[7]疗效显著,临床上常用于治疗胃食管反流病、功能性消化不良、胃瘫等疾病[8],但多为临床疗效观察,对其明确疗效及作用机制研究仍不清楚。因此,研究旋覆代赭汤对食管癌的发生发展具有非常重要的意义。
已有报道指出,胃食管反流病是导致食管癌发生的至关重要因素[9,10],但关于旋覆代赭汤抗肿瘤作用的研究尚未见报道。因此,本研究通过检测旋覆代赭汤对食管癌肿瘤生长及干性相关标志物NANOG(Nanog homeobox)、OCT4(organic cation/carnitine transporter4)、SOX2(SRY-box transcription factor 2)[11]的表达、ALDH(aldehyde dehydrogenase)活性以及肿瘤细胞的成球能力等,研究旋覆代赭汤对食管癌细胞干性的影响,为旋覆代赭汤作为抑制食管癌恶性转化的有效药物提供理论依据。
1 材料及方法
1.1 旋覆代赭汤组方的配制
按照《伤寒论》中旋覆代赭汤的配比,制备汤剂,组方为:旋覆花15 g,代赭石5 g,生姜25 g,半夏15 g,人参10 g,炙甘草15 g,大枣10 g(4枚),一副药共95 g(饮片,购自天津市南开医院中药房)。加入十倍水,提取2次,每次1 h,煎煮后用旋蒸器浓缩至1 g/ml的含药液,-20℃保存。组方中的中药材购买于天津市南开医院中药房。
1.2 实验动物
10只健康6~8周龄SPF级BALB/c雌性裸鼠,动物合格证号:SYXK(津)2015-0007。经天津市南开医院实验动物伦理委员会批准(NKYY-DWLL-2020-001)。
1.3 实验分组及处理
BALB/c裸鼠随机分为对照组与实验组,每组5只,实验组每日旋覆代赭汤按9.89 g/kg灌胃(根据人与动物等效剂量系数,实验动物给药剂量为常规用药6.25倍,按成年人体重为60 kg计算,实验动物给药量:95 g/60 kg×6.25),对照组每日等容积生理盐水灌胃处理,一日一次,在给予灌胃第8日时右侧背部皮下接种5×106细胞数量的人源食管癌ECA-109细胞,之后连续灌胃28 d。
每周两次测量肿瘤大小,用游标卡尺测出肿瘤最长和最宽处,再用公式长×宽2/2计算出肿瘤体积;小鼠处死后,取血置于EP管中,4℃静置4 h后,取上层血清至新的EP管中,-20℃保存;肿瘤组织称量大小并拍照,分别取50 mg提取RNA和蛋白质,另取一部分放入4%的多聚甲醛中,剩余部分-80℃ 保存。
1.4 实验试剂及仪器
实验试剂:培养基(DMEM)、胎牛血清、双抗、生理盐水、磷酸缓冲盐溶液(PBS),游标卡尺(艾瑞泽,ARZ-150),成球实验及相关成长因子B-27、hEGF、hFGF(Gibco公司,批号2226812;BIO-TECH公司,批号E10504121、J10402062),病理、包埋盒,苏木素染液(批号:70060020),RT-PCR和荧光定量PCR试剂盒(北京全式金生物技术有限公司,批号:O10306),蛋白定量试剂盒(Thermo公司,批号:VA289349) ,兔源 ALDH、NANOG、COT4、SOX2抗体(Abcam公司,批号:GR3236296-11),HRP偶联二抗(中杉金桥公司,批号:ZA-2301),聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳液,聚偏氟乙烯(PVDF)膜,等渗缓冲盐溶液(TBST),DAB底物缓冲液(Burlingame公司,批号:ZG0901),ALDH活性检测试剂盒(STEMCELL公司,批号:1000020662)。
实验仪器:细胞培养箱(Heal Force,型号:HF240),倒置显微镜(美国Leica公司,型号:D-35578),水浴锅(上海一恒,型号:HWS-26),水平摇床(Thermo公司,型号:SHKE2000-1CE),电泳仪 (美国BioRad公司,型号:042BR18385),转膜仪(美国BioRad公司,型号:221BR55398)化学发光分析仪(美国BioRad公司,型号:ChemiDoc XRS),PCR扩增仪(美国BioRad公司,型号:T100),离心机(美国Eppendorf公司,型号:5404EK418270),酶标仪(上海科华,型号:ST-360),全自动自动脱水仪(美国Leica公司,型号:ASP200S),包埋机(美国Leica公司,型号:EG1150H+C),切片机(美国Leica公司,型号:RM2235),摊片机(美国Leica公司,型号:H1210),烤片机(美国Leica公司,型号:H1220)。
1.5 细胞培养
将食管癌细胞ECA-109接种到六孔板上,每孔接种5×105个细胞,分为对照组和实验组,每组设置三个复孔,细胞贴壁后,分别用动物模型中取的体积分数10%的正常裸鼠血清和旋覆代赭汤含药血清处理食管癌细胞48 h。
1.6 RT-PCR(实时荧光定量 PCR)
在PubMed基因数据库查得人GAPDH、NANOG、OCT4、SOX2、ALDH mRNA信息,由生工生物工程(上海)股份有限公司合成。引物如下:GAPDH,上游引物:5’CTCTGATTTGGTCGTATTGGG3’,下游引物:5’TGGAAGATGGTGATGGGATT 3’;NANOG,上游引物:5’TCTGGACACTGGCTGAATCCT,下游引物:5’CGCTGATTAGGCTCCAACCAT;OCT4,上游引物:5’GCTCGAGAAGGATGTGGTCC,下游引物:5’CGTTGTGCATAGTCGCTGCT;SOX2,上游引物:5’GCCTGGGCGCCGAGTGGA,下游引物:5’GGGCGAGCCGTTCATGTAGGTCTG;ALDH,上游引物:5’CGGGAAAAGCAATCTGAAGAGGG,下游引物:5’GATGCGGCTATACAACACTGGC各组细胞PBS洗一次(各组肿瘤组织取黄豆粒大小至EP管中),提取RNA,立即反转录为cDNA,以cDNA为模板进行RT-PCR检测,分析各样品的CT值,采用2-ΔΔt法分析各组实验数据。
1.7 Western blot (蛋白质印迹法)
各组细胞PBS洗一次(各组肿瘤组织取黄豆粒大小),提取蛋白质,检测蛋白质浓度,加入Loading Buffer金属浴变性后,在SDS-PAGE电泳液中进行电泳1 h,之后在湿转槽中将蛋白湿转到PVDF膜,5%TBST配的脱脂奶粉室温封闭1 h,加入一抗4℃过夜,TBST洗3次,加入二抗,室温1 h,ELC化学发光法曝光条带。
1.8 免疫组化
收取小鼠的肿瘤组织,取适量大小放入包埋盒中,4%多聚甲醛浸泡,脱水进蜡,包埋,切片(4 mm),烘箱中过夜,脱蜡,抗原修复,全程避光,PBS洗3次,滴加去除内源性过氧化物酶室温孵育10 min,PBS洗3次,5%的山羊血清室温封闭30 min,之后滴加一抗,4℃过夜,PBS洗3次,滴加二抗,37℃水浴30 min,PBS洗3次,滴加辣根酶标记的链霉卵白素37℃水浴30 min,PBS洗3次,滴加现配的DAB显色液,2~5min后明显变色,自来水中终止变色并水洗,滴加苏木素后自来水终止染色并水洗反蓝,脱水处理,擦干切片后滴加中性树胶封片,晾干后显微镜下观察。
1.9 ALDH活性检测
将旋覆代赭汤血清处理48 h后的食管癌细胞与对照组的食管癌细胞消化并计数,取1×106个,用1 ml活化后的ALDEFLUORTMbuffer重悬细胞于流式管①中,在①中加入5 μl的ALDEFLUORTM试剂,混匀,吸取500 μl细胞悬液于流式管②中,在②中加入5 μl DEAB试剂混匀,将处理好的细胞置于37℃孵育40 min,之后4℃离心4 000 r/min,5 min,弃上清,用0.5 ml ALDEFLUORTMbuffer重悬细胞,置于冰上待上机,之后上机分析检测结果。
1.10 成球实验
用非黏附的六孔板,分别为对照组和实验组,每孔加入5 000个食管癌ECA-109细胞,2.7 ml DMEM(其中每10 ml DMEM中加入生长因子B-27 50 × 200 μl、hEGF 1 μl、hFGF 1 μl),300 μl动物模型中收取的正常裸鼠血清和旋覆代赭汤含药血清,7 d后显微镜下拍照并分析结果。
1.11 统计学处理
2 结果
2.1 旋覆代赭汤对小鼠食管癌肿瘤生长的影响。
对构建的食管癌皮下肿瘤小鼠给予不同处理(图1A),结果显示,对照组小鼠形态消瘦、活动迟缓、少动、出现声音时迅速聚在角落、目光晦暗无神、皮肤疏松无光泽;实验组小鼠体型较瘦,一般状况良好,饮水摄食正常,皮肤略疏松。而且,与对照组相比,旋覆代赭汤组(实验组)组显著抑制小鼠肿瘤的生长和肿瘤大小(P<0.01,P<0.05,图1B,C,D)。实验结果表明,旋覆代赭汤具有抑制食管癌肿瘤生长的作用。
2.2 旋覆代赭汤对小鼠肿瘤组织中干性相关基因和蛋白表达的影响。
RT-qPCR检测结果显示(表1),与对照组相比,实验组肿瘤组织中干性相关转录因子NANOG、OCT4、SOX2以及ALDH的mRNA水平显著降低(P<0.05,P<0.01);Western blot检测结果显示(图2A,表2),与对照组相比,实验组肿瘤组织中NANOG、OCT4、SOX2的蛋白表达水平显著降低(P<0.05,P<0.01);免疫组织化学染色检测结果显示(图2B,表3),实验组肿瘤组织中NANOG、OCT4、SOX2的阳性细胞的分布显著低于对照组(P<0.01)。实验结果表明,旋覆代赭汤抑制肿瘤组织中干性相关基因的表达。
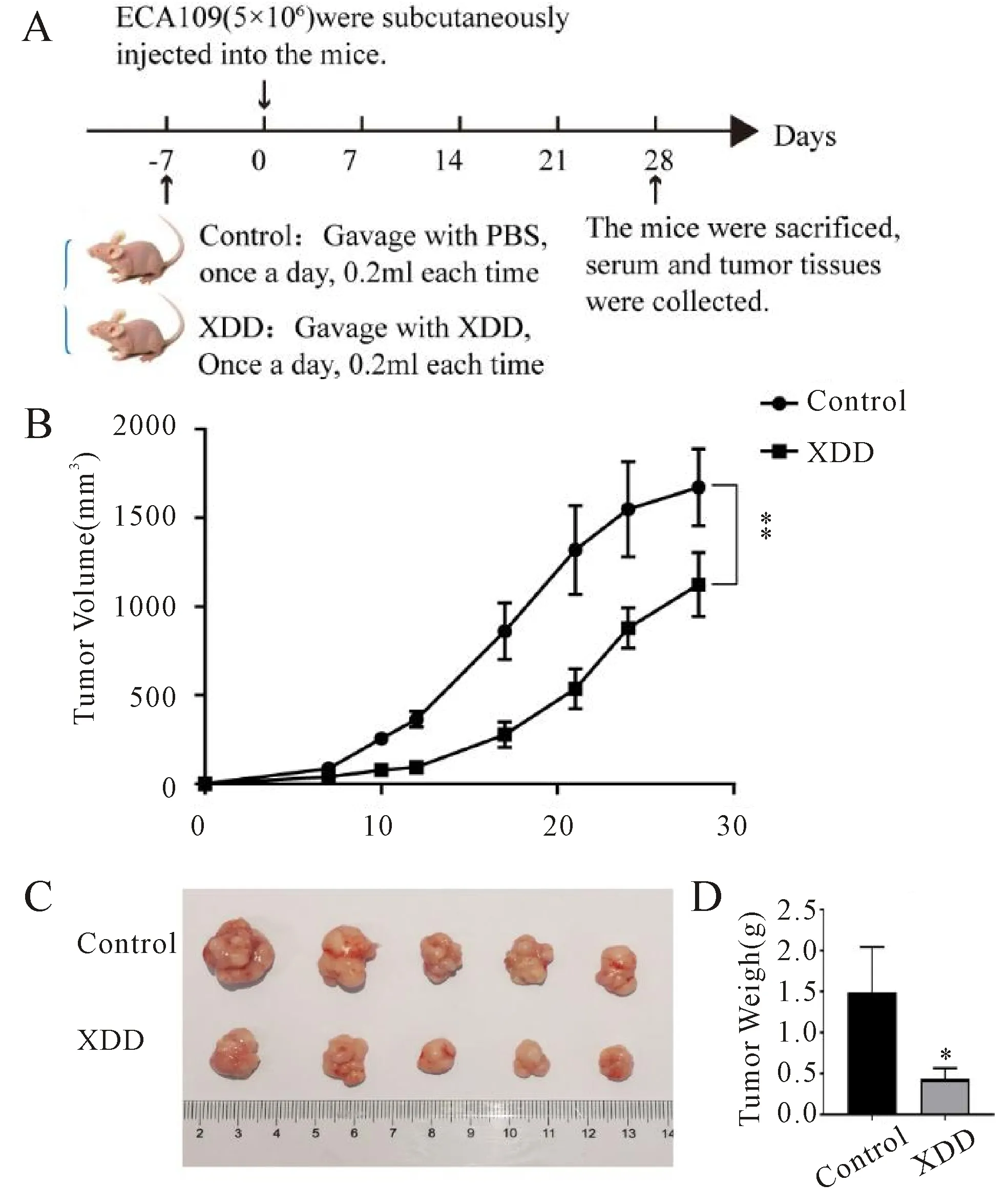
Fig. 1 Xuanfu Daizhe decoction inhibits the growth of esophageal cancer xenografts in mice
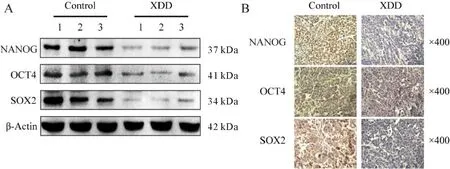
Fig. 2 Expressions of stemness-related genes in tumor tissues of mice in each group
Tab. 1 The mRNA expression levels of tumor-related stemness transcription factors NANOG,OCT4,SOX2 and ALDH in mouse tumor tissues n=5)
Tab. 2 The protein expression levels of tumor-related stemness transcription factors NANOG,OCT4,SOX2 in mouse tumor tissues n=5)
Tab. 3 The levels of tumor-related stem transcription factors NANOG,OCT4 and SOX2 determined by immunohistochemistry in mouse tumor tissues n=5)
2.3 旋覆代赭汤复方血清对食管癌细胞干性的影响
RT-qPCR检测结果显示(表4),与对照组相比,实验组肿瘤细胞中干性相关转录因子NANOG、OCT4、SOX2以及ALDH的mRNA水平显著降低(P<0.05,P<0.01);Western blot检测结果显示(图3A,表5),实验组肿瘤细胞中干性相关转录因子NANOG、OCT4和SOX2的蛋白水平显著降低(P<0.05,P<0.01);流式细胞术检测结果显示(图3B,表6),与对照组相比,实验组肿瘤细胞中ALDH酶活性显著低于对照组(P<0.01);成球实验结果显示(图3C,表6),与对照组相比,实验组肿瘤细胞的成球数量显著减少(P<0.01)。以上体外实验结果表明,旋覆代赭汤复方血清抑制食管癌细胞的干性。
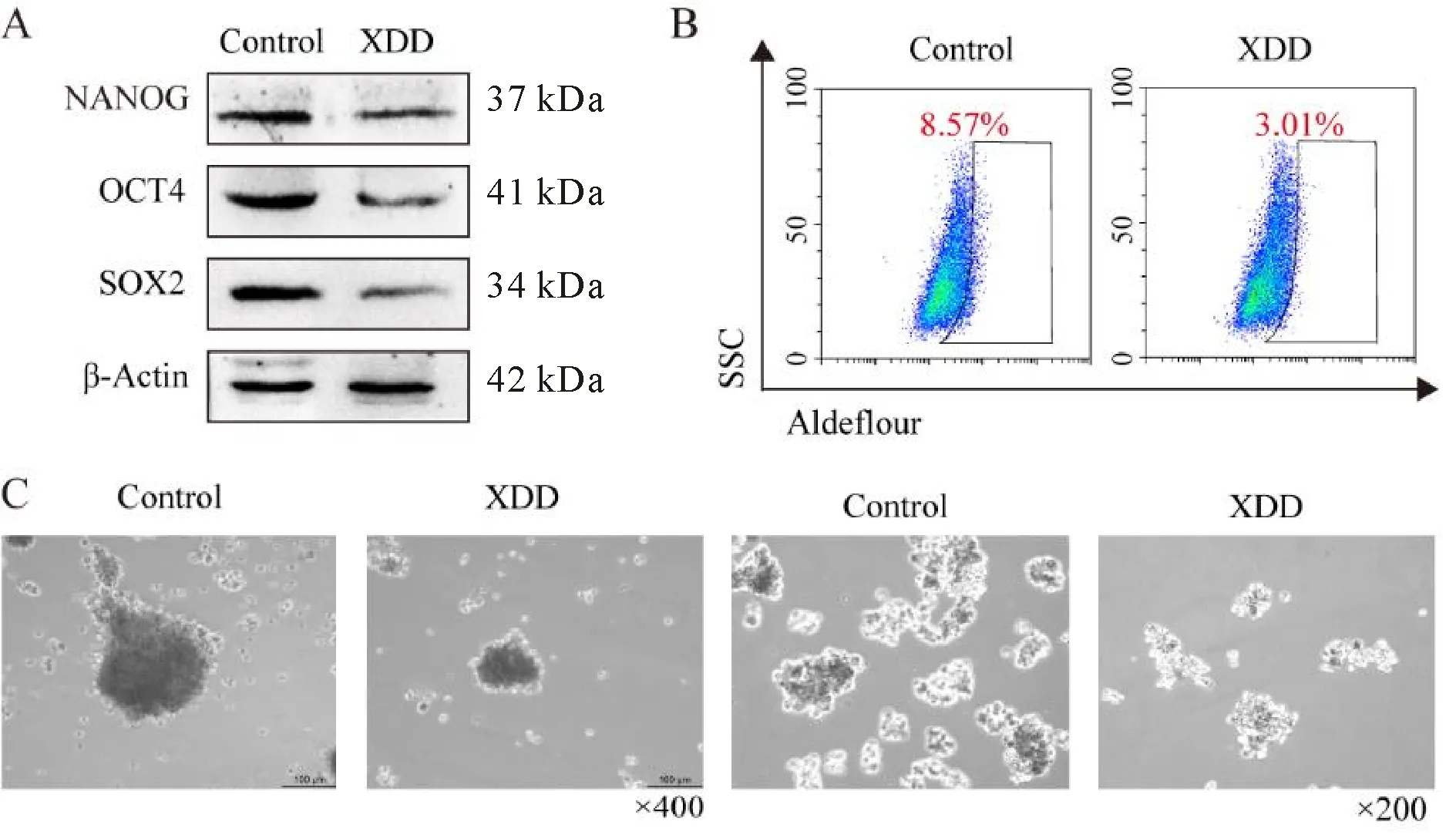
Fig. 3 The effects of mouse serum in each group on the stemness of esophageal cancer cells
Tab. 4 The mRNA expression levels of stem-related genes NANOG,OCT4,SOX2 and ALDH in the cells n=3)
Tab. 5 The protein expression levels of stem-related genes NANOG,OCT4 and SOX2 in the cells n=3)
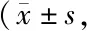
Tab. 6 The changes in intracellular ALDH enzyme activity and cell numbers into spheroids n=3)
2.4 旋覆代赭汤复方血清对食管癌细胞中AKT磷酸化水平的影响
Western blot检测结果显示(图4,表7),实验组肿瘤细胞中p-AKT蛋白表达水平显著低于对照组(P<0.05)。结果提示,旋覆代赭汤可能通过抑制p-AKT抑制食管癌细胞的干性。
Fig. 4 The effects of mouse serum in each group on the expression of AKT and p-AKT in esophageal cancer cells
Tab. 7 The protein levels of AKT and p-AKT in esophageal cancer ECA-109 cells treated with mouse serum in each group n=3)
3 讨论
食管癌是我国肿瘤类型中的高发疾病[1,12],其全球发病率也呈上升趋势[13,14]。研究表明,食管癌干细胞是具有自我更新、多向分化潜能及致瘤能力的细胞亚群,是引起肿瘤发生、进展、复发、转移和耐药等的根本原因[2]。因此,探寻有效的抑制食管癌细胞干性的药物具有重要意义。
从中医理论上讲,食管癌的病因病机多为饮食不节,七情内伤,久病体虚所导致的痰凝,气郁,气结血瘀,而致食道窒塞不通,故本病在治疗时应以健脾理气,降逆化痰,活血散结,滋阴清热为治疗原则。全方中旋覆花苦辛,降逆气消痰;代赭石生血凉血,而其质重坠,又善镇逆气,降痰涎止呕吐,通燥结;甘草、大枣和中;人参、清半夏降气和胃化痰。因此,该方具有主治汗、吐、下后表邪已解而脾胃中气受伤,胃气因虚上逆,以致心下痞硬,噫气不除之证,主“和胃降逆”之功。全方配伍切中食管癌的病因病机,临床上有很好的治疗效果[15-18]。临床研究发现,旋覆代赭汤对治疗胃食管反流病疗效显著[19,20]。已有报道指出,胃食管反流病是导致食管癌发生的至关重要因素[21]。因此,研究旋覆代赭汤对食管癌发生发展的影响,对于寻找治疗食管癌的有效药物具有重要临床价值。
本研究对构建的小鼠食管癌肿瘤进行处理发现,旋覆代赭汤可显著抑制肿瘤的生长和大小,说明旋覆代赭汤具有抑制食管癌作用。基于肿瘤干细胞在肿瘤发生发展过程中的重要作用,提示旋覆代赭汤可能抑制食管癌细胞的干性。本研究的体内和体外结果显示,旋覆代赭汤可显著抑制食管癌细胞的干细胞样特性:降低干细胞标志物ALDH的表达和活性,显著抑制干性相关转录因子NANOG、SOX2和OCT4的表达,降低肿瘤细胞的成球能力。因此,本研究表明旋覆代赭汤在食管癌发生发展过程中发挥抑制作用。
此外,研究表明,PI3K/AKT信号是调控肿瘤进展的关键通路[22],该信号的异常活化与肿瘤恶性程度成正相关关系,具有诱导和维持肿瘤细胞干性的作用[23-25]。Wang.Z等人的研究发现[26],AKT能够促进SOX2的过表达及其磷酸化,抑制SOX2与泛素E3连接酶UBR5的相互作用,从而稳定SOX2的蛋白水平,促进食管癌细胞的干性。因此,本研究检测了磷酸化的AKT蛋白水平。结果显示,旋覆代赭汤复方血清可显著抑制食管癌细胞中AKT的磷酸化水平。这提示,旋覆代赭汤可能通过抑制PI3K/AKT通路抑制食管癌细胞的干性,进而抑制食管癌进展。然而,旋覆代赭汤调控PI3K/AKT信号通路的具体分子机制还有待进一步的研究。
综上所述,本研究发现旋覆代赭汤能够抑制食管癌细胞的干性:抑制食管癌肿瘤的生长和大小,降低ALDH的表达和活性,抑制干性相关转录因子NANOG、SOX2和OCT4表达及肿瘤细胞的成球能力;PI3K/AKT信号通路可能介导旋覆代赭汤对食管癌细胞干性的抑制作用。本研究结果将为食管癌治疗探寻新的有效药物提供理论依据。

