基于CFTR的胞浆内第二信使cAMP检测方法的建立*
吴明达,刘雪莹,冯剑南,高雪伟,郝 峰,高俊涛
(1.吉林医药学院检验学院,吉林 132013;2.延边大学医学院,延吉 133002;3.北华大学医学技术学院,吉林 132013;4.吉林医药学院基础医学院,吉林 132013)
G蛋白偶联受体(G protein-coupled receptors,GPCRs)是最大的膜受体家族,其中GPCRs在内分泌、神经、心血管、感觉和免疫系统功能中发挥的基础性作用尤为突出,并与甲状腺疾病、高血压或帕金森病等人类流行疾病的发病机制有关[1-3]。GPCRs作为临床药物研发的重要靶点,对其激动剂和抑制剂的研究备受关注,高通量药物筛选技术有助于推动GPCRs靶向药物的深入研究[4]。基于GPCRs信号传递过程中效应分子改变细胞内第二信使的含量与分布,通过对下游第二信使定量检测以反映GPCRs功能性已经成为GPCRs靶向药物筛选的重要手段。其中cAMP作为胞浆内重要的第二信使[5],可调控细胞内诸多重要的生理过程,如参与细胞的增殖与分化、激素的合成与分泌、基因表达、信号转导、神经节突触传递的调节等[6]。与其他第二信使不同的是,胞浆内cAMP也参与许多病理过程,是治疗心脏病、急性白血病、慢性呼吸道疾病、某些肿瘤等疾病的潜在靶点[7,8]。因此,胞浆内第二信使cAMP一直是科研领域的研究热点。
cAMP分子量只有329.21,并且在细胞胞浆中的含量极低,为pmol/L级别,一般的检测方法信噪比较低,且检测难度颇大。目前最基本的方法可以分为两类:一类是利用抗cAMP抗体检测细胞内cAMP与已知浓度的被标记的cAMP之间的竞争水平,该方法是通过不同检测技术检测不同标记物标记的cAMP,包括荧光共振能量转移 (FRET)、竞争性酶联免疫吸附法、放射性免疫分析法等;另一类是基于转录水平的报告基因检测模型,即报告基因法。上述方法普遍存在一些问题,例如在检测时需要细胞破膜,使本来含量极低浓度的cAMP进一步稀释,并且遭受细胞外环境的干扰;由于抗体的制备存在批次上差异,使检测试剂存在非均一性;对相应配套的仪器精密度要求十分严格,并且信噪比相对较低[9],并且市售的cAMP检测试剂盒普遍都造价昂贵。基于以上cAMP检测方法带来的不便,本文探索了一种重复性高,检测费用低,灵敏性高并且无需对细胞进行破膜处理的检测方法。
本方法原理如下:当胞浆内cAMP浓度升高时,囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)通道开放[10],可将细胞外I-转运到胞浆内,使I-敏感的黄色荧光蛋白的荧光发生淬灭[11]。通过酶标仪检测得到荧光淬灭曲线的斜率值来反映通道受cAMP激活开放的程度,间接反映细胞内cAMP相对浓度的变化(图1)。
1 材料与方法
1.1 材料
FRT细胞本实验室保存;pcDNA3.1由麻彤辉教授馈赠;YFP-H148Q/I152L真核表达载体由本实验室前期构建[12];Lipofectamine 3000脂质体、zeocin抗生素、G418抗生素、ionomycin、calcimycin购自Invitrogen公司;F-12营养培养基、三羟基黄酮(genistein)、欧前胡素(imperatorin)、毛喉素(forskolin)、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、Gly H101、CFTRinh -172均购自Sigma公司,放射免疫试剂盒购自上海中医药大学。
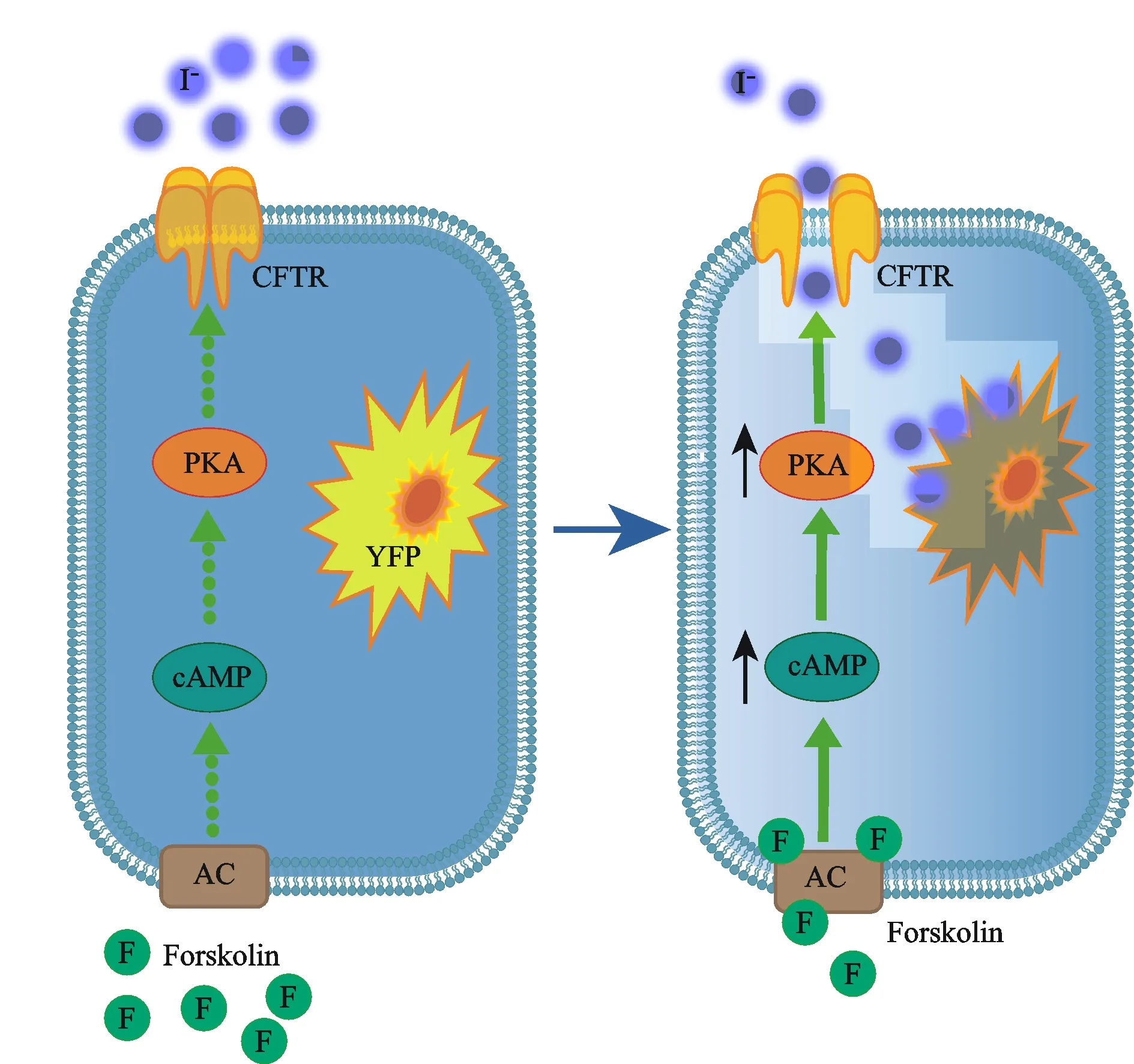
Fig. 1 Principle of the assay of CFTR-based cytosolic second messengercAMP detection
1.2 CFTR真核表达载体的构建
将CFTR 和pcDNA3.1载体为模板,进行PCR扩增。琼脂糖凝胶电泳,分别用Nhe I和BamH I双酶切PCR产物,酶切产物经琼脂糖凝胶电泳后切胶回收。利用T4连接酶将载体pcDNA3.1和目的基因CFTR于4℃连接反应12 h。将CFTR- pcDNA3.1进行转化,并提取质粒,琼脂糖凝胶电泳后送于上海生工生物公司测序。
1.3 共表达CFTR和YFP-H148Q/I152L细胞模型的构建
1.3.1 构建共表达CFTR和YFP-H148Q/I152L细胞株 按照Lipofectamine 3000说明书将CFTR质粒瞬时转染到大鼠甲状腺滤泡上皮细胞(fisher rat thyroid follicular epithelial cells,FRT)中,利用zeocin抗生素进行筛选,两周后利用倒置荧光显微镜观察,挑取细胞膜上可见绿色荧光的细胞进行有限稀释,对得到的阳性克隆的细胞株进行扩大培养,经过两次传代仍表达CFTR的细胞则为稳定表达CFTR的FRT大鼠甲状腺滤泡上皮细胞株。按照Lipofectamine 3000说明书将YFP-H148Q/I152质粒转染到已稳定表达CFTR的FRT细胞中,利用G418抗生素进行筛选,两周后利用倒置荧光显微镜观察,挑取胞浆中可见绿色荧光且荧光信号较强的细胞进行有限稀释,对得到的阳性克隆的细胞株进行扩大培养,经过两次传代仍表达YFP-H148Q/I152的细胞则为稳定共表达CFTR-YFP-H148Q/I152L的FRT 细胞株。
1.3.2 流式细胞仪检测细胞纯度 将稳定共表达CFTR-YFP-H148Q/I152L的FRT 细胞用胰酶消化,800 g离心5 min,弃上清,加入PBS缓冲液,重悬细胞后上机进行检测。以未转染的FRT细胞作为阴性对照,选择FL2通道,激发光波长488 nm,检测光波长575 nm,每管收集5×105cells。阴性对照所检测到的荧光强度范围进行设门,该门内的细胞表示未转染上的细胞,将大于该范围的荧光强度表示为转染成功的细胞,计算细胞纯度。
1.4 荧光淬灭动力学实验鉴定细胞模型的有效性
将培养在黑壁透明底的 96孔板中的稳定共转染CFTR-YFP-H148Q/I152L的FRT细胞分为2组:实验组和对照组,每组3个复孔。以含钙镁离子的PBS缓冲液洗涤两组细胞 3次,加入50 μl含钙镁PBS缓冲液,向实验组加入120 μl含有forskolin(CFTR激活剂)的碘化钠PBS缓冲液,对照组加入CFTRinh -172(CFTR特异性抑制剂)孵育10 min,采用Fluo star多功能酶标仪检测相对荧光强度动态变化。具体设置如下:发射光波长540 nm,激发光波长500 nm。以每0.2 s检测一个相对荧光强度的速度动态检测14 s,其中前2 s为基线,2 s后以180 μl/s的速度向实验组组孔中加入120 μl含有forskolin的碘化钠PBS缓冲液。
1.5 验证细胞模型功能
为了验证CFTR细胞模型可筛选CFTR调节剂,将细胞分为5组(实验组4组,对照组1组),每组3个复孔,其中实验组4组分别加入imperatorin、genistein、forskolin、IBMX四种激活剂,另外对照组用钙镁PBS缓冲液洗涤细胞3次后,吸出液体后加入50 μl PBS缓冲液,加入CFTR抑制剂Gly H101,孵育10 min,采用多功能酶标仪进行检测,加入碘化钠PBS缓冲液120 μl,记录相对荧光强度动态变化。
为了验证CFTR细胞模型的功能活性,将细胞分为6组,每组3个复孔,以800 μmol/L作为初始浓度,采用倍比稀释的方法获得不同浓度的激活剂和抑制剂。其中4组分别加入不同浓度的imperatorin、genistein、forskolin、IBMX四种激活剂,采用多功能酶标仪进行检测,加入碘化钠PBS缓冲液120 μl,记录相对荧光强度动态变化。另外2组加入不同浓度的Gly H101、CFTRinh -172两种抑制剂,孵育10 min,同样采用多功能酶标仪进行检测,加入含有forskolin的碘化钠PBS缓冲液120 μl,记录相对荧光强度动态变化。利用Excel软件对原始数据进行宏计算,求出斜率值(slope),绘制细胞模型的剂量依赖曲线。
1.6 放射免疫法检测cAMP的浓度变化
利用放射免疫试剂盒测定细胞内cAMP浓度,将培养在黑壁透明底的 96孔板中稳定共转染CFTR和YFP-H148Q/I152L的FRT细胞采用无钙镁PBS缓冲液洗涤细胞3次,加入含有forskolin的PBS缓冲液孵育15 min,弃去溶液。加入200 μl醋酸缓冲液后立即将细胞超声破碎,将细胞破碎液收集到含有800 μl醋酸缓冲液的EP管中,3 000 r/min离心15 min,吸取100 μl进行cAMP测定。按照说明书进行操作,检测放射性含量,根据标准曲线进行cAMP浓度的计算。
1.7 统计学处理
2 结果
2.1 CFTR真核表达载体的构建
结果表明,所构建重组质粒上连有目的基因CFTR,酶切位点分别是NheI和BamHI,证实成功构建CFTR真核表达载体(图2)。
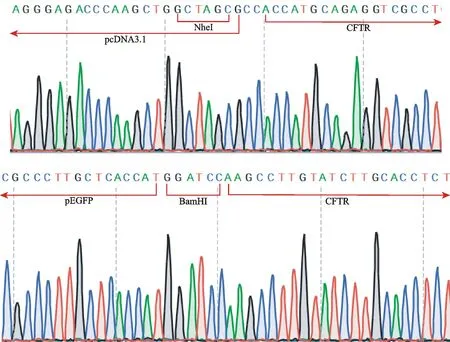
Fig. 2 The sequencing results of recombinant plasmid
2.2 共表达CFTR和YFP-H148Q/I152L细胞模型的构建
转染CFTR的FRT细胞共挑出5个单克隆细胞团,在倒置荧光显微镜下可见细胞膜呈绿色荧光,取表达量最高的单克隆细胞团进行扩大培养。稳定表达CFTR的FRT细胞镜下可见绿色荧光在细胞膜上均匀分布,结果表明CFTR表达在细胞膜上(图3A);共转染CFTR-YFP-H148Q/I152L的FRT细胞共挑出6个单克隆细胞团,在倒置荧光显微镜下可见胞浆呈绿色荧光,同样取表达量最高的进行扩大培养。镜下可见绿色荧光在胞浆内均匀分布,结果表明YFP-H148Q/I152L表达在胞浆中(图3B)。结果表明,成功获得稳定共表达CFTR和YFP-H148Q/I152L的FRT细胞株。流式细胞仪检测结果表明,稳定转染的细胞纯度达到96.3%(图3C,D)。
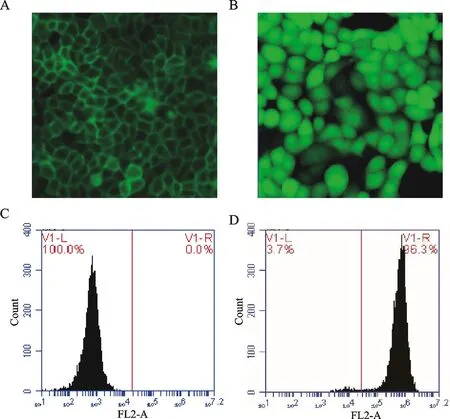
Fig. 3 Construction results of CFTR and YFP-H148Q / I152L cell model
2.3 荧光淬灭动力学实验鉴定细胞模型的有效性
酶标仪结果显示,实验组加入forskolin后,细胞相对荧光强度显著下降,对照组在CFTRinh -172孵育后,细胞相对荧光强度无明显变化(图4)。Forskolin可迅速升高胞浆内cAMP浓度,cAMP浓度的升高可引起CFTR通道的开放,CFTR具有转运碘离子特性,细胞外碘离子转运至胞浆内引起YFP-H148Q / I152L迅速淬灭,导致荧光强度显著下降。而加入CFTRinh -172可抑制CFTR通道的开放,荧光强度无明显变化。结果表明,共表达CFTR-YFP-H148Q/I152L的FRT 细胞具有CFTR通道特性,细胞模型构建成功。
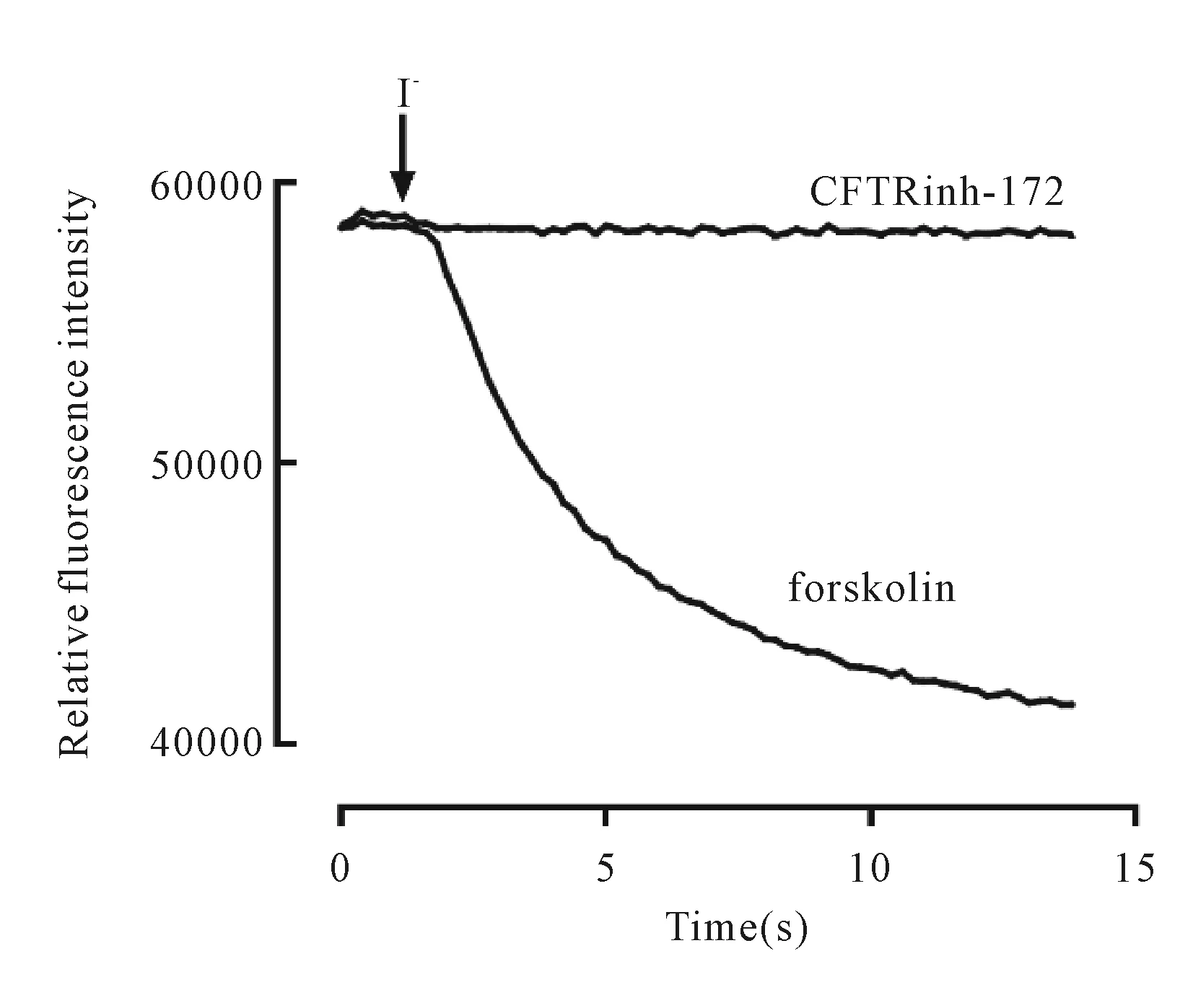
Fig. 4 Results of model validation by fluorescence quenching experiment
2.4 验证细胞模型功能
加入CFTR激活剂genistein、imperatorin、forskolin、IBMX后,荧光迅速淬灭。而加入CFTR抑制剂Gly H101后,荧光不淬灭(图5A)。通过计算分别得出各激活剂和抑制剂荧光淬灭曲线的斜率值分别为65.36±2.80、57.66±1.45、52.83±2.45、46.06±2.80和2.10±0.43,结果显示各实验组荧光斜率值均显著高于对照组,各实验组与对照组具有显著性差异(P<0.01),说明模型可以筛选CFTR调节剂。
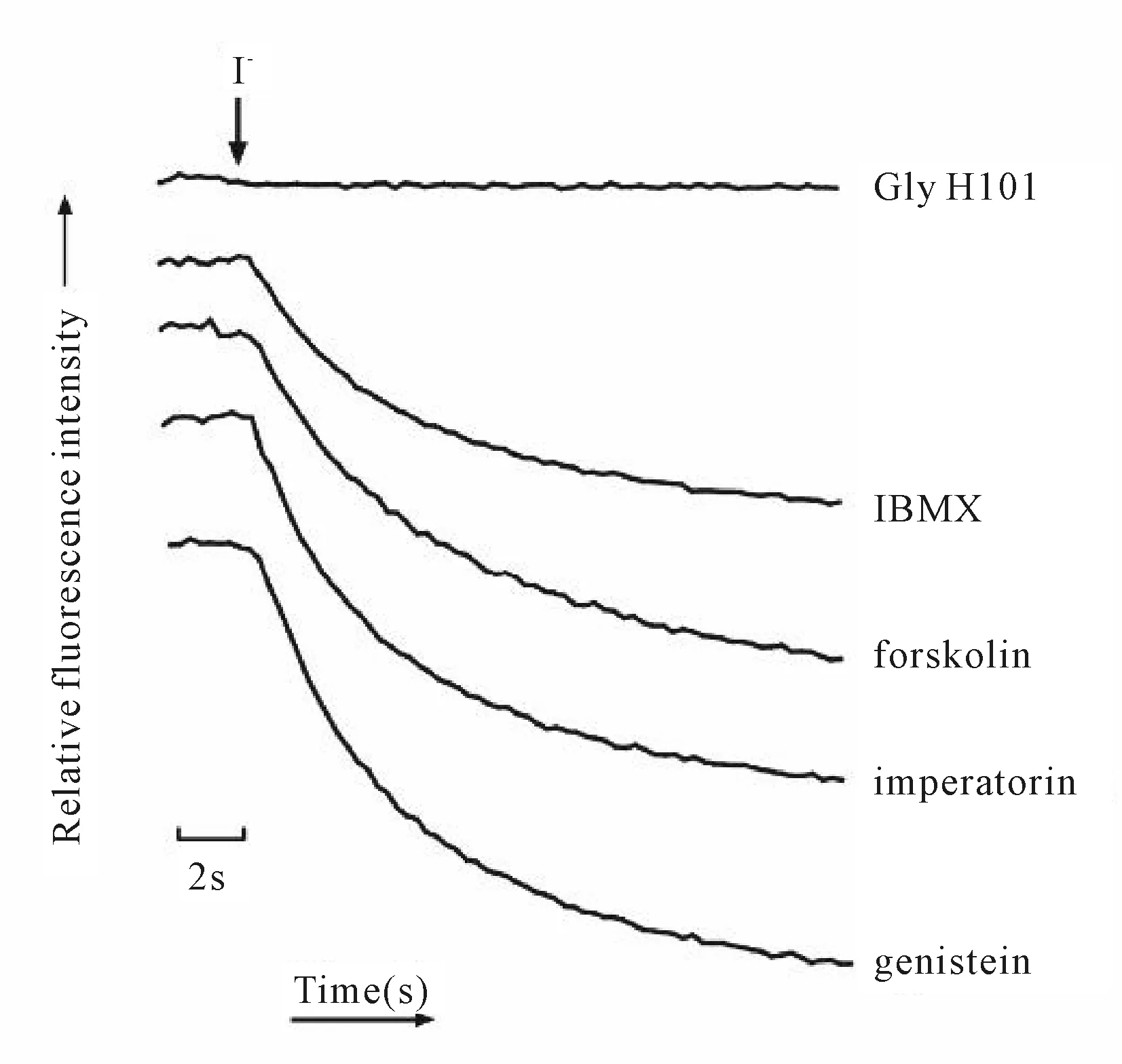
Fig. 5 Fluorescence quenching kinetics experiment identification model could screen CFTR modulators
在加入不同浓度的CFTR激活剂后,荧光信号呈现不同的变化。随着激活剂浓度的增加,荧光斜率不断增强,呈现剂量-效应依赖关系。结果采用GraphPad Prism 8软件分析(图6A),genistein、imperatorin、forskolin、IBMX的EC50分别为(28.87± 0.16)μmol/L、(67.47±2.47)μmol/L、(107.20± 4.45)μmol/L、(174.26±1.66)μmol/L。在加入含有激活剂的碘化钠PBS缓冲液后,随着抑制剂浓度的增加,荧光信号不断减弱,即抑制剂浓度越大其抑制作用越强,呈现剂量-效应依赖关系。结果同样采用GraphPad Prism 8软件分析(图6B),CFTRinh -172、Gly H101的IC50分别为(23.58±1.70)μmol/L和(55.50±4.04)μmol/L。
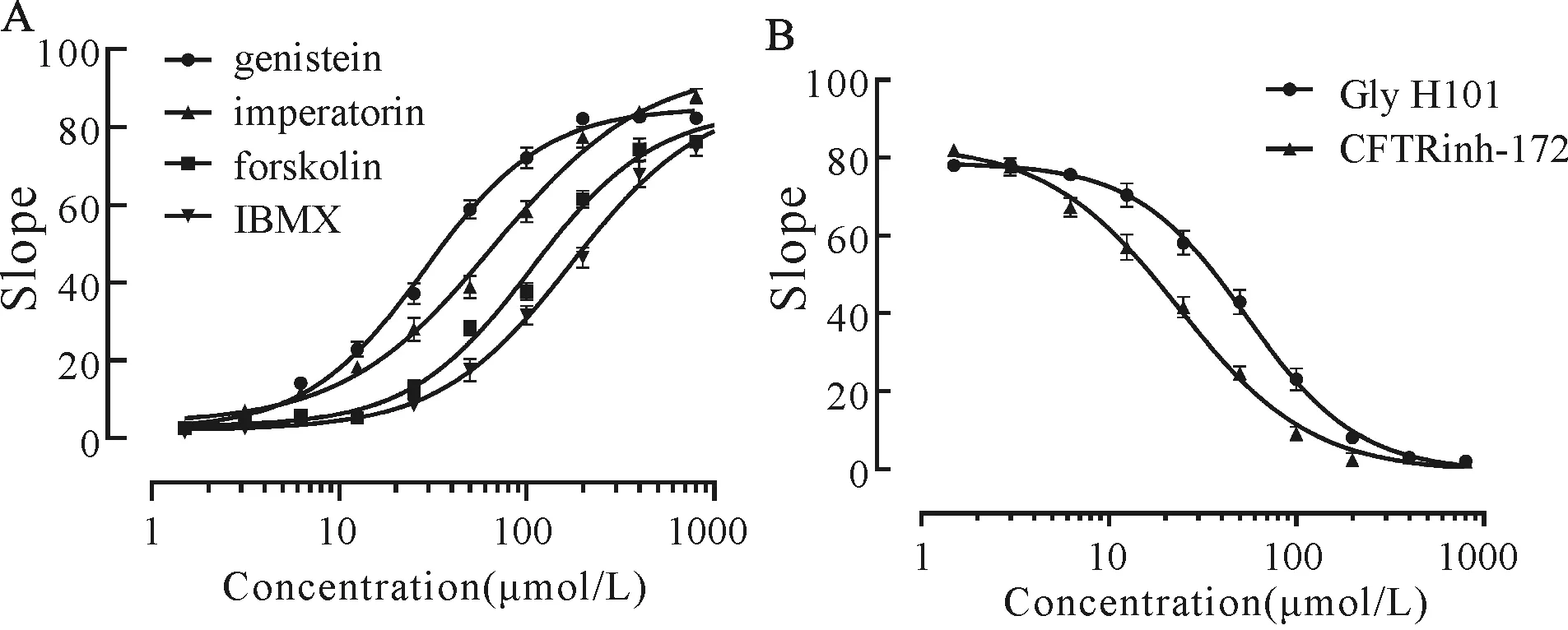
Fig. 6 Dose-dependent curves of CFTR activators and inhibitors
2.5 基于CFTR的检测方法与放射免疫法分别检测cAMP
加入不同浓度的forskolin后,相对荧光强度产生不同程度的下降,激活剂浓度越大,相对荧光强度下降的幅度越大,荧光淬灭曲线斜率值越大(图7A),结果表明荧光斜率值与激活剂浓度呈剂量依赖关系。随着激活剂浓度的升高,胞浆内cAMP浓度越高,其浓度与激活剂浓度呈剂量依赖关系(图7B)。根据图7A,7B分析结果表明,荧光淬灭曲线斜率值随着胞浆内cAMP浓度增加而增加,并呈现良好的依赖关系,因此通过荧光变化的斜率值可反映细胞内cAMP浓度(图7C)。与传统的放射免疫法(图7D)相比,加入不同浓度的forskolin后,在同一cAMP浓度下荧光淬灭曲线Slope值变化百分比比放射性信号变化百分比更高,即本方法信噪比更高,信号窗口更大,说明此方法具有更高的灵敏度(图7E),因此该细胞模型可灵敏检测细胞内cAMP浓度的变化。
3 讨论
cAMP作为第二信使学说是萨瑟兰于1965年首先提出的,他认为人体内各种含氮激素都是通过细胞内的cAMP而发挥作用,首次把cAMP叫做第二信使[13]。cAMP作为第二信使在信号转导通路中起着关键作用。对cAMP动力学的研究为cAMP相关疾病的药物开发和治疗提供线索。例如,抗肿瘤药物对cAMP介导的细胞内信号通路的调节可以减少肿瘤的生长[14,15]。然而,大多数用于测量活体内cAMP水平的早期工具都需要细胞破坏,这不适合于活细胞成像。因此,在过去的几十年里,研究开发用于实时监测cAMP分布或信号动力学的工具一直是努力的方向,基于荧光蛋白和荧光素酶的基因编码传感器可能是克服这些缺点的有力工具。
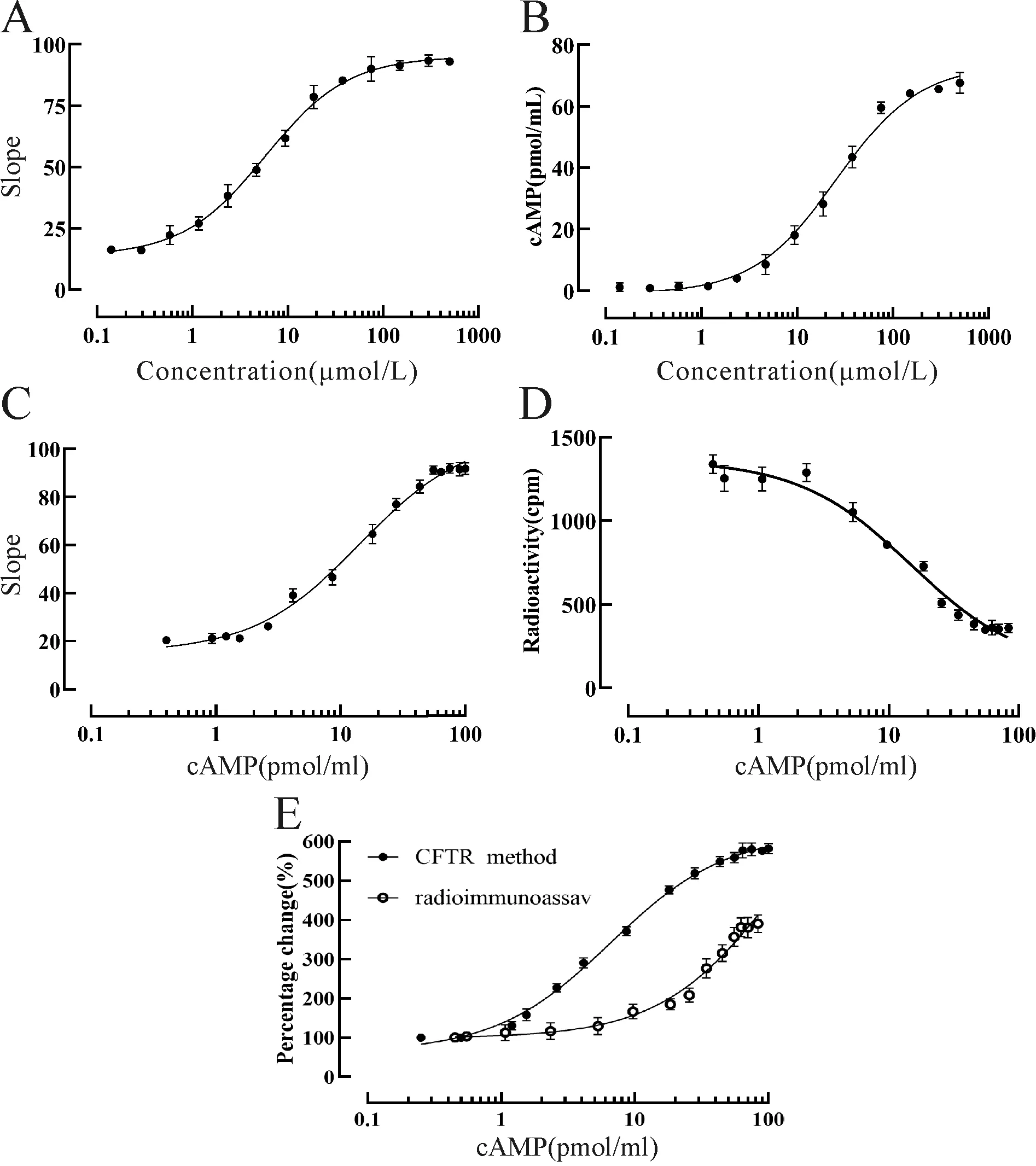
Fig. 7 The detection method based on CFTR and radioimmunoassay respectively detect the changes of cAMP
检测细胞内cAMP的众多方法中[16],国内外较为主流的方法大体可以归为抗原抗体竞争性结合法和报告基因法,这两种方法目前无论是在检测原理和操作上仍存在一定的局限性[17,18],如免疫法抗体在制备过程中存在批次上差异,使检测试剂存在非均一性;报告基因检测的显著缺点是需要一个稳定的细胞系来表达由cAMP反应元件驱动的报告基因,并且需要较长的转录孵育时间,在这过程中可能会发生受体下调。在操作方法上,这两种检测手段均需要细胞破膜操作,耗时相对较长,并且需要额外的配套试剂。
本研究构建一种新的胞浆内第二信使cAMP的检测方法,利用CFTR通道可以转运碘离子和YFP-H148Q/I152L遇到碘离子淬灭的特性,成功构建检测胞浆内第二信使cAMP的细胞模型。当胞浆内cAMP浓度升高时,CFTR通道开放,细胞外I-转运至胞浆内,细胞内黄色荧光蛋白双突变体YFP-H148Q/I152L遇到I-发生荧光淬灭,荧光信号显著下降,利用荧光淬灭曲线的斜率值来反映胞浆内cAMP浓度。本研究提出的基于CFTR的胞浆内第二信使cAMP检测方法与传统方法相比具有以下优势:(1)本方法利用荧光斜率值来反映胞浆内cAMP浓度升高情况,解决了以往直接检测cAMP浓度的方法的操作复杂、试剂昂贵、周期长等问题;(2)通过CFTR通道对cAMP以及YFP-H148Q/I152L荧光蛋白对CFTR通道开放后转运碘离子的敏感性的特点,实现了对细胞内cAMP的实时检测,延迟基本可以忽略,这一优势相对于报告基因法是十分明显的;(3)这种检测方法无需额外的试剂,细胞模型经过反复传代至25代以上,CFTR和YFP-H148Q/I152L仍然保持其良好特性和稳定状态,具有良好的稳定性。这种细胞模型在国外已经证实可运用于阴离子通道的研究,并且美国加州大学Verkman教授利用基于CFTR对cAMP的敏感性,成功应用类似的细胞模型进行了加压素-2受体(Vasopressin-2,V2)调节剂的筛选[19]
综上所述,本研究构建的基于CFTR可敏感检测胞浆内第二信使cAMP的细胞模型,可以简单快速地检测胞浆内cAMP浓度,为研究CFTR信号通路的第二信使cAMP相关靶点提供了筛选方法,同时为第二信使cAMP信号转导途径的深入研究以及对G蛋白偶联受体的功能检测奠定了良好的基础。

