“氢氧化钠与二氧化碳反应”实验的简约化设计
姜跟华


摘要:氢氧化钠与二氧化碳反应,通常没有明显的实验现象,学生易产生“实证”盲点。在分析已有实验设计方案的基础上,不断实践与总结,设计了简约化实验方案,取得了非常好的实验效果。
关键词:氢氧化钠:二氧化碳;简约化:设计
文章编号:1008-0546( 2022 )11x-0087-03
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2022.11x.022
一、问题提出
“氢氧化钠与二氧化碳反应”是氢氧化钠的化学性质之一,更是初中化学非常重要的知识点。人教版九年级化学下册56页指出:“氢氧化钠在空气中不仅吸收水分,还会发生下列反应2NaOH+CO2= Na2CO3+H2O”。它对帮助学生认识“氢氧化钠必须密封保存”“碱可以与某些非金属氧化物反应”等有著重要的意义。然而教学时却发现一些问题:(1)教材没有编排相关探究实验,而是直接给出化学方程式,减少了学生自主探究的机会,不利于学生学科素养的提升,较难体现学科的特点和育人价值;(2)将二氧化碳气体通人到氢氧化钠溶液中,通常没有明显的实验现象,学生易产生“实证”盲点,失去了“实验是化学最高法庭”的本真;(3)遵循教材、教参意图,以氢氧化钙为参照物,通过类比方式来讲解该反应原理,学生缺乏直观的感性认知,教学效果不理想。实验是化学的灵魂,探究是学生学习的主要方式,如何设计创新实验,将氢氧化钠与二氧化碳反应现象由“看不见”变为“看得见”?帮助学生理解和掌握该反应原理,成为笔者迫切想解决的问题。
二、已有设计
化学变化不但生成其他物质,而且还伴随着能量的变化,这种能量变化常表现为吸热、放热、发光等。上述可观察到的现象,常常可以帮助我们判断物质是否发生了化学变化。[1]笔者通过中国知网、万方数据库等平台查阅相关资料,发现很多教师对该反应进行了研究,设计的实验方案创新选出,令人回味,其设计归纳起来可以分为以下几种。
1.从气体压强变化设计实验
利用密闭容器内气体被消耗而导致压强减小的原理,来设计有明显现象的实验,是目前最主要的实验设计方向。
谢丹敏和汤中华用向上排空气法将U型管中收集满二氧化碳,塞上橡皮塞,然后将U型管两侧分别插入等体积的水和NaOH溶液中,再用镊子取下橡皮塞,可观察到左侧玻璃管内液面比右侧液面高(如图1所示)。[2]
褚衍伟利用了压强与沸点的关系设计实验。他将20 mL的水注入到A锥形瓶中,振荡后观察无现象,然后又将20 mL浓NaOH溶液迅速注入到锥形瓶A中,振荡,观察到B锥形瓶中的水剧烈沸腾起来(如图2所示)。[3]
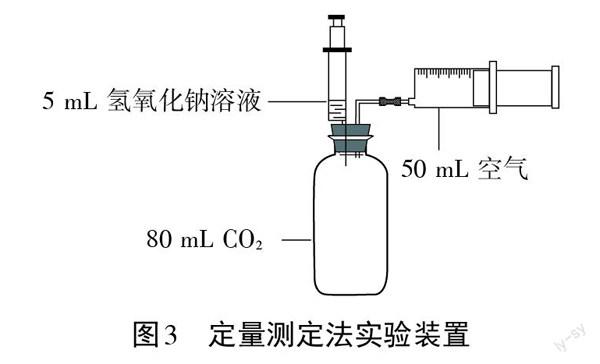
通常情况下,1体积水只能溶解1体积二氧化碳。陈立铭和李德前将5 mL 10%的氢氧化钠溶液慢慢注射到集气瓶中,发现至少有50 mL的二氧化碳气体被吸收,除去5 mL水吸收的5 mL二氧化碳气体,显然约有45 mL的二氧化碳气体是被氢氧化钠吸收的(如图3所示)。[4]
此外还有的研究者用瓶子变瘪法、气球法、喷泉法、瓶吞鸡蛋法等来设计实验。[5]
2.从氢氧化钠浓度变化设计实验
突破固定思维束缚,从另一反应物人手,检验OH一离子浓度变化也成为研究者的设计思路。
耿元元将10%的NaOH溶液滴入到百里酚酞指示剂中,直至溶液恰好呈蓝色,然后把蓝色溶液喷在白色滤纸上,把滤纸放入盛满CO2的集气瓶中,摇晃,可观察到滤纸由蓝色变成无色;则证明NaOH与CO2发生了反应(如图4所示)。[6]
夏琴等向一定浓度的紫甘蓝汁稀释液中加入200 mL 0.1 mol-L -1的氢氧化钠溶液,然后将pH传感器浸入混合液中,连接数据采集器,投入几块干冰,测定溶液的pH变化,通过观察溶液酸碱度和溶液颜色的变化,从定性和定量二个维度来证明氢氧化钠与二氧化碳发生了反应(如图5所示)。[7]
3.碳酸钠产物检验设计实验
化学变化的主要特征是有新物质生成。利用碳酸钠与氢氧化钠性质的不同,检验溶液中是否有碳酸钠存在,从而确定是否发生了反应,也成为许多研究者设计的方向。
杨光梅等利用碳酸钠易溶于水而难溶于酒精的性质,将二氧化碳依次通过NaOH的水溶液和NaOH酒精溶液中,发现NaOH水溶液无明显现象,而NaOH的酒精溶液中却可以看到白色浑浊,从而证明有新物质生成,真正实现了反应本身由“无现象”变为“有现象”(如图6所示)。[8]
赵永胜和朱莉将二氧化碳气体通入氢氧化钠溶液中一会儿,然后加热上述溶液,冷却,再向溶液中滴加足量稀盐酸,可观察到气泡产生,验证有碳酸钠存在,从而确定氢氧化钠与二氧化碳发生了反应(如图7所示);此外,他们还提出可以用Ca(OH)2或BaCl2溶液来检验碳酸钠是否存在。[5]
纵观上述实验设计,各位研究者在实验可视化方面都做出了积极的探索。笔者同时也发现了一些问题:(1)有些实验操作比较繁琐,不简约,不利于师生操作;(2)有些实验设想与实际情形存在差距,成功率偏低(如褚衍伟的液体沸腾设计等);(3)有些实验使用的仪器普及率不高,在实际教学中难以被借鉴(如数字化实验等);(4)有些实验设计远离人教版的知识体系(此时还未学习中和反应和盐的化学性质),未考虑到学生的知识结构和认知能力,为了“设计”而设计(如使用酸、碱或盐来检验碳酸钠等)。基于以上分析与思考,笔者有了设想:能否从生成物水的视角来设计实验呢?反应通常伴随着能量的变化,能否从能量的视角证明反应的发生呢?为此,笔者进行了实验设计,并不断实践与优化,最终形成了如下简约化的实验,实验效果令人满意。
三、“氢氧化钠与二氧化碳反应”实验的简约化设计
1.实验用品
二氧化碳氣体、氢氧化钠固体、集气瓶、研钵、药匙等。
2.实验操作
(1)取一个250 mL集气瓶,用向上排空气法收集一瓶干燥的二氧化碳气体,备用;
(2)用研钵将氢氧化钠固体尽可能研细,装入试剂瓶中;
(3)取2药匙氢氧化钠粉末加入到盛有二氧化碳气体的集气瓶中,快速盖好玻璃片,上下振荡,观察实验现象;同时用手触摸集气瓶(黏有固体的部位),感受温度的变化。
3.实验说明
(1)250 mL集气瓶可以提供比较多的二氧化碳气体参与反应(相对于125 mL),使实验现象更明显。
(2)选用集气瓶作为反应容器,符合学生的一般认知(用集气瓶收集气体),更重要的原因在于它有适中的厚度(相对于矿泉水瓶)、适宜的导热性能,可以避免反应放出的热量将手烫伤,更不会将容器烫穿。
(3)使用固体氢氧化钠作为反应物,可以排除外来水的干扰,实现从水的视角证明反应的发生;同时将固体氢氧化钠进行研磨(越细越好),目的是增大固体与气体的接触面积,使其充分、快速反应,缩短实验时间,观察到更明显的实验现象。
(4)实验过程中,可观察到固体粉末形成糊状而黏在容器壁上,同时大约30秒后固体周围出现很多小水珠;用手触摸瓶壁可明显感觉到热,真正实现了“可视可感”的实验现象,从多个维度来证明反应的发生。
4.实验优点
(1)装置简约,操作简便。利用最简约的实验装置(集气瓶),进行最简便的“研磨”“振荡”操作,不需要增加额外实验(如进行对比实验或产物检验实验等),就可实现实验现象的“看得见”。立足简约,又不失创新。
(2)效果显著,师生可用。虽然只进行简约化设计,但注重实验细节,完美地解决了“看不见”问题,实验成功率达100%;实验在1 min左右即可完成,达到了“简约而不简单”的效果。
四、实验思考
氢氧化钠与二氧化碳反应除了生成水,还生成了碳酸钠,笔者就有了一个想法:能否从碳酸钠视角重新设计实验,既能满足装置的简约化、操作的简单化和现象的可视化,还能适应学生的知识结构和认知能力呢?为此笔者将二氧化碳气体分别通人不同浓度的氢氧化钠溶液中。惊奇地发现饱和氢氧化钠溶液逐渐变浑浊,30 s左右液体会全部变为糊状固体;用手触摸试管外壁,有发热的感觉。这是为什么呢?笔者查阅资料、仔细分析,终于找到了答案,原来在氢氧化钠与二氧化碳的反应中,生成的碳酸钠质量远大于参加反应的氢氧化钠质量,而相同温度下碳酸钠的溶解度又远远小于氢氧化钠的溶解度(如表1所示),使用饱和氢氧化钠溶液进行实验,生成碳酸钠的质量会远远超过此时碳酸钠的溶解极限,从而碳酸钠以晶体形式析出,出现了“看得见”的实验现象。
立足于教材,设计简约化的实验,回归教学原点,让学生在“做中学”、在“学中思”,亲身体验氢氧化钠与二氧化碳反应的真实发生,培养了学生创新意识和证据意识。当然二氧化碳和氢氧化钠反应的简约化设计肯定远不止这些,期待与更多的同仁一起碰撞出更好的创意。
参考文献
[1]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.义务教育教科书(化学九年级上册)[M].北京:人民教育出版社,2012.
[2]谢丹敏,汤中华.封闭U型管在对比实验中的应用[J].化学教学,2016(04):81-84.
[3]褚衍伟.CO:与NaOH溶液反应实验的趣味化设计[J].化学教学,2014(02):40.
[4]陈立铭,李德前,基于量的角度设计“氢氧化钠溶液与二氧化碳反应”的实验[J].化学教育,2014,35 (23):50-51.
[5]赵永胜,朱莉.验证二氧化碳与氢氧化钠反应的实验方案[J].化学教与学,2013(12):85-88.
[6]耿元元.氢氧化钠溶液与二氧化碳反应实验的四种新设计[J].化学教与学,2018(09):85-87.
[7]夏琴,杨砚宁,毛明.利用紫甘蓝汁和pH传感器探究二氧化碳与氢氧化钠溶液的反应[J].化学教学,2016 (10):39-41.
[8]杨光梅,徐世银,傅雪伟,氢氧化钠与二氧化碳反应的实验设计——将反应由“看不见”变为“看得见”[J].中学化学教学参考,2017(20):51.
[9] 李梦龙.化学数据速查手册[M].北京:化学工业出版社,2003:151-152.

