柔肝化纤颗粒抑制肝纤维化大鼠脂质过氧化物生成及TGF-β1、Numb 表达的影响
吕艳杭,吴姗姗,王振常*,温智稀,段桂姣,符燕青,苏晓文,农小欣
(1.福建中医药大学附属龙岩市中医院,福建 龙岩 364200;2.广西中医药大学研究生学院,南宁 530222;3.广西国际壮医医院脾胃肝病科,南宁 530201)
肝纤维化是慢性肝病的共同病理阶段。适当的治疗措施可逆转肝纤维化或早期肝硬化的病理状态,控制肝纤维化的发展,对于肝硬化甚至肝癌的防治起着至关重要的作用[1-3]。前期研究[4-6]证实柔肝化纤颗粒能从多途径、多方位、多靶点抗肝纤维化作,具有健脾补肾柔肝、兼顾解毒活血、化痰软坚散结功效,具有抗肝纤维化作用,但该复方抗肝纤维化效果及机制尚不清晰。本研究采用经典的 CCl4复合因素建立肝纤维化大鼠模型为研究对象,探讨柔肝化纤颗粒预防大鼠肝纤维化作用机制,以期为中药新药的临床应用提供实验依据。
柔肝化纤颗粒由黄芪、牡蛎、黄精、枸杞、薏苡仁、橘红、泽兰、鸡内金、鳖甲、虎杖、牡丹皮、黑枣组成,具有抗氧化、抗炎及抗纤维化等多种药理和生物学作用[7-9]。黄芪健脾益气、利尿排毒,佐黄精加强补宜气血、健脾化湿功效;枸杞子滋养肝肾、益精明目,佐黑枣滋养阴血,二者共奏滋养阴血,补肾柔肝之效,肝体得养、阴血得充,恢复肝脏得功能,佐鸡内金加强益精之效;牡蛎软坚散结、平肝潜阳,合鳖甲加强软坚散结、活血化瘀、破血消癥之效,橘红燥湿化痰、通利三焦;泽兰芳香悦脾以扶气、行水肿,疏利悦肝以行血,具有活血化瘀而不伤正气,行血消肿而温中功效,橘红、泽兰、鳖甲、生牡蛎四者合用共奏“活血祛瘀、化痰散结”,主要通过“活血化痰”调整气血关系、达到“血和则经脉流行”;加虎杖化痰散瘀,清热解毒以除湿热瘀邪。本实验通过观察柔肝化纤颗粒对肝纤维化大鼠肝组织中TGF-β1及Numb 表达的影响,进一步阐明柔肝化纤颗粒预防大鼠肝纤维化的作用机制,为传统中药新药的开发与应用提供理论依据。
1 材料与方法
1.1 实验设计 采用随机抽取动物对照实验。
1.2 时间与实验地点 本实验于2018 年2 月-2019年10 月在广西中医药大学实验动物中心、广西中医药大学第一附属医院动物实验中心及医学分子生物学实验室、中医内科实验室完成。
1.3 材料
1.3.1 实验动物 成龄SPF 级Wistar 大鼠72 只,体质量在120~160 g,均购于广西医科大学实验动物研究所[动物实验合格证:SCXK(桂)2018-0001]。
1.3.2 药物 柔肝化纤颗粒方药组成:生黄芪45 g,黄精 20 g,生牡蛎 30 g,鳖甲 30 g,薏苡仁 45 g,枸杞子 20 g,橘红 12 g,泽兰 30 g,鸡内金 15 g,虎杖 20 g,黑枣 15 g。药物免煎颗粒剂由广西中医药大学第一附属医院药剂科提供,严格按照说明书上的克数进行换算。秋水仙碱(北京盛世康普化工技术研究所,生产批号:170821)。
1.3.3 主要仪器设备与试剂 仪器设备与试剂均由广西中医药大学及广西国际壮医医院提供。5417R 低温高速离心机,德国Eppendoff公司;IX71-22FL/PH 显微镜,日本OLYMPUS 公司;SHANDON 石蜡切片机,全自动生化分析仪(ES-480),南京颐兰贝生物科技有限公司。ROS,南京建成生物工程研究所,生产批号:20 160629;MDA 试剂盒,南京建成生物工程研究所,生产批号:20 170810;4-HNE 试剂盒,南京建成生物工程研究所,生产批号:32102;四氯化碳(CCl4)分析纯,中国医药集团上海化学试剂公司;花生油,山东烟台莱阳鲁花浓香花生油有限公司。
1.4 实验方法
1.4.1 动物分组 采用成龄SPF 级Wistar 大鼠72 只,雌雄各半,适应饲养1 周,随机分为6 组,取10 只大鼠作为正常对照组(不做任何处理,正常饲养),剩余62 只大鼠采用CCl4复合因素行肝纤维化造模,随机抽取2 只证实肝纤维化造模成功,取造模成功后的60 只大鼠随机分为肝纤维化模型组、秋水仙碱组、柔肝化纤颗粒低剂量组(2 mg/kg)、柔肝化纤颗粒中剂量组(4 mg/kg)、柔肝化纤颗粒高剂量组(8 mg/kg),每组12 只。
1.4.2 实验处理 本实验采用CCl4联合植物油混悬液复合因素诱导[10],进行肝纤维化造模,此法参照韩德五法进行改进,采用皮下注射40% CCl4(第1 次使用5 mL/kg 体质量,以后每隔3 天以每3 mL/kg 体质量,每周2 次,共8 周)皮下注射,联合高脂低蛋白食物(以玉米面为饲料,实验第1 周、第2 周加用0.5%胆固醇、20%猪油),为了防止肝纤维化自然修复对实验结果造成的影响,除正常对照组外,其余各组仍每周腹腔注射1 次40% CCl4油剂,每次3 mL/kg 体质量;正常对照组正常饲养,同时采用同体积花生油皮下注射8 周后灌胃予同体积的生理盐水,肝纤维化模型组造模成功8 周后予灌胃秋水仙碱,以0.01 mg/100 g 体质量给予,每周5 次,共8 周;柔肝化纤颗粒低剂量、中剂量、高剂量组造模8 周后分别灌胃柔肝化纤颗粒溶液(2、4、8 mg/kg),每周3 次,共8 周。
1.4.3 标本采集与处理 各组分别于用药8 周后,禁食12 h,经1%戊巴比妥麻醉,股静脉采血后处死,开腹剖取肝脏,每只均取肝脏右叶相同部位的组织置入10%的甲醛,另一部分于-80℃液氮速冻中保存待检。冻存的肝脏组织置于冰水浴中匀浆 10 min,制成 10%的组织匀浆,继以 3 000 r/min,离心半径为30 cm,离心 10~ 15 min,吸取上清液,测定ROS、MDA 及4-HNE 值。
1.5 实验室指标及检测方法
1.5.1 常规肝脏组织的病理学检测 取肝脏组织,使用4%多聚甲醛固定,梯度经久脱水,石蜡包埋,经组织切片后进行HE 染色及Masson 染色,封片后使用显微镜拍照,分析肝脏病理及纤维化情况。
1.5.2 各组肝功能指标检测 采用AU 5400 型全自动生化仪(美国Beckman Coulter 公司)检测大鼠血清AST、ALT、ALB、TBIL。
1.5.3 ROS、MDA 及4-HNE 检测 严格按照试剂盒说明书进行操作。
1.5.4 qRCR 检测 RNA 提取及逆转录PCR:将30 mg肝脏组织置于1 000 μL Trizol 裂解液(Solarbio,R1100)中,充分裂解混匀后,加入500 μL 氯仿,4℃,12 000 g 离心15 min 后400 μL 上层水相,加入400 μL异丙醇后,4℃,12 000 g 离心10 min 获得RNA 沉淀,经70%酒精洗涤后,晾干,使用无RNA 酶水进行溶解,使用超微量核酸检测仪(Suizhen,FC-1100)进行RNA 浓度及纯度检测,后按照逆转录试剂盒(Monad,RN05004M)说明书进行逆转录操作,所得cDNA 置于-20℃保存待用。引物序列与产物长度,见表1。

表1 引物序列及产物长度
qPCR 反应体系为:SYBR Green Premix Taq(Monad,RN04006M):5 uL,cDNA:1 uL,Primer Forward(10 uM):0.3ul,Primer Reverse(10 uM):0.3 uL,H2O:3.4 uL,反应程序:预处理95℃:30 s;PCR 循环(40 循环):95 ℃:5 s,60 ℃:30 s,72 ℃:15 s;溶解曲线:标准溶解曲线程序。实验仪器为ABI 7500 定量PCR 仪(ABI 7500)。经实验获得的数据使用SPSS 软件进行整理及分析,采用2-ΔΔCT法进行分析。
1.5.5 Western Blot 检测 组织蛋白提取:取30 mg 组织块置于离心管中,加入400 uL RIPA-PMSF 裂解液(Solarbio,R0010),匀浆后于4℃,12 000 rpm 离心5 min,取上清采用BCA 法测定蛋白含量。4×蛋白上样buffer(Solarbio,P1016)100 ℃变性5~10 min。蛋白电泳:80 V 恒压电泳约20 min,待样品进入分离胶层后,换用100 V 恒压电泳1~1.5 h;转膜:200 mA恒流转膜60~90 min。抗体孵育:用TBST(Solarbio,T1081)配制体积分数为8%的脱脂奶粉(Solarbio,D8340)作为封闭液,将膜放入封闭液中封闭3 h。按抗体说明书上的推荐比例使用封闭液将一抗[Anti-TGF-β1抗 体(Abcam,ab9628),Anti-Numb 抗 体(Abcam,ab84865)];Anti-β-actin 抗 体(Abcam,ab8227);抗进行稀释,将膜放入稀释后的一抗中4℃孵育12 h。一抗孵育完成后,使用TBST 洗膜3 次,每次15 min。将膜放入按1:3000 比例稀释的二抗(goat anti-rabbit:Abcam,ab6721)中37 ℃ 孵育1 h,使用TBST(Solarbio,T1081)洗膜3 次,每次15 min 使用ECL 显色剂(Solarbio,PE0010)对膜进行显色,于凝胶成像仪(Tanon,5200)中进行曝光成像。
1.6 统计学方法 采用SPSS 21.0 软件处理实验数据,均以均数±标准差()表示,各组间比较采用单因素方差分析,组间比较采用t检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 柔肝化纤颗粒可明显改善肝纤维化情况 经HE染色及Masson 染色,与模型组相比,秋水仙碱、柔肝化纤颗粒干预后,大鼠肝纤维化程度均有不同程度降低,秋水仙碱组、柔肝化纤颗粒高剂量组显著,见图1。

图1 肝组织石蜡切片HE 染色及Masson 染色观察肝纤维程度
2.2 大鼠血清中肝功能指标变化比较 见表2。
表2 大鼠血清中肝功能指标变化比较()

表2 大鼠血清中肝功能指标变化比较()
注:与正常组比较,# P <0.05,## P <0.01;与模型组比较,△△P <0.01;与秋水仙碱组比较,▲▲P <0.01
2.3 各组大鼠肝组织中ROS、MDA、4-HNE 指标变化比较 见表3。
表3 各组大鼠肝组织中ROS、MDA、4-HNE 指标变化比较()

表3 各组大鼠肝组织中ROS、MDA、4-HNE 指标变化比较()
注:与正常组比较,# P <0.05,## P <0.01;与模型组比较,△△P <0.01;与秋水仙碱组比较,▲▲P <0.01
2.4 各组大鼠肝组织 TGF-β1及Numb 含量指标变化比较 见表4。
表4 各组大鼠肝组织 TGF-β1 及Numb 含量指标变化比较(,n =10) %
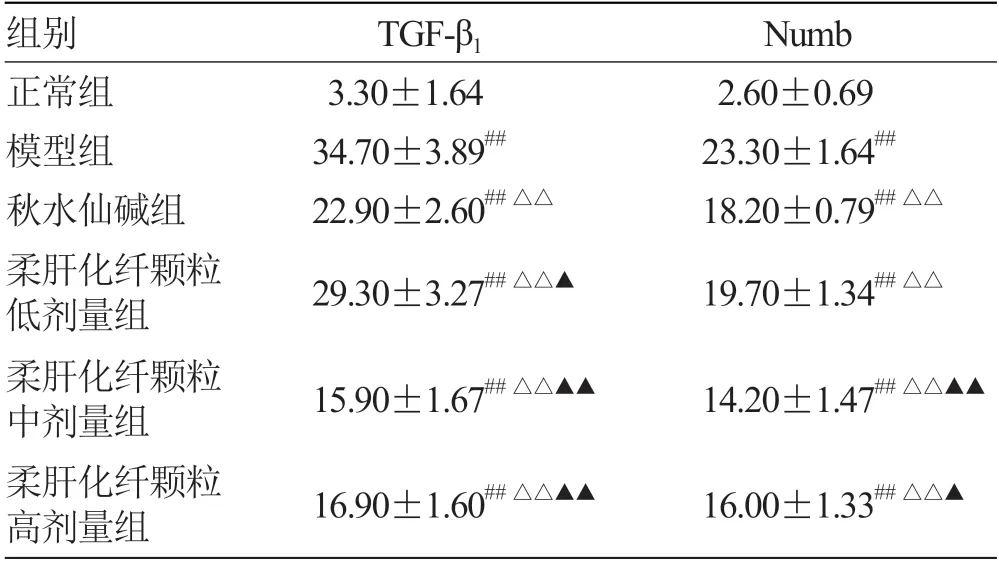
表4 各组大鼠肝组织 TGF-β1 及Numb 含量指标变化比较(,n =10) %
注:与正常组比较,## P <0.01;与模型组比较,△△P <0.01;与秋水仙碱组比较,▲▲P <0.01
2.5 各组大鼠肝组织 TGF-β1及Numb 蛋白表达变化比较 见表5。
表5 各组大鼠肝组织 TGF-β1 及Numb 蛋白表达变化比较()
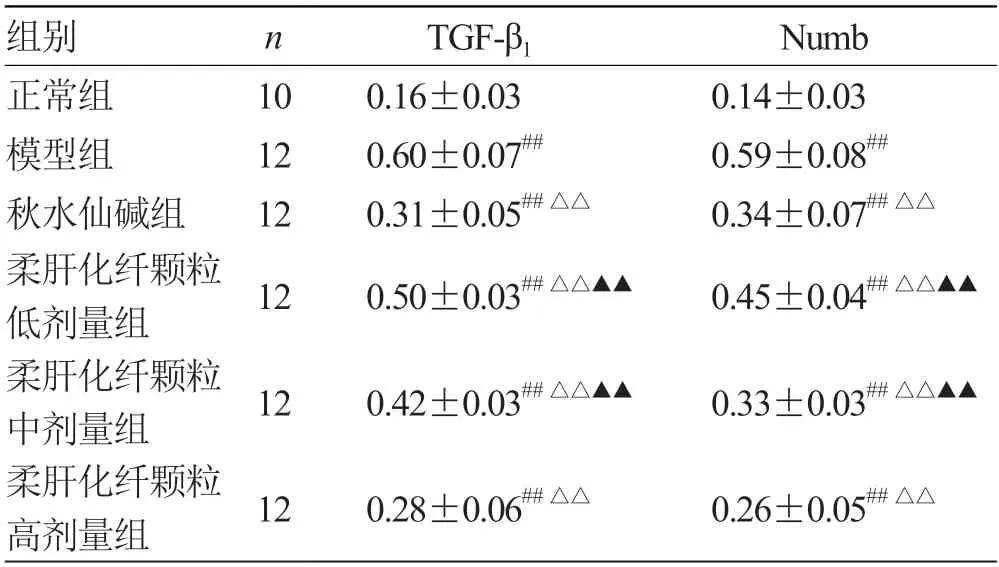
表5 各组大鼠肝组织 TGF-β1 及Numb 蛋白表达变化比较()
注:与正常组比较,## P <0.01;与模型组比较,△△P <0.01;与秋水仙碱组比较,▲▲P <0.01
3 讨论
肝纤维化是由各种损肝因素导致的肝脏内结缔组织异常增生的病理过程,具有肝细胞外基质(胶原蛋白、层黏连蛋白)的弥漫性沉积与异常分布及肝窦毛细血管化等病理特征,是各种慢性肝病向肝硬化甚至肝癌发展过程中的必经阶段,是影响慢性肝病预后的重要环节。研究[11]证实,参与肝纤维化的细胞有肝星状细胞(HSC)、肝巨噬细胞(Kuffer)、肝窦内皮细胞等,而肝星状细胞(HSC)的活化是肝纤维化的中心环节。正常情况下,肝星状细胞处于静息状态,当肝脏受到各种损肝因素刺激时,处于静息状态的HSC发生表型改变,即发生上皮-间质(EMT)转化。肝细胞受到刺激后受损凋亡可激活kuffer 细胞、窦内皮细胞,促使其分泌ROS、TGF-β1、TNF-α 等细胞因子,活性氧(ROS)可进一步激活HSC 而增加ECM 沉积,HSC 活化可启动脂质过氧化,形成大量的脂质过氧化物,如丙二醛(MDA)和4-羟基壬烯酸(4-HNE),可与蛋白质的特定氨基酸残基结合,形成加合物产生细胞免疫反应释放TGF-β1而激活HSC,王玲[12]研究证实HSC 培养中加入4-HNE 和MDA 培养基,发现可大幅度蛋白产物及胶原蛋白的表达,表明4-HNE 增加HSC 胶原生成的能力强于MDA。熊章鄂[13]研究发现ROS 可打破氧化-还原平衡,肝炎患者合并长期酗酒者其4-HNE、MDA 免疫球蛋白显著增加。于晨辉等[14]体内外实验研究表明,外源性4-HNE 与慢性酒精摄入在肝纤维化的发生发展过程中均起着至关重要的作用,4-HNE 可抑制TNF-α 介导的NF-κB 抗HSC 凋亡而诱导肝纤维化的形成。
肝纤维化发生时TGF-β1明显增多,TGF-β1可促进多条信号通路(Smad、Wnt、Notch)以及上调转录因子(NF-κB、Snail、Twist),以上信号通路及转录因子均可诱导基质金属蛋白酶MMPs、金属蛋白组织抑制因子TIMP 及血浆纤溶酶原活化抑制因子PAI使ECM 成分增多,刺激I 型及III 型胶原的产生或抑制DNA 合成及HSC 的凋亡[15]。杨博等[16]发现抑制TGF-β1表达可阻止肝纤维化的进展,甚至逆转。安祯祥等[17]研究显示TGF-β1质粒转染技术SiRNA 可显著降低肝纤维化大鼠中α-SMA 及胶原蛋白的表达,证实TGF-β1在肝纤维化的发生发展过程中起着至关重要的作用。研究[18-19]表明抑制TGF-β1及与其相关的信号通路可有效减轻甚至逆转肝纤维化。本研究证实,给予不同剂量的柔肝化纤颗粒抑制TGF-β1表达较肝纤维化模型组明显,进一步说明柔肝化纤颗粒可明显抑制TGF-β1表达而发挥肝纤维化的作用。
近年来,Numb 作为一种决定细胞命运的决定因子与Wnt、Notch、Hedgehog 等信号在肿瘤的发生发展中受到广泛关注,但是Numb 在肝纤维化发生中的作用尚未深入探讨。张旭等[20]研究发现胆汁淤积性肝纤维化的肝组织Numb 显著下降,Notch 信号通路异常活化。胥文等[21]文献报道了Numb 是Wnt 信号通路直接靶标,可抑制Notch 和Hedgehog 信号通路,在Notch-Wnt 信号转导方面起到“开关”作用,因此Numb 基因缺失可能通过阻断Notch-Wnt 信号通路传导而进一步诱导肝纤维化的进程。万赞燕等[22]发现Wnt3a 可诱导Numb,而在肝纤维化中,Hedgehog 信号作为经典Wnt 通路的调节,证实了在经典Hedgehog 和Wnt信号通路中共同调节了HSC 活化。虽然在肝纤维化中与Numb 联系尚未明确,但在肺、肾组织纤维化疾病中已证实。章智慧[23]研究发现,过表达的Numb 参与肺纤维化的上皮-间质转化的进展。刘伟等[24]研究结果显示,Numb 过表达在近端小管中会引起细胞周期停滞在G2/M,从而加重肾小管间质纤维化,进而加重肾纤维化。本研究发现,肝纤维化大鼠的肝脏中的Numb 在纤维间隔、肝细胞中大量表达,给予不同剂量的柔肝化纤颗粒干预,Numb表达较病理模型组减少。故抑制Numb 表达可能是柔肝化纤颗粒预防肝纤维化作用机制之一。
综上所述,本研究证实柔肝化纤颗粒能够显著减少脂质过氧化物、TGF-β1、Numb 的表达而发挥预防肝纤维化的作用,为柔肝化纤颗粒发挥抗肝纤维化的临床运用奠定基础,但其具体的作用机制需要我们进一步深入研究。

