酸性氧化电解水辅助提取槐米总黄酮工艺
王紫倩,高胜,王铭,衡娅萍,吴祯祯,任占冬,朱玉婵
(武汉轻工大学化学与环境工程学院,湖北武汉 430023)
槐米是豆科(Leguminosaesp.)植物槐(Sophora japonicaLinn)的蓓蕾采摘干燥后剔除枝梗及杂质所得的产物。槐米中不仅拥有种类丰富的黄酮类成分,像芦丁、槐二醇、槲皮素等,还有少量脂肪酸[1],使其在抗菌消炎、清热解毒、加快生命体新陈代谢[2]等方面具有显著的药理作用。黄酮类化合物对自由基的清除机制与目前最为常见的如BHA等这类合成抗氧剂大致相同。主要是利用自由基与氢结合,生成酚氧自由基。进一步再转变为半醌式自由基[3,4],并中断自由基链式反应,达到抑制脂类过氧化的功效。因此可以有效阻止自由基在体内的产生,减少基体的氧化损伤,是一种良好的天然非酶类抗氧化活性物质。在医药、食品和护肤品方面具有较好的运用价值[4]。
目前,植物中黄酮类物质的提取方法包括碱提酸沉法、乙醇回流法[5,6]等常用传统的方法。黄酮类化合物在乙醇中具有较好的溶解度,这使乙醇回流法不仅成本较低,无环境污染,操作简便,且产品安全,被广泛采用。在此基础上,为了进一步提高提取效率,更多的学者选择使用超声辅助,微波辅助和加压溶剂法[7,8]等方法进行辅助提取。但这些方法都是基于通过引入特殊仪器(超声、微波和加压)来提高提取效果。本文则从处理溶剂角度上进行考虑,在常规乙醇回流法过程前面引入酸性氧化电解水(acidic electrolyzed oxidizing water,AEOW)预处理步骤,希望能通过简单AEOW预处理过程起到破坏槐米植物细胞的作用,从而为后续乙醇回流萃取提供辅助提高作用。因为AEOW具备三大特点:低pH值、高氧化还原电位值、拥有一定的有效氯含量(available chlorine content, ACC)[9,10]。这使其可通过氧化作用破坏生物细胞表面结构,增加膜通透性[11-13],增加物质溶出效果。本文包括单因素实验和响应面法优化实验,确定了提取槐米总黄酮的最佳工艺。同时通过测定清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH)自由基和羟基自由基的效果,评估槐米黄酮的抗氧化能力。综上所述,本文旨在探究AEOW对槐米的预处理辅助提取作用,考察其对总黄酮提取的增效作用,为植物总黄酮提取方法提供一个新思路。
1 材料与方法
1.1 材料与试剂
槐米,本实验采购于武汉市药店。1,1-二苯-2-苦肼基(DPPH),分析纯,Macklin;芦丁(95%),国药试剂;乙醇、氯化钠、重铬酸钾、硫代硫酸钠、可溶性淀粉、硫酸、铬酸钾、氯化钾、氢氧化钠、硝酸铝、亚硝酸钠、水杨酸、硫酸亚铁的纯度均为分析纯,国药试剂。
1.2 仪器与设备
PS-3005D直流稳压电源,深圳兆信电子仪器设备厂;HJ-1型磁力搅拌器,荣华仪器制造有限公司;DF-101s(加深)集热式磁力搅拌器;SHZ-D型真空泵,上海力辰科技有限公司;BS210S型电子天平,德国赛多利斯集团;DHG-9147A型恒温干燥箱,上海精宏实验设备有限公司;721型可见分光光度计,上海菁华仪器有限公司;RE-52C型旋转蒸发仪,上海亚荣生化仪器厂;FW100型植物粉碎机,郑州科丰仪器设备有限公司。
1.3 实验方法
整个实验流程如图1所示,首先在自制电解槽中制备所需的酸性氧化电解水,其次利用酸性氧化电解水对槐米进行预处理,然后采用乙醇回流法提取黄酮类物质,最后通过分光光度法测试其体外抗氧化活性。
1.3.1 酸性氧化电解水的制备与测定
1.3.1.1 酸性氧化电解水的制备
参考文献[13]的方法,在图1所示的自制电解槽中,用均相阳离子交换膜将电解槽分隔为阴极区和阳极区。阴阳极分别是纯钛板和自制钌铱氧化物电极。电解过程中,以0.1%~0.2%的NaCl溶液(400 mL)为电解质,电极间距2 cm,电极有效面积3.50 cm2,电流密度为60~70 mA/cm2,电解电压为20 V。当电解时间分别为10、30、60、75和90 min时,制得的电解水有效氯含量分别是13.61、52.94、114.33、166.10、205.47 mg/L。利用酸度计测定其pH=2.00±0.10,氧化电位值为1100±50 mV。
1.3.1.2 有效氯含量的测定
采用碘量法进行测定。先对阴凉避光静置两周后的Na2S2O3溶液标定。取制得的酸性氧化电解水25 mL,加入KI固体0.50 g后移取2 mol/L的H2SO4溶液10 mL于碘量瓶中,暗处反应10 min。稀释标定后的Na2S2O3溶液,用其滴定至溶液为浅黄色时加入1 mL的1%淀粉溶液,继续滴定至蓝色刚好消失,滴定终点以半分钟内颜色不变为指标。记录所用Na2S2O3溶液体积V。有效氯含量计算公式:
1.3.2 槐米总黄酮的提取
将实验所购买的槐米用去离子水冲洗洗净,放入60 ℃的恒温干燥箱中干燥。用植物粉碎机进行粉碎并用50目筛过滤,获得试验所需槐米粉末。称取2 g,在一定的有效氯浓度和预处理时间条件下进行浸泡预处理,随后改变乙醇体积分数和液料比进行回流提取。回流2 h后将所得的提取液抽滤离心,并取定量上层清液,用60%的乙醇定容至100 mL,贮存备用。
1.3.3 总黄酮的测定
1.3.3.1 总黄酮标准曲线的制定
用分析天平精准称取10.0 mg的芦丁黄酮标准品,溶于95%乙醇中,制备1 g/L的芦丁标准储备液。分别取0、0.10、0.20、0.30、0.40、0.50和0.60 mL芦丁标准储备液,分别注入7个10 mL容量瓶中,依次标号0、l、2、3、4、5和6。加入5% NaNO2溶液l mL,摇匀,放置6 min;加入10% Al(NO3)3溶液l mL,摇匀,放置6 min;随后加入4% NaOH溶液5 mL,95%乙醇定容。放置15 min后,以0号容量瓶为参比对照,吸光度测于510 nm处。然后样品测定吸光度3~5次取其平均值。数据结果以芦丁的浓度为横坐标,测定的吸光度为纵坐标,可以求得标准曲线的线性回归方程Y=0.0101X+0.0069,R2=0.9996。
1.3.3.2 槐米总黄酮的测定
参照米智等[14]的方法。移取存贮液0.30 mL于50 mL容量瓶,纯水定容。根据“1.3.2.1”中所述操作。用标准曲线计算得出黄酮质量浓度和得率。
黄酮得率的计算公式:
式中:
γ——得率,mg/g;
c——计算出的黄酮质量浓度,mg/mL;
k——黄酮类物质提取液的稀释倍数;
v——总黄酮提取液的体积,mL;
m——样品总质量,g。
1.3.4 单因素试验设计
在确定提取温度70 ℃,提取时间120 min的条件下,分别设置不同单因素实验水平:有效氯浓度13.61、52.94、114.33、166.10、205.47和322.22 mg/L;预处理时间0、2、4、6和8 h;乙醇体积分数50%、60%、70%、80%和90%;液料比10:1、20:1、30:1、40:1和50:1 mL/g。探究其对总黄酮得率的影响,依据结果,确定最终响应面实验因素的具体水平。
1.3.5 响应面试验设计
依据单因素试验结果,将总黄酮得率作为实验响应值。利用软件Design-Expert,设定有效氯含量(A)、预处理时间(B)、乙醇体积分数(C)和液料比(D)为自变量的4因素3水平的响应面分析实验。实验共29个试验点(含5个重复试验为零点)。试验因素与水平设计见表1。

表1 响应面分析试验因素与水平Table 1 Factors and levels used in response surface analysis
1.3.6 槐米黄酮体外抗氧化活性试验
1.3.6.1 DPPH自由基的清除能力测定
参考文献[15]的方法并加以修改。取最佳条件下获得的黄酮提取液,用60%乙醇定容成100 mL,然后从中分别移取0.00、2.00、4.00、6.00、8.00和10.00 mL液体到比色管中,分别用去离子水稀释成10.00 mL。然后分别取4.00 mL样品稀释液和4.00 mL DPPH溶液(0.2 mmol/L)于比色管中,室温避光反应15 min,520 nm下测定吸光度值。
式中:
Ai——样品吸光度;
Ax——乙醇代替DPPH溶液吸光度;
A0——空白对照(纯水替代样品)。
1.3.6.2 羟基自由基的清除能力测定
参考文献[16]的方法并加以修改。配制不同浓度的提取液,依次加入FeSO4溶液(10.0 mmol/L)、H2O2溶液(8.8 mmol/L)、样品溶液和水杨酸溶液(10.0 mmol/L)各1.00 mL,用去离子水定容至10 mL。37 ℃水浴反应15 min后,510 nm处测定吸光度。
式中:
Ai——样品吸光度;
Ax——去离子水代替H2O2溶液吸光度;
A0——空白对照(纯水替代样品)。
1.4 数据处理
多次平行实验,采用Origin 2017和Design-Expert V8.0.6.1软件对试验进行数据处理分析与因素相互关系的作图。
2 结果与讨论
2.1 单因素试验结果
2.1.1 有效氯浓度
由图2可知,经酸性氧化电解水处理2 h后,槐米总黄酮得率最高为20.88%,其比纯水对照组(得率4.01%)得到了明显的提高。以此数据为进一步探究基础,评估槐米黄酮得率受不同有效氯浓度的酸性氧化电解水的影响。当有效氯含量分别为13.61、52.94、114.33、166.10、205.47和322.22 mg/L时,其黄酮得率分别为7.16%、8.92%、13.79%、17.20%、19.40%和20.88%。由数据可知,电解水中有效氯含量与总黄酮的得率成正相关关系。当有效氯从52.94 mg/L上升到205.47 mg/L时,总黄酮得率从8.92%增加到从19.40%,其增长率是117.49%;而当有效氯浓度从205.47 mg/L增加到322.22 mg/L时,其增长率仅为7.63%,即黄酮得率不再有明显的提高。这可能因为较高浓度的电解水具有一定的抑制性,同时会在一定程度上氧化破坏黄酮的结构[13,17],致使得率不再增加。
2.1.2 预处理时间
由图3可知,槐米经酸性氧化电解水浸泡预处理后,其总黄酮得率随时间增长呈现出先升后降的走向,并在2 h时达到最大值。如图2所示,当预处理时间从0 h增加到2 h时,槐米总黄酮得率从10.87%增加到最大值19.04%;但得率在预处理时间超过2 h后就开始下降。得率升高的原因是随着预处理时间的增加,酸性氧化电解水会加速生物细胞内物质的溶出,增大细胞膜的通透性[18,19],有益加快黄酮类物质溶出效果,进而提高得率。但浸泡时间过长时,会损坏黄酮类物质的部分结构,致使得率降低。因此,将预处理时间定在2 h比较合适。
2.1.3 乙醇体积分数
如图4所示,当乙醇体积分数不超过70%时,得率处于一直增加的趋势,并在70%时达到最大值。黄酮类物质是含有羟基的有机大分子,极性与乙醇较为接近[20,21],同时乙醇会增加植物细胞的组织渗透性,使细胞中的黄酮类物质充分溶解在溶液中,增加了其溶解性,进而使得率提升。然而乙醇体积分数过高时,不仅会使黄酮成分溶解,还促进了与乙醇分子结合的色素、醇溶性杂质等成分的溶出,与黄酮物质形成竞争关系,使得率降低。因此后期呈现明显下降现象。
2.1.4 液料比
如图5所示,当液料比10:1 mL/g变化到30:1 mL/g时,得率逐渐增大,且在液料比为30:1 mL/g时达到最大值18.44%。持续增大配比中的溶剂量,得率反而下降。出现这种现象是因为随着提取溶剂量的逐渐增大,槐米细胞与溶剂中的黄酮浓度差也会随之增大,同时增加了传质推动力[22],所以溶出的总黄酮类含量就会增加。但是当液料比达到30:1 mL/g后,槐米中大部分黄酮都已经被提取溶出进入溶剂之中,基本达到饱和状态,溶剂量的继续增加,使原本溶解到溶液中的黄酮质量浓度被稀释[21-23],得率下降。
2.2 响应面实验结果与分析
2.2.1 回归方程的建立
根据表2设计的因素和水平,以槐米总黄酮得率(Y)为响应值,自变量选择有效氯含量(A)、预处理时间(B)、乙醇体积分数(C)、液料比(D),采用BBD实验设计法进行响应面设计。实验结果如表2所示。对黄酮得率与有效氯浓度、预处理时间、乙醇体积分数和液料比之间的作用关系进行回归分析。得到回归方程:Y=18.95+0.56A+0.50B-0.19C+0.18D+ 0.53AB-1.30AC+0.95AD+0.50BC+0.33BD-0.27CD- 0.81A2-0.86B2-0.80C2-1.16D2,其中Y为黄酮得率的预测值。

表2 响应面试验设计及结果分析Table 2 Design and analysis results of response surface experiments
2.2.2 回归方程的验证
如表3所示,对上述回归方程进行了方差分析校验。由图可知,模型的p<0.0001,并且决定系数R2=0.9543,R2adj=0.9086,说明该模型极显著。同时,失拟项不显著(p=0.1266>0.05),在统计学上有意义。该回归模型与实际提取过程具有极高的拟合程度,可用于分析总黄酮得率随因素变化的趋势及产率预测。
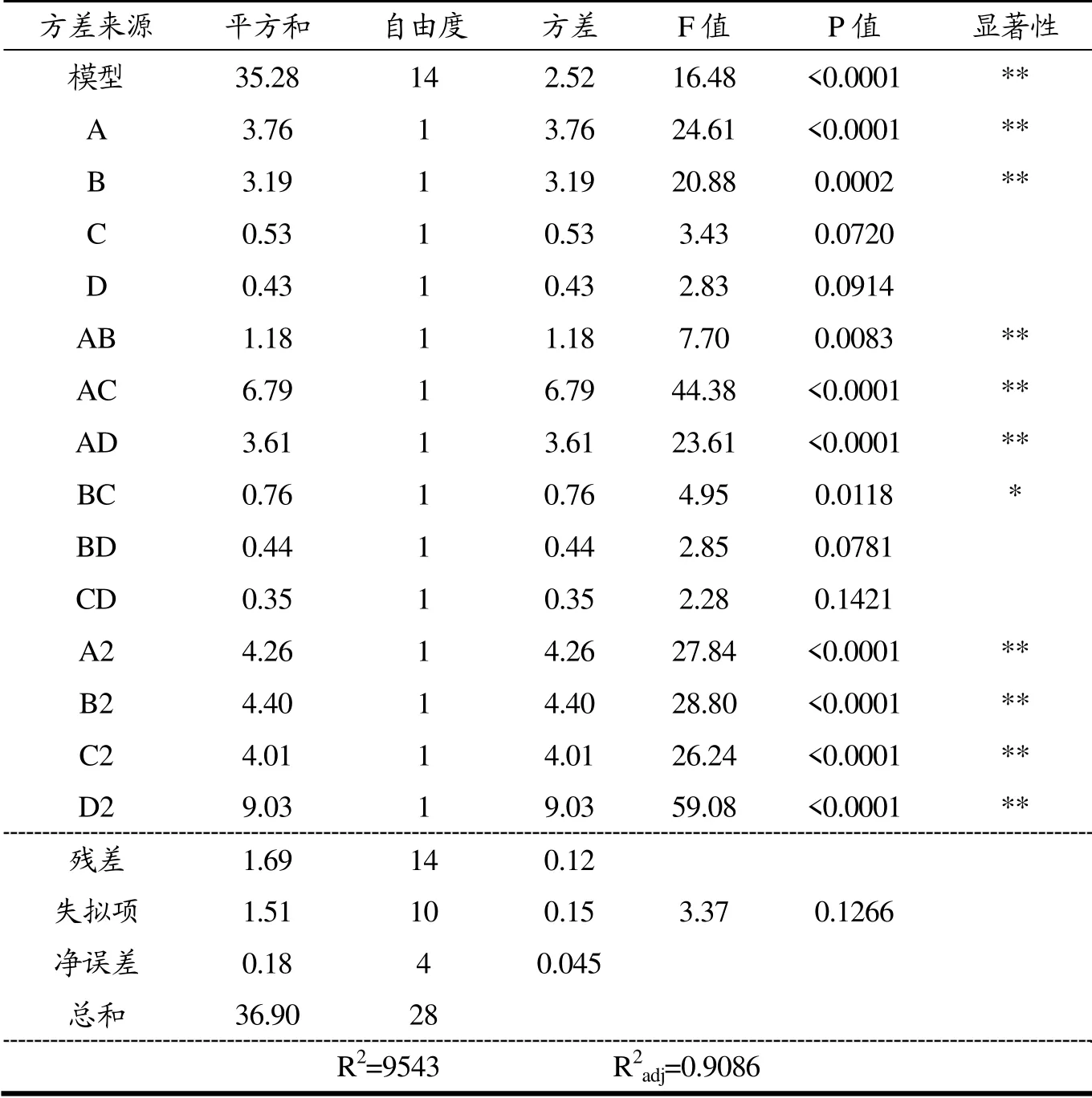
表3 回归模型方差分析Table 3 Variance analysis of regression model
四个因素对黄酮得率影响的主次关系可以通过F值的大小分别进行判定:A(有效氯含量)>B(预处理时间)>C(乙醇体积分数)>D(液料比)。其中因素A、B,交互作用项AB、AC、AD和二次项A2、B2、C2、D2对试验指标有极为显著的影响(p<0.01),交互作用项BC对试验有显著的影响(p<0.05),其余项对试验指标的影响则不显著。
2.2.3 响应面分析
利用Design-Expert软件,针对各因素之间的交互 作用关系进行分析,并作出响应曲面和等高线图。响应曲面中所示的陡峭程度和等高线椭圆率数值大小可以有效的判断出因素之间交互作用关系强弱的程度。曲面越陡峭,等高线椭圆率越大[22,23],则可证明交互关系越显著。由图6、图7和图8可看出,交互作用AB、AC、AD的响应曲面陡峭且图中的等高线较为扁平,椭圆率较大,因此证实了以上三种交互作用对总黄酮得率有较为显著的影响。其余图中响应曲面比较平滑,椭圆率较小,说明交互作用BC、BD、CD对响应值的影响较小。
2.2.4 试验结果验证
依据响应面所示模型和结果分析,得到提取槐米总黄酮的最优工艺:有效氯浓度250.00 mg/L,预处理时间161.70 min,乙醇体积分数60.93%,液料比36.63:1 mL/g,在此条件下槐米总黄酮的得率最高,可达20.00%。因此最佳工艺调整为:有效氯浓度250.00 mg/L,预处理时间162 min,乙醇体积分数61%,液料比37:1 mL/g,在此条件下重复进行3次试验。结果表明,在最优实验工艺条件下,黄酮平均得率为19.67%,与估测值相差0.33%,说明该模型可靠性较高,可以较好模拟槐米总黄酮的提取条件,且预测的黄酮得率准确。
目前,已报道的辅助提取技术有超声波、微波和加压等。其中,张堃等[24]利用超声波辅助提取槐米黄酮,得到乙醇浓度70%,温度25 ℃,超声提取时间35 min,料液比1:40 g/mL的最佳提取条件,此工艺下槐米黄酮得率为15.47%。初丽媛[25]采用加压溶剂提取法,得到最优工艺是温度130 ℃,料液比1:40 g/mL,时间20 min,乙醇体积分数50%,压力0.4 MPa,槐米黄酮得率为19.40%。肖梦媛等[6]通过正交实验设计法比较了醇提法、超声波提取和微波提取三种常见提取槐米总黄酮的工艺,其中最佳工艺下得率分别是10.40%、2.49%和8.18%。本文采用的酸性氧化电解水预处理-乙醇回流两步提取法,能较大幅度地提高总黄酮得率,并优于常见的辅助提取方法。另外,该方法不需要使用超声波、微波等特殊仪器,预处理过程简单,可操作性强,其为植物中总黄酮的提取提供一个新思路。
2.3 槐米总黄酮抗氧化活性测定结果
2.3.1 DPPH自由基清除能力分析
黄酮类物质可以提供质子与DPPH自由基结合而形成一种稳定的抗磁性分子,降低DPPH自由基的含量[26]。由表4数据可知,提取液中总黄酮的浓度和对DPPH自由基的清除率成正相关关系。在提取液中总黄酮的浓度为2.36 mg/mL时,清除率达到最大值96.38%±0.48%。即使浓度降低到0.47 mg/mL,相应的清除率仍达到91.86%±0.32%。Jun X等[3]探讨了在PSE条件下得到的槐米黄酮类物质对DPPH自由基清除效果,证实其浓度与清除率的显著相关性,当提取物浓度由0.1 mg/mL上升到0.9 mg/mL时,清除率从29.56%±2.48%增加到90.5%±2.92%。与本文结果相近,说明槐米总黄酮在抗氧化方面有较大的应用价值。
2.3.2 羟基自由基清除能力分析
羟基自由基是一种易使蛋白质、脂类等物质发生氧化损伤的活跃自由基[27]。清除羟基自由基在人体内的产生可以有效的提高机体抗氧化性能。表4数据表明,随着提取液中总黄酮浓度的增加,对羟基自由基清除率逐渐升高,呈现不断上升的趋势。当浓度达到2.36 mg/mL时,清除率高达92.30%±0.24%,且当浓度大于0.40 mg/mL时,其对羟基自由基的清除率均在85%以上。王益莉等[1]研究发现槐米提取液在1 mg/mL的浓度下对羟基自由基的清除率约为89.00%,这说明槐米总黄酮具有较为良好的抗氧化效果。
3 结论
试验采用自制酸性氧化电解水对槐米进行预处理后,采取乙醇回流法提取槐米中的黄酮类化合物,并探究其体外抗氧化活性。依据单因素实验所得出的结果,设计响应面实验,分析得出最佳提取槐米总黄酮的工艺参数:即有效氯浓度250 mg/L,预处理时间161.70 min,乙醇体积分数60.93%,液料比36.63:1 mL/g,在此工艺下得率为19.67%,与模型预期值仅差0.33%,证实了该工艺可行。实验利用酸性氧化电解水(有效氯含量ACC=205.40 mg/L)对样品进行浸泡预处理,在相同条件下,比实验中对照组提高4.84倍,说明预处理效果显著。另外,槐米总黄酮清除DPPH自由基和羟基自由基的效果随其浓度的上升而增强。当黄酮浓度达到2.36 mg/mL时,清除DPPH自由基与羟基自由基效率最高可分别达96.38%和92.30%,这表明槐米黄酮提取液具有良好的抗氧化活性。本研究结果将为植物黄酮类成分提取提供一个较为新颖的思路,为其得率的提高方法提供新依据。

