基于斑马鱼生物模型评价青钱柳的降糖作用
刘均,李强,谭蓉
(中华全国供销合作总社杭州茶叶研究院,浙江省茶资源跨界应用技术重点实验室,浙江杭州 310016)
斑马鱼(Zebrafish)是一种脊椎模式生物,与人类基因具有高度相似性,同时具有个体小、发育周期短、实验周期短、费用低、单次产卵数较高、实验用药量小等显著优势,已成为生命科学研究的新宠,并广泛用于构建人类的各种疾病和肿瘤模型,建立药物筛选和治疗的研究平台。利用斑马鱼构建的人类疾病模型,属于从事在体研究,可以作为连接非脊椎动物(细胞等)和哺乳动物(大小鼠等)实验之间的巨大生物学断层,完善现有药物研发体系。截止目前,以斑马鱼为对象,可以成功构建糖尿病[1,2]、高血脂[3,4]、高尿酸症[5,6]、失眠[7,8]等生物模型,并可以有效开展靶向药物筛选以及药物安全与毒理评价研究。在糖尿病斑马鱼模型建立方面,目前主要以斑马鱼成鱼为主,如采用腹腔注射四氧嘧啶(Alloxan,ALX)或链脲佐菌素[9,10],或采用ALX与高糖溶液联合诱导[11],再或者采用过度饲喂法[12]建立糖尿病模型。Shin等[11]以斑马鱼成鱼为对象,研究不同浓度ALX(1、2、3、4 mg/mL)溶液孵育不同时间(10、20、30 min),以及研究不同浓度葡萄糖(GLU,1%、2%、3%)溶液孵育不同时间(30 min,1、2、3 h)对血糖的影响,最终认为先以3 mg/mL ALX溶液诱导30 min,再用1% GLU溶液孵育30 min,最后在水溶液中孵育1 h可以诱导建立斑马鱼高血糖模型。Zang等[12]以4~6月龄斑马鱼成鱼为对象,采用过度饲喂法,探讨建立2型糖尿病斑马鱼生物模型。研究发现,相比每天喂食1次,采用过度饲喂法每天喂食6次的鱼空腹血糖水平显著增加,并且经腹腔和口服糖耐量试验结果表明过度饲喂法下斑马鱼出现糖耐量受损,而且经抗糖尿病治疗药物二甲双弧和格列美脲治疗具有降糖效用,表明以此方式可以建立2型糖尿病斑马鱼模型。但是,目前以斑马鱼幼鱼为对象,开展糖尿病斑马鱼生物模型构建方面的研究报道还较为鲜见。
青钱柳(Cyclocarya paliurus,CP)属于胡桃科、青钱柳属植物,同时也属于古老珍稀树种,仅存于中国,科学研究表明CP具有显著降血糖的功能特性[13-15]。因此,本文以5 dpf(days post fertilization)斑马鱼为对象,采用单糖GLU单独或与ALX诱导药物联合建立基于正常生理和病理生理的糖代谢异常斑马鱼生物模型,并以此模型为基础开展CP降糖作用评价,为健康功能饮品开发提供基础理论和基础数据支撑,同时也为高通量斑马鱼降糖药物筛选及复方产品开发提供多方案参考。
1 材料与方法
1.1 实验材料
1.1.1 主要仪器及试剂
Multiskan SkyHigh酶标仪,赛默飞世尔科技(中国)有限公司;GLU检测试剂盒(GLU氧化酶法),南京建成生物工程研究所;全自动智能型生化(霉菌)培养箱,天津市宏诺仪器有限公司;3K1S离心机,德国sigma离心机公司;AL-204精密电子天平,梅特勒-托利多国际贸易(上海)有限公司;MY-20手持式高速匀浆机,上海净信实业发展有限公司;水浴锅,上海精宏实验设备有限公司。
GLU(国药集团化学试剂有限公司):10 mg/mL溶液制备,称取1.00 g GLU于烧杯中,加入蒸馏水搅拌溶解并定容至100 mL容量瓶中,冷藏备用。
ALX(CAS号:2244-11-3,纯度≥98.0%):144 μg/mL ALX母液制备,称量0.0144 g ALX于烧杯中,加入蒸馏水搅拌溶解并定容于100 mL容量瓶中,冷藏备用。准确量取0、1.25、2.50、5.00、10.00、12.50、25.00、50.00 mL上述144 μg/mL ALX母液,加蒸馏水定容至50 mL,分别制成0、3.60、7.20、14.40、28.80、36.00、72.00 μg/mL的ALX溶液,用于斑马鱼对ALX药物耐受性的影响研究。
青钱柳(CP,文成县泉山中药材种植有限公司):50 mg/mL CP(以生药量计)贮备液制备,称取5 g CP于烧杯中,在80 ℃恒温水浴锅中浸提3次,每次浸提30 min,合并滤液并定容至100 mL制得50 mg/mL CP(以生药量计)储备液,保存于4 ℃冷藏备用。准确量取0、0.025、0.050、0.10、0.20、0.40、0.80、1.00、2.00、4.00、8.00和10.00 mL上述CP储备液,加蒸馏水定容至50 mL,分别制成0、25、50、100、200、400、800、1000、2000、4000、8000、10000 μg/mL的CP溶液,用于开展斑马鱼对不同浓度CP溶液耐受性的影响研究。
阿卡波糖(Acarbose,ACA,拜耳医药保健有限公司):50 mg/mL ACA(以生药量计)贮备液制备,称取5 g ACA于烧杯中,加入蒸馏水搅拌溶解过滤后定容至100 mL制得50 mg/mL ACA(以生药量计)储备液,保存于4 ℃冷藏备用。准确量取0.20、0.40、0.80 mL上述ACA储备液,加蒸馏水定容至50 mL,分别制成200、400、800 μg/mL的ACA溶液,用于开展降糖功效评价研究。三卡因甲磺酸(CAS号:886-86-2),上海阿拉丁生化科技股份有限公司;磷酸缓冲盐溶液(pH 7.02),南京建成生物工程研究所。
1.1.2 实验动物
斑马鱼(3月龄,AB型),上海费曦生物科技有限公司。斑马鱼胚胎的繁殖以自然交配方式进行。每个产卵盒中按1:1放入公鱼和母鱼,放入28.5 ℃恒温培养箱中,光照设置为14 h光照和10 h黑暗,于第二天上午收集胚胎,去除死卵和粪便,清洗后换孵育水(60 µg/mL海盐水),置于28.5 ℃恒温培养箱中孵育,每24 h换水一次,去掉卵膜和死卵。实验完成后,用0.017%三卡因甲磺酸暴露将斑马鱼麻醉处死。
1.2 实验方法
1.2.1 斑马鱼对GLU和ALX的耐受性分析研究
本研究拟以GLU单独或者与ALX联用建立糖代谢异常斑马鱼(幼鱼)模型,因幼鱼对GLU与ALX的耐药性的影响尚无参考依据,故开展斑马鱼幼鱼对GLU与ALX耐受性的影响研究,为下一步建模方案提供基础信息。(1)斑马鱼幼鱼对GLU耐受性影响:将5 dpf野生型AB系斑马鱼随机分为6组,每组3个重复,每个重复30条,分别给予0、10、20、40、80、100 mg/mL GLU溶液;(2)斑马鱼幼鱼对ALX耐受性影响:将5 dpf野生型AB系斑马鱼随机分为为7组,每组3个重复,每个重复45条,分别给予0、3.60、7.20、14.40、28.80、36.00、72.00 μg/mL溶液。培养24 h记录死亡数量计算死亡率,探讨斑马鱼对GLU和ALX耐受性的影响并指导开展糖尿病斑马鱼建模方案研究。
1.2.2 GLU与ALX联合建立糖尿病斑马鱼模型可行性及有效性分析
1.2.2.1 糖尿病斑马鱼建模可行性研究
基于上述斑马鱼对GLU和ALX耐受性的影响结果,优选10 mg/mL GLU与3.60或7.20 μg/mL药物组合开展糖尿病斑马鱼(幼鱼)建模方案研究。将5 dpf野生型AB系斑马鱼随机分为4组,分别记为BC1、BC2、MC1、MC2,每组3个重复,每个重复20条,分别给予0 mg/mL GLU+0.00 μg/mL、10 mg/mL GLU+0.00 μg/mL、10 mg/mL GLU+3.60 μg/mL、10 mg/mL GLU+7.20 μg/mL溶液,每孔加药物8 mL,培养24 h,取9条用于测定GLU含量,探究GLU与ALX联合建立糖尿病斑马鱼模型的可行性。
1.2.2.2 糖尿病斑马鱼建模有效性分析
ACA是常见的糖尿病治疗药物,因此选用ACA干预以评价糖尿病建模方案的有效性。将5 dpf野生型AB系斑马鱼给予10 mg/mL GLU+3.60 μg/mL溶液孵育24 h以建立糖尿病模型,然后随机分为5组,分别记为MC1、T1、T2、T3,每组3个重复,每个重复20条,分别给予10 mg/mL GLU、10 mg/mL GLU+200 μg/mL ACA、10 mg/mL GLU+400 μg/mL ACA、10 mg/mL GLU+800 μg/mL ACA溶液,每孔加药物8 mL。同步设置0 mg/mL GLU孵育48 h(孵育24 h时换水一次)作为BC1空白对照组。培养结束后,每个重复取10条用于测定GLU含量,探究GLU与ALX联合建立糖尿病斑马鱼模型的有效性。
1.2.3 斑马鱼对CP的耐受性分析研究
将5 dpf野生型AB系斑马鱼随机分为12组,每组3个重复,每个重复30条,分别给予0、25、50、100、200、400、800、1000、2000、4000、8000、10000 μg/mL CP溶液(以生药量计),每孔加药物10 mL,每24 h换水一次,记录死亡数量,计算每组死亡率,优选剂量作为降糖作用评价用剂量浓度。
1.2.4 CP对基于正常生理和病理生理的斑马鱼模型的降糖作用研究
1.2.4.1 CP对高糖诱导正常斑马鱼模型降糖作用的影响
根据斑马鱼对CP的耐受性分析结果,按照CP的10%~25% LC50推荐可用于降糖作用评估的剂量浓度并对剂量浓度略作调整,下限调整为200 μg/mL,并按照倍数关系设置400和800 μg/mL作为梯度设计开展CP降糖作用研究。将5 dpf野生型AB系斑马鱼随机分为5组,分别记为BC1、BC2、T1、T2、T3,每组3个重复,每个重复20条,分别给予0 mg/mL GLU+0 μg/mL CP、10 mg/mL GLU+0 μg/mL CP、10 mg/mL GLU+200 μg/mL CP、10 mg/mL GLU+400 μg/mL CP、10 mg/mL GLU+800 μg/mL CP溶液,每孔加药物8 mL,培养24 h,取10条用于测定GLU含量,探究CP对高糖诱导斑马鱼模型降糖作用的影响。
1.2.4.2 CP处理对胰岛损伤糖尿病糖斑马鱼模型降糖作用的影响
将5 dpf野生型AB系斑马鱼,给予10 mg/mL GLU+3.60 μg/mL联合孵育24 h以诱导建立糖尿病模型,然后随机分成分为5组,分别记为MC1、T1、T2、T3、T4,每组3个重复,每个重复20条,分别给予10 mg/mL GLU、10 mg/mL GLU+200 μg/mL CP、10 mg/mL GLU+400 μg/mL CP、10 mg/mL GLU+800μg/mL CP、10 mg/mL GLU+400 μg/mL ACA孵育24 h,每孔加药8 mL。同步设置0 mg/mL GLU、10 mg/mL GLU孵育48 h(孵育24 h时换水一次)作为空白对照组,分别记为BC1和BC2。培养结束后,每个重复取10条鱼用于测定GLU含量,探究CP处理对糖尿病斑马鱼模型降糖作用的影响。
1.3 检测方法
GLU含量检测按如下步骤进行:取0.1 mL PBS缓冲液于装鱼的1.5 mL离心管中,采用高速手持式匀浆机匀浆直至鱼体组织裂解充分,然后于4 ℃下以2500 r/min离心10 min,结束后取上清样2.5 μL采用GLU检测试剂盒(GLU氧化酶法)测定GLU浓度,其测定程序和方法按照试剂盒说明书规定的步骤进行。
1.4 统计分析
所有试验数据经Excel 2016处理后,用Graphpad Prism 6.0绘图,并用SPSS Statistics 17.0进行单因素方差分析(One-way ANOVA),所有数据均以平均值±标准差呈现,差异显著性采用Duncan分析并将进行多重比较,p<0.05表示组间差异显著。在药物耐受性分析方面,利用SPSS 17.0软件中PROBIT程序计算其半数致死浓度(Median lethal concentration,LC50)。
2 结果与讨论
2.1 斑马鱼对GLU和ALX的耐受性分析
不同浓度GLU和ALX对斑马鱼死亡率的影响见图1。从图1中可以看出,斑马鱼幼鱼对高浓度GLU和ALX具有不耐受性,当GLU浓度大于等于40 mg/mL或ALX浓度大于等于36.00 μg/mL时死亡率达到100%。10 mg/mL GLU处理组死亡率为2.22%,3.60和7.20 μg/mL ALX处理组死亡率分别为2.22%和4.44%。研究表明,为成功构建基于正常生理和病理生理的糖代谢异常斑马鱼模型,GLU宜选用剂量浓度为10 mg/mL,ALX的宜选用剂量浓度3.60和7.20 μg/mL。
2.2 GLU与ALX联合建立糖尿病斑马鱼模型性及有效性分析研究
综合斑马鱼对GLU耐受性和ALX耐受性特点,选取10 mg/mL GLU溶液为糖源,并与3.60和7.20 μg/mL ALX联合探讨建立糖尿病模型的可行性,结果见图2a。研究发现,相比BC1组,BC2组斑马鱼组织GLU值显著增加,达到50.19%(p>0.05),表明以10 mg/mL GLU处理可以构建基于生理的糖代谢异常斑马鱼模型。此外,与BC1组相比,MC1和MC2组斑马鱼组织GLU值显著增加,分别增加了51.52%和68.32%,且差异均显著(p<0.05)。结果表明,以10 mg/mL GLU与3.60和7.20 μg/mL ALX作为药物联合可以用于构建基于病理的糖尿病斑马鱼模型的预选方式方法。
基于上述研究,选用10 mg/mL GLU与3.60 μg/mL溶液联合建立糖尿病模型并进行模型有效性分析,结果见图2b。从图2b中可以看出,与BC1组相比,MC1组斑马鱼GLU值显著增加,达到46.24%(p<0.05),再次验证了前期研究结果。与此同时,从糖尿病治疗药物-ACA治疗疗效方面看,相比MC1组,T1、T2和T3组斑马鱼GLU值显著降低,分别降低了27.28%、33.69%和38.75%,差异均显著(p<0.05)。结果显示在该模型下,ACA降糖效果显著,表明以此方式诱导建立的糖尿病模型是有效性的。
目前,以斑马鱼幼鱼为对象构建糖尿病模型还比较鲜见。可查阅对比的是劳乔聪等[13]的研究,他们以4 dpf斑马鱼为对象,采用40 mg/mL蔗糖作为糖源与144 μg/mL联用,并通过二甲双胍等4种常见糖尿病治疗药物进行模型有效性论证,表示以此方法可以成功并有效建立的糖尿病模型。另外,劳乔聪[16]以4 dpf斑马鱼对象,先后在1.008 mg/mL ALX与36 mg/mL GLU溶液联合下冲击1 h,144 μg/mL ALX与36 mg/mL GLU溶液联合下孵育48 h可以有效建立斑马鱼糖尿病模型。但与本研究相比,建模方案有明显差异,尤其是剂量浓度选用方面差异较大。研究发现随着孵育液中GLU剂量浓度的增加致死率明显上升,可能与试验使用的斑马鱼的品系、养殖体系参数、药物品种品质等不同有关,其具体的原因还需后续进一步的探索研究。另外,同采用类似经典的大小鼠糖尿病造模方式相比[11,12],本研究以斑马鱼幼鱼为对象构建的糖尿病斑马鱼模型更具有明显的可操作性和便捷性优势,并且成本更为节约。
2.3 斑马鱼对CP的耐受性分析
不同CP浓度对斑马鱼幼鱼死亡率的影响见图3。从图3中可以看出,斑马鱼幼鱼对高浓度CP溶液具有不耐受性,CP浓度大于等于4000 μg/mL时死亡率为100%。另外,从孵育时间上看,随着孵育时间的延长死亡率不断增加。以24 h基准,采用SPSS中PROBIT程序回归分析得出斑马鱼幼鱼的CP耐受性(表1)Probit模型:Probit(p)=-1.26667+0.00049x,按该模型计算得出CP的LC50为2582.82 μg/mL,95%可信范围为2166.95~3149.83 μg/mL。因而,若按照CP的10%~25% LC50推荐可用于降糖作用评估的剂量浓度为258.28~645.71 μg/mL。
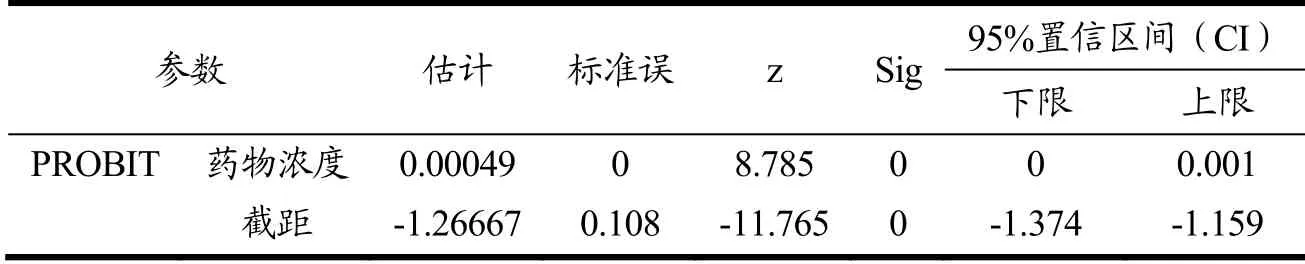
表1 斑马鱼幼鱼青钱柳耐受性影响的参数估计表Table 1 Parameter estimates of CP tolerance in zebrafish larvae
2.4 CP对基于正常生理和病理生理的斑马鱼模型的降糖作用研究
根据斑马鱼对CP耐受性的影响,按照CP的10%~25% LC50推荐略作调整,选用200、400和800 μg/mL剂量梯度组合开展CP降糖作用研究,其对基于正常生理和病理生理斑马鱼幼鱼GLU值的影响见图4。从图4a中可以看出,相比BC1组,BC2组斑马鱼组织GLU值明显增加,达到21.70%(p>0.05),与前期结果一致。另外,与BC2组相比,T1组对斑马鱼GLU含量影响较小,略微增加了7.77%(p>0.05),T1和T2组斑马鱼GLU值显著降低,且降低幅度分别达到了37.59%(p<0.05)和38.57%(p<0.05),表明在正常生理模型下较高浓度的CP具有明显的降糖效应。
从图4b中可以看出,相比BC1组,10 mg/mL GLU诱导48 h的BC2组斑马鱼GLU值显著增加(p<0.05),MC1组斑马鱼GLU值显著增加(p<0.05)。相比MC1组,T1、T2和T3组斑马鱼GLU值显著降低,分别降低了27.43%、32.75%和29.20%,差异均显著(p<0.05),表明在该病理模型下CP均表现出了明显的降糖效应(p<0.05)。
研究发现,400和800 μg/mL CP可以显著降低10 mg/mL GLU诱导的斑马鱼GLU值,以及200、400和800 μg/mL可以显著降低胰岛损伤型糖尿病斑马鱼GLU值,CP的降糖作用可能与减少GLU肠道内吸收,保护胰腺促进胰岛素分泌[14],改善胰岛素敏感性[15],增加体内GLU的消耗利用[17-19],保护并改善肝脏异常代谢[20,21],还可能与促进血脂稳定,增强抗氧化,保护胰腺等相关[22-24]。姚骏凯等[15]研究发现CP可以显著降低糖尿病大鼠空腹血糖和胰岛素抵抗指数,显著增加肝脏磷酸化胰岛素受体底物1/胰岛素受体底物1蛋白比值以及胰岛素受体底物1蛋白mRNA的表达。姚骏凯等[14]研究发现CP可以降低糖尿病大鼠胰腺可溶性细胞凋亡因子、可溶性细胞凋亡因子配体、活化半胱氨酸蛋白酶8含量以及总c-Jun氨基端激酶1和磷酸化c-Jun氨基端激酶1的表达量,表明CP降糖效应可能与抑制胰腺β细胞凋亡有关。肝脏在糖脂代谢中发挥重要作用。栗静等[20,21]研究发现CP可以通过改善肝脏异常代谢来预防糖尿病[14,15]。另外,劳乔聪[13]等利用斑马鱼模型开展CP降糖作用研究时表明1000和2000 μg/mL CP可以显著降低血糖值,且降糖效果呈浓度依赖性。因此,下一步将基于正常生理和病理生理生理的糖代谢异常模型,开展CP毒理学安全性评价和剂量学估算研究,尤其是借助斑马鱼幼体透明和可以进行活体染色的显著优势开展器官毒理损伤作用研究,靶器官损伤的保护和治疗作用研究,以及开展复方配伍降糖增效作用研究,为健康功能食品或饮品开发提供基础理论和基础数据支撑。
3 结论
5 dpf斑马鱼对高浓度的GLU、ALX和CP具有不耐受性。相比0 mg/mL GLU组,以10 mg/mL GLU与3.60或7.20 μg/mL ALX联合诱导造模24 h,可显著增加斑马鱼GLU值,分别增加了51.52%(p<0.05)和68.32%(p<0.05)。与模型对照组相比,经200、400和800 μg/mL ACA治疗评价斑马鱼GLU值分别降低了27.28%、33.69%和38.75%,差异均显著(p<0.05),表明以10 mg/mL GLU与3.60 μg/mL ALX联合孵育24 h可以有效建立糖尿病斑马鱼模型。另外,研究发现,400和800 μg/mL CP可以显著降低10 mg/mL GLU溶液诱导的斑马鱼GLU值,分别降低了37.59%(p<0.05)和38.57%(p<0.05);200、400和800 μg/mL CP可以显著降低糖尿病斑马鱼GLU值,分别降低了27.43%、32.75%和29.20%,差异均显著(p<0.05)。结果表明,基于正常生理和病理生理的斑马鱼生物模型评价,CP具有明显的降糖效应,其在辅助降糖功能饮品开发上具有广阔的应用前景。

