miR-142-3p靶向PERK/Bip信号通路对骨关节炎模型大鼠的干预作用
魏 萌,张英民,康少英,李建伟,王振兴,陈 伟
(邯郸市中心医院骨三科,河北 邯郸 056001)
骨关节炎是一种慢性致残性关节疾病,临床症状为关节痛、关节僵硬、关节功能障碍等[1]。有研究显示,骨关节炎在肥胖、中老年、超负荷运动人群中发病率较高,且多见于女性[2]。目前临床治疗此病多采取药物治疗,但疗效不佳,故寻找更好的替代疗法成为了亟需解决的问题[3]。微小RNAs(miRNAs)是一种单链内源性表达的、较小的非编码RNA,广泛存在于动植物及病毒中[4]。miRNAs在疾病的发生发展过程中起关键作用,且具有治疗疾病的潜力[5-6]。miR-142-3p是调节炎症通路的新因子,可抑制软骨细胞的凋亡[7]。有研究发现,miR-142-3p在骨关节炎中表达异常[8],而其异常表达可能为骨关节炎的早期诊断和治疗提供帮助。由于骨关节炎患者较高的致残率,早期诊断和后期干预治疗具有重要意义。miR-142-3p有望成为较理想的骨关节炎相关标志物,但是目前关于miR-142-3p如何干预骨关节炎的分子机制及其参与的信号通路尚不清楚。故本研究建立骨关节炎大鼠模型,通过调控miR-142-3p的表达,探究其对骨关节炎模型大鼠的干预作用,以期为骨关节炎的早期诊断、疾病监测和治疗提供参考。
1 材料与方法
1.1 材料
研究动物:60只SPF级健康雄性大鼠,由四川省疾病预防控制中心提供[动物许可证号:SYXK(川)2020-229],鼠龄7~8周,平均(7.63±0.65)周;体质量217~249 g,平均(232.29±21.07)g。所有大鼠均于室温(22~24)℃、湿度40%~70%、自然光照及通风、无病原菌的干净笼子中饲养,水和食物均经消毒,按统一标准饲养,允许自由活动,饲养1周。本实验经我院伦理委员会批准(批准号:HD-DWLL-2019-023)。
主要试剂:miR-142-3p mimic和miR-142-3p inhibitor由南通百奥迈科生物技术有限公司合成;白细胞介素1β(interleukin 1β,IL-1β)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自杭州铂赛生物科技有限公司(批号:BSH2021351A);肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)ELISA试剂盒购自上海韵泰信息科技有限公司(批号:YT202110831);小鼠抗大鼠蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)、免疫球蛋白结合蛋白(immune globulin binding protein,Bip)抗体购自上海西格生物科技有限公司(批号:XGK202145、XGK202157);小鼠抗大鼠Caspase-9抗体购自武汉益普生物科技有限公司(批号:ATA25899-53)。
1.2 方法
1.2.1 建模及分组 在60只大鼠中随机挑选15只作为空白组(空白组自然生长不做处理),其余45只大鼠采用前交叉韧带横断术诱导骨关节炎产生,建立骨关节炎大鼠模型:在全身麻醉下作内侧髌旁切口,将髌骨脱位,露出右膝关节,采用显微剪刀切断前交叉韧带,进行前抽屉试验以确保切断成功,复位髌骨后,依次缝合关节囊和皮肤,术后大鼠置于可自由活动的笼子中。建模过程中脱失6只,前抽屉试验呈阴性,剩余39只大鼠进行前抽屉试验均呈阳性,最终39只大鼠建模成功,随机分为模型组、下调组、上调组,每组13只。上调组大鼠膝部注射miR-142-3p mimic,下调组大鼠尾部注射miR-142-3p inhibitor,剂量均为100 ng/mg。空白组、模型组大鼠膝部注射等剂量生理盐水。
1.2.2 miR-142-3p转染效率鉴定 在miR-142-3p转染完成24 h后,采用实时荧光定量PCR检测miR-142-3p的转染效率,每组随机选取5只大鼠,使用6%水合氯醛(6 mL/kg)腹腔麻醉后处死,取膝关节软骨组织并提取RNA,逆转录获得cDNA。以U6为内参,miR-142-3p上游序列:5’-CGCCGTGTAGTGTTTCCTAC-3’,下游序列:5’-CAGTGCAGGGTCCGAGGT-3’;U6上游序列:5’-CTCGCTTCGGCAGCACA-3’,下游序列:5’-CGCTTCACGAATTTGCGT-3’。
1.2.3 HE染色 采用6%水合氯醛(6 mL/kg)腹腔麻醉各组大鼠,在右膝处切开皮肤,分离皮下筋膜组织,取其右侧膝关节新鲜软骨组织,以生理盐水冲洗,4%多聚甲醛固定,采用HE试剂盒对各组大鼠的右侧膝关节软骨组织样本进行染色,显微镜下观察膝关节软骨组织病理学变化。
1.2.4 膝关节活动度、压痛阈值、热痛阈值检测 观察并比较各组大鼠膝关节活动度,其中空白组10只,模型组、上调组、下调组各8只,采用YLS-3E电子压痛仪测定各组大鼠压痛阈值,采用足底热痛测试仪测定大鼠两侧足后趾热痛阈值,以大鼠疼痛后嘶鸣作为痛阈指标,压痛阈值、热痛阈值均测定3次,每次间隔5~10 min,取均值。
1.2.5 ELISA检测 采集各组大鼠腹动脉血2 mL,离心分离血清,参照IL-1β、TNF-α的ELISA试剂盒说明书吸取上清液进行加样及后续操作。实验步骤:制作标准品,按照梯度稀释标准品;对应板孔中加入100 μL标准品工作液或样本,37 ℃孵育2 h后立即加入100 μL生物素化抗体工作液;反应板洗涤3次,每孔加抗体工作液100 μL,35 ℃温育45 min;将100 μL TMB溶液加入反应孔,35 ℃反应45 min,加入终止液,采用酶标仪检测上述指标水平(颜色深浅与上述指标水平成正比)。
1.2.6 实时荧光定量PCR 待测血清采用Trizol法进行总RNA提取,并使用核酸蛋白检测仪进行浓度检测;逆转录后进行PCR,依次加入Mix 10 mL、上游引物1 mL、下游引物1 mL、RNAase free水7 mL、cDNA 1 mL,每管20 mL。转化生长因子-β(transforming growth factor-β,TGF-β)上游引物:5’-TGCACCGCAACAACGCAATCT-3’,下游引物:5’-TTCTGGCACTGCTTCCCGAATG-3’;Ⅰ型胶原α1(collagen type Ⅰ α1,COL1α1)上游引物:5’-TTGGTCCTGCTGGCAAGAATGG-3’,下游引物:5’-TCTGTCACCTTGTTCGCCTGTC-3’;金属蛋白酶组织抑制因子1(tissue inhibitor of metalloproteinase 1,TIMP1)上游引物:5’-TGTTTCCCTGTTCAGCCATCCC-3’,下游引物:5’-GGTAGCCCTTCTCAGAGCCCAT-3’;内参GAPDH上游引物:5’-AGGTTGTCTCCTGTGACTTCAA-3’,下游引物:5’-CTGTTGCTGTAGCCATATTCATTG-3’。PCR反应条件:预变性95 ℃ 5 min,94 ℃ 20 s,56 ℃ 20 s,72 ℃ 1 min,40个循环;72 ℃终末延伸6 min。采用2-ΔΔCt法计算TGF-β、COL1α1、TIMP1的相对表达量。
1.2.7 Western blot 在各组膝软骨组织研磨匀浆样本中加入蛋白提取液提取总蛋白,采用BCA法对PERK/Bip信号通路蛋白进行定量检测,取10 μL蛋白进行SDS-PAGE电泳、转膜,加入适量一抗(兔源PERK、Bip、Caspase-9)封闭,4 ℃过夜孵育,TBST洗涤标本,加入适量二抗(羊抗兔IgG)室温孵育1 h,各组标本洗膜,加入等体积化学发光液A液、B液与PAGE膜反应,曝光显影,内参蛋白为GAPDH。
1.3 统计学处理

2 结果
2.1 转染效率鉴定
与空白组相比,其他各组大鼠miR-142-3p表达量较低,差异均有统计学意义(P<0.05);与模型组相比,下调组miR-142-3p表达量较低,差异有统计学意义(P<0.05);与模型组和下调组比较,上调组miR-142-3p表达量较高,差异均有统计学意义(P<0.05),提示miR-142-3p转染成功,见表1。
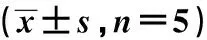
表1 转染效率鉴定
2.2 各组大鼠膝关节软骨组织病理学观察
空白组大鼠膝关节软骨组织清晰、完整;模型组、下调组大鼠软骨退变,软骨面减少,正常软骨结构丧失;上调组大鼠软骨形态、结构明显恢复,见图1。
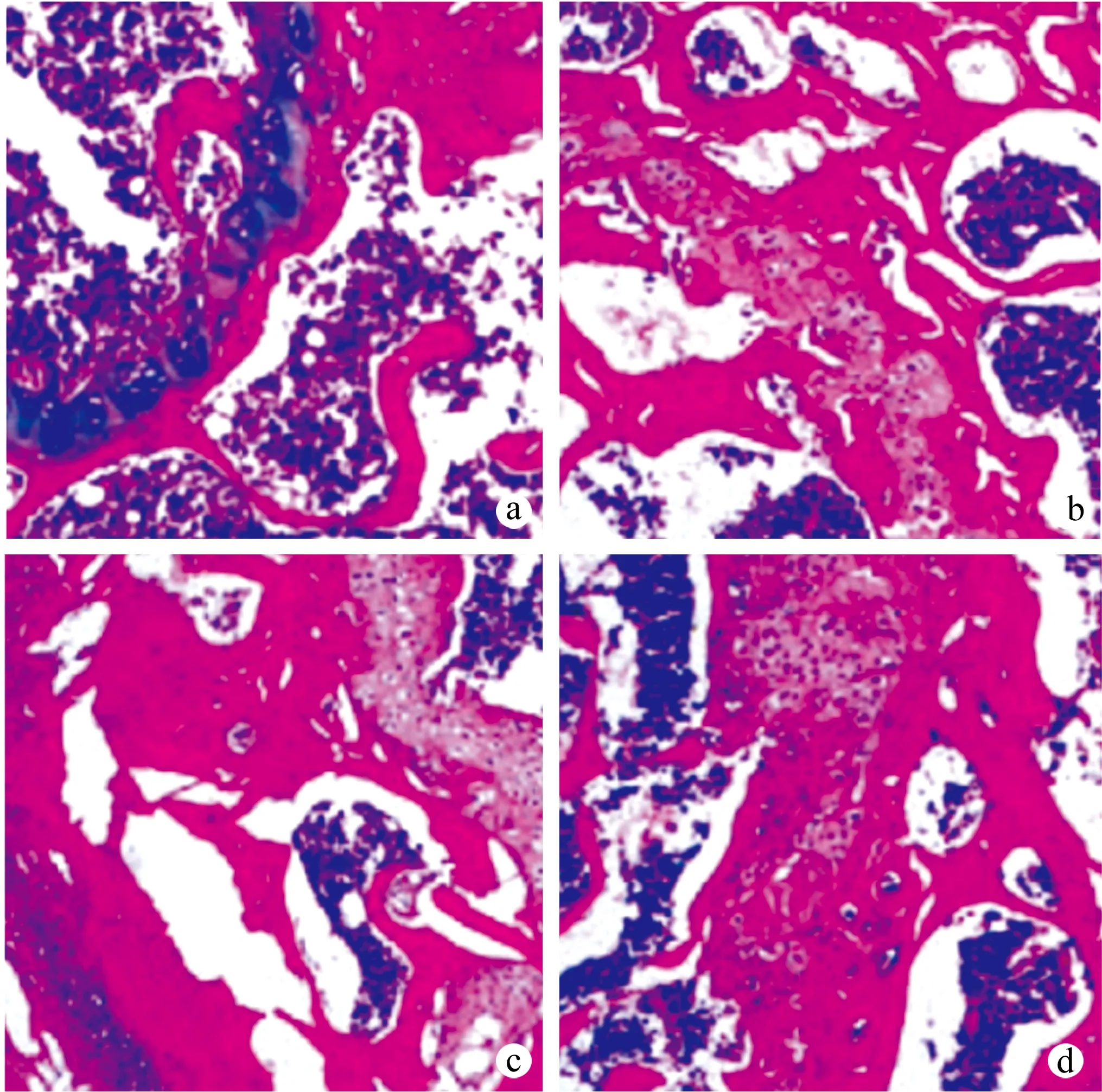
a:空白组;b:模型组;c:下调组;d:上调组
2.3 各组大鼠膝关节活动度、压痛阈值、热痛阈值比较
与空白组比较,其他各组大鼠膝关节活动度较小,压痛阈值、热痛阈值较低,差异均有统计学意义(P<0.05);与模型组比较,下调组大鼠膝关节活动度较小,压痛阈值、热痛阈值较低,差异均有统计学意义(P<0.05);与模型组和下调组比较,上调组大鼠膝关节活动度较大,压痛阈值、热痛阈值较高,差异均有统计学意义(P<0.05),见表2。
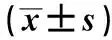
表2 各组大鼠膝关节活动度、压痛阈值、热痛阈值比较
2.4 各组大鼠炎症因子水平比较
与空白组比较,其他各组大鼠IL-1β、TNF-α水平较高,差异均有统计学意义(P<0.05);与模型组比较,下调组大鼠IL-1β、TNF-α水平较高,差异均有统计学意义(P<0.05);与模型组和下调组比较,上调组大鼠IL-1β、TNF-α水平较低,差异均有统计学意义(P<0.05),见表3。

表3 各组大鼠炎症因子水平比较
2.5 各组大鼠滑膜纤维化标志物mRNA比较
与空白组比较,其他各组大鼠TGF-β、COL1α1、TIMP1 mRNA水平较高,差异均有统计学意义(P<0.05);与模型组比较,下调组大鼠TGF-β、COL1α1、TIMP1 mRNA水平较高,差异均有统计学意义(P<0.05);与模型组和下调组比较,上调组大鼠TGF-β、COL1α1、TIMP1 mRNA水平较低,差异均有统计学意义(P<0.05),见表4。

表4 各组大鼠滑膜纤维化标志物mRNA比较
2.6 各组大鼠PERK/Bip信号通路蛋白表达比较
与空白组比较,其他各组大鼠PERK、Bip、Caspase-9蛋白表达较高,差异均有统计学意义(P<0.05);与模型组比较,下调组大鼠PERK、Bip、Caspase-9蛋白表达较高,差异均有统计学意义(P<0.05);与模型组和下调组比较,上调组大鼠PERK、Bip、Caspase-9蛋白表达较低,差异均有统计学意义(P<0.05),见表5、图2。

表5 各组大鼠PERK/Bip信号通路蛋白表达比较
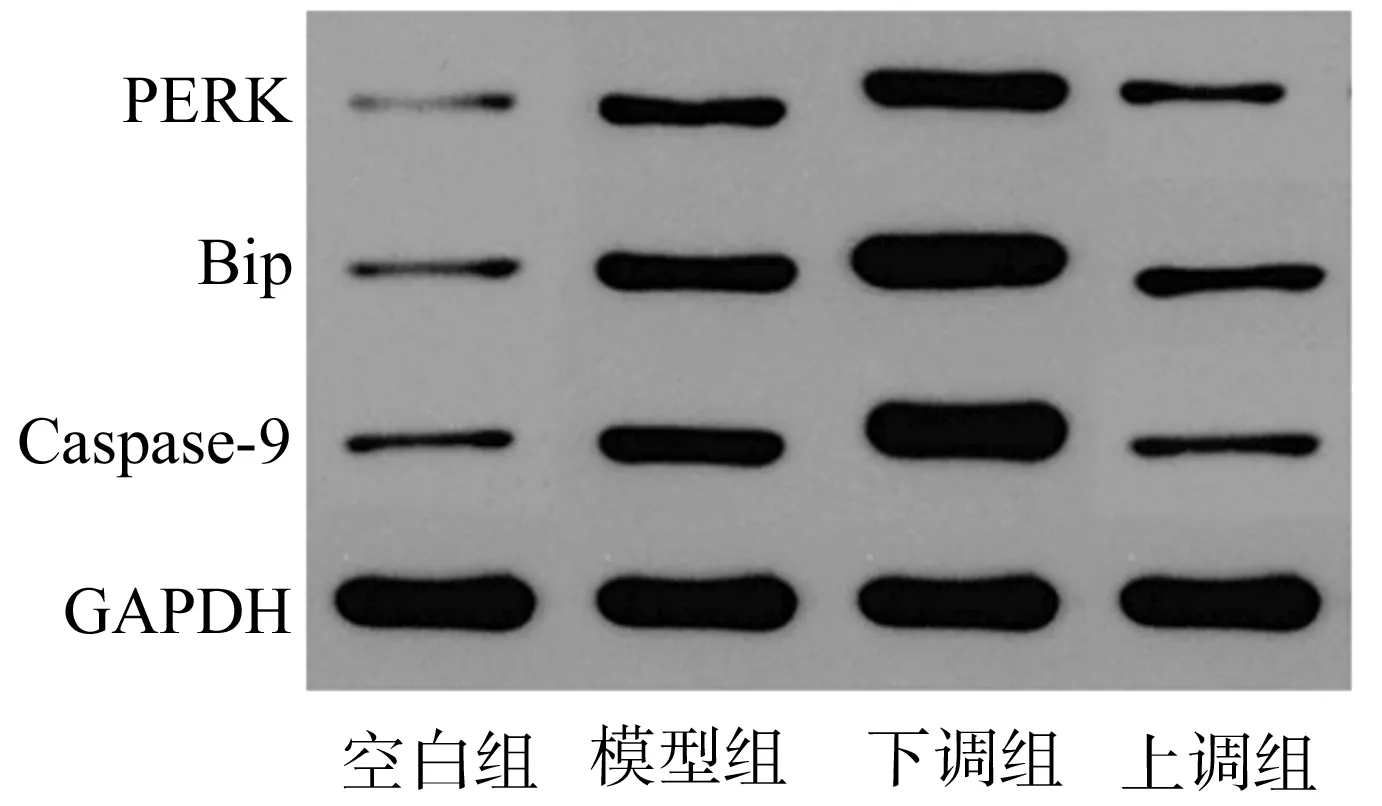
图2 PERK/Bip信号通路蛋白
3 讨论
目前对于骨关节炎的发病机制尚无统一定论,有研究认为其发病可能与某些基因表达调控紊乱密切相关,其中miRNAs在骨关节炎发病及进展中所起到的关键作用被广泛接受[9-10]。研究显示,miR-9-5p、miR-424-59在骨关节炎软骨中表达异常,miRNAs可能作为一种调控基因在骨关节炎的病理发展过程中起作用,在骨关节炎的早期诊断及治疗中具有重要意义[11-12]。有研究显示,过表达miR-142-3p可抑制IL-1、IL-6等水平,促进软骨细胞增殖,抑制细胞凋亡,其可作为治疗骨关节炎的潜在分子靶点[13]。也有研究显示,miR-142-3p在关节炎患者中呈低表达,上调miR-142-3p的表达可降低成纤维样滑膜细胞活性,促进其凋亡,从而改善滑膜细胞功能,促进病情恢复[14]。本研究表明,在骨关节炎模型大鼠中,上调miR-142-3p表达可增加大鼠膝关节活动度,提高压痛阈值、热痛阈值,并降低炎症因子IL-1β、TNF-α表达水平,从而减轻炎症反应,促进膝关节功能恢复。
临床实践证实,TGF-β是转化生长因子超家族的多功能细胞因子,其主要功能是调节炎症过程,在软骨的形成、维持、修复过程中起关键作用;COL1α1可直接参与Ⅰ型胶原蛋白的合成,在组织纤维化、韧带损伤、软骨破坏等多种病理过程中起关键作用;TIMP1是基质金属蛋白酶抑制剂家族主要成员之一,可维持软骨结构完整[15-17]。张力等[18]的研究显示,膝骨关节炎模型大鼠使用膝痹宁治疗后,TGF-β、COL1α1、TIMP1水平较低,可能是由于膝痹宁可有效减轻膝骨关节滑膜纤维化,从而改善膝关节功能[16]。在本研究中,上调miR-142-3p可有效抑制滑膜组织中TGF-β、COL1α1、TIMP1表达,缓解滑膜组织纤维化,从而有利于疾病恢复。
PERK/Bip信号通路是经典的信号通路之一,其中PERK、Bip、Caspase-9为该通路常见因子[19]。PERK是内质网膜蛋白,炎症因子IL-1β、TNF-α异常升高会活化PERK,PERK活化后会促使Bip的激活态,进而导致PERK/Bip信号通路及Caspase-9被激活,而活化的Caspase-9可启动细胞凋亡程序,导致软骨退变[20]。有研究显示,在骨关节炎模型大鼠中,PERK、Bip蛋白表达量升高,从而诱导膝关节炎症反应、激活PERK/Bip信号通路,导致关节软骨退变,进而造成骨关节炎[21]。还有研究显示,使用中药治疗骨关节炎可抑制PERK/Bip、Wnt/β-catenin等信号通路及IL-4、TNF-α等炎症因子的表达,调控软骨细胞转录,从而减轻软骨组织损伤[22]。PERK/Bip信号通路在骨关节炎内质网应激反应引起软骨细胞凋亡过程中起重要的调控作用。在应激反应发生时,Bip蛋白使PERK胞浆区的蛋白激酶活化,进一步磷酸化elF-2α,导致异常蛋白产生减少,并高表达Bip等分子伴侣,从而减轻内质网应激反应,阻止软骨细胞凋亡和软骨退变[23-24]。在本研究中,上调miR-142-3p可以抑制炎症因子IL-1β、TNF-α的表达;下调miR-142-3p可以提高炎症因子IL-1β、TNF-α的表达,从而活化PERK蛋白激活Bip信号通路;因此,上调miR-142-3p可能通过降低PERK、Bip、Caspase-9蛋白表达抑制PERK/Bip信号通路,减轻骨关节炎大鼠软骨损伤,改善其临床症状,提示PERK/Bip信号通路是治疗骨关节炎的一个作用靶点。
综上所述,上调miR-142-3p可明显抑制骨关节炎大鼠PERK、Bip、Caspase-9蛋白表达,减轻炎症反应,改善膝关节活动度,提高压痛阈值、热痛阈值,修复膝关节组织损伤,其作用机制可能与抑制PERK/Bip信号通路活性相关,为临床骨关节炎的诊治提供了新思路。但目前尚无研究阐明miR-142-3p、PERK/Bip信号通路与骨关节炎的关系,还需进一步研究证实。

