FAM83H-AS1靶向miR-4684-5p对胰腺癌细胞放射敏感性的影响
时彩艳,刘 峰,卢宏全,黄国定
(海南西部中心医院肿瘤内科,海南 儋州 571700)
胰腺癌是消化系统最常见的恶性肿瘤之一,其早期症状不明显,限制了早期诊断和治疗[1-2]。尽管近年来胰腺癌的治疗水平有所提高,但患者的5年生存率仍小于5%[3]。清楚地认识胰腺癌的发病机制将有助于明确胰腺癌诊治的有效靶点和策略。长链非编码RNAs(long non-coding RNAs,lncRNAs)是真核细胞中长度超过200核苷酸的RNA转录本,不具有蛋白质编码能力[4],lncRNAs可参与调节多种细胞的生物学过程和疾病发病,包括正常胰腺细胞的癌变等[5-6],也可参与调控肿瘤的放射敏感性[7],如沉默lncRNA LINC00857通过招募NF-κB1增强肺腺癌细胞的放射敏感性[8];另有研究发现,lncRNA HOTAIR可通过miR-449b-5p促进HSPA1A表达,增强乳腺癌耐辐射性[9];还有研究表明lncRNA SBF2-AS1可通过miR-302a/MBNL3轴影响非小细胞肺癌的放射敏感性[10]。有研究发现FAM83H-AS1参与乳腺癌、结直肠癌、食管鳞癌等肿瘤的增殖与转移[11-12],但其在胰腺癌中的表达及其调控胰腺癌放射敏感性的作用机制仍不明确。因此,本研究通过探讨FAM83H-AS1对胰腺癌放射敏感性的影响及其作用机制,首次揭示了FAM83H-AS1与胰腺癌辐射抵抗有关,为研究癌症辐射耐药性的分子机制开辟了新的途径,现报告如下。
1 材料与方法
1.1 主要材料
经患者和家属同意,收集我院胰腺癌组织和距离病变位置约5 cm的癌旁组织标本各30个,且立即保存在液氮中。胰腺癌PANC-1细胞、正常胰腺HPDE细胞来自中国科学院上海细胞库,DMEM培养基及胎牛血清(FBS)来自美国Gibco公司,细胞凋亡检测试剂盒购自美国Sigma公司,GAPDH多克隆抗体和Bcl-2、Bax抗体购自英国Abcam公司,FAM83H-AS1 siRNA、pcDNA-FAM83H-AS1由北京擎科生物有限公司合成,miR-4684-5p inhibitor和miR-4684-5p mimics由上海吉玛公司提供,流式细胞仪购自美国Cell Signaling。
1.2 细胞培养与转染
PANC-1细胞、HPDE细胞用含10% FBS、10 kU链霉素—青霉素的DMEM培养基培养,置于37 ℃、饱和湿度为5% CO2的细胞培养箱中。待细胞融合至90%时,加入0.25%胰蛋白酶进行消化传代。转染的细胞分组如下:①siRNA NC组(PANC-1细胞转染siRNA NC质粒)、FAM83H-AS1 siRNA组(PANC-1细胞转染FAM83H-AS1 siRNA质粒);②pcDNA-3.1(+)组[PANC-1细胞转染pcDNA-3.1(+)质粒]、pcDNA-3.1(+)+8 Gy组[PANC-1细胞转染pcDNA-3.1(+)质粒后,用8 Gy射线垂直照射]、pcDNA-FAM83H-AS1组(PANC-1细胞转染pcDNA-FAM83H-AS1质粒)、pcDNA-FAM83H-AS1+8 Gy组(PANC-1细胞转染pcDNA-FAM83H-AS1质粒后,用8 Gy射线垂直照射);③FAM83H-AS1 WT+mimics NC组(PANC-1细胞共转染FAM83H-AS1 WT与mimics NC质粒)、FAM83H-AS1 WT+miR-4684-5p mimics组(PANC-1细胞共转染FAM83H-AS1 WT与miR-4684-5p mimics质粒)、FAM83H-AS1 MUT+mimics NC组(PANC-1细胞共转染FAM83H-AS1 MUT与mimics NC质粒)、FAM83H-AS1 MUT+miR-4684-5p mimics组(PANC-1细胞共转染FAM83H-AS1 MUT与miR-4684-5p mimics质粒);④mimics NC组(PANC-1细胞转染mimics NC质粒)、mimics NC+8 Gy组(PANC-1细胞转染mimics NC质粒后,用8 Gy射线垂直照射)、miR-4684-5p mimics组(PANC-1细胞转染miR-4684-5p mimics质粒)、miR-4684-5p mimics+8 Gy组(PANC-1细胞转染miR-4684-5p mimics质粒后,用8 Gy射线垂直照射);⑤siRNA NC+inhibitor NC组(PANC-1细胞共转染siRNA NC与inhibitor NC质粒)、FAM83H-AS1 siRNA+inhibitor NC组(PANC-1细胞共转染FAM83H-AS1 siRNA与inhibitor NC质粒)、siRNA NC+miR-4684-5p inhibitor组(PANC-1细胞共转染siRNA NC与miR-4684-5p inhibitor质粒)、FAM83H-AS1 siRNA+miR-4684-5p inhibitor组(PANC-1细胞共转染FAM83H-AS1 siRNA与miR-4684-5p inhibitor质粒);⑥X射线未照射组、X射线照射组(细胞完成转染后,分别采用0、2、4、6、8 Gy的X射线垂直照射)。细胞铺于12孔板,待融合至75%时弃培养基,用无FBS的DMEM覆盖细胞,取稀释好的重组质粒和脂质体混匀,室温静置20 min,缓慢滴入细胞。48 h后收集细胞RNA和蛋白进行分析检测。
1.3 细胞活力测定
细胞铺于96孔板,融合至70%~80%时,按照1.2转染步骤将重组质粒转染至细胞内,需行X射线照射的细胞转染后用8 Gy的X射线垂直照射,在培养箱中静置48 h后,用PBS清洗,每孔细胞加入10 μL CCK-8溶液,放置4 h,在酶标仪下读取每孔细胞在450 nm处的吸光度值,计算细胞活力。
1.4 流式细胞仪检测细胞凋亡率
细胞接种于12孔板,用LipofectamineTM2000进行质粒转染,需行X射线照射的细胞转染后用8 Gy的X射线垂直照射,48 h后收集细胞置于EP管,PBS清洗后,用500 μL结合缓冲液重悬细胞。细胞中加入5 μL Annexin V-FITC和10 μL PI,避光放置15 min后离心,采用流式细胞仪测定细胞的凋亡率。
1.5 双荧光素酶报告基因实验
采用生物信息学软件miRnada预测FAM83H-AS1的靶基因后,构建FAM83H-AS1野生型载体(FAM83H-AS1 WT)和突变型载体(FAM83H-AS1 MUT)。分别将FAM83H-AS1 WT+miR-4684-5p mimics与FAM83H-AS1 MUT+miR-4684-5p mimics质粒共转染至细胞内,用8 Gy的X射线垂直照射,48 h后用双荧光素酶报告基因检测试剂盒检测荧光素酶活性。
1.6 实时荧光定量聚合酶链反应( real-time fluoresent quantitative polymerase chain reaction,RT-qPCR)
从液氮中取出保存的胰腺癌组织和癌旁组织,用液氮充分研磨后提取总RNA。PANC-1细胞转染48 h后或转染完成用X射线照射48 h后,用Trizol法提取细胞RNA。通过逆转录试剂盒将RNA反转录成cDNA。以稀释后的cDNA为模板,GAPDH为内参,进行RT-qPCR,反应程序为95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,共40个循环。结果通过2-ΔΔCt法分析。引物序列为GAPDH:F-CAAGGACCTCTACGCCAACAC,R-TGGAGGCGCGATGATCTT;FAM83H-AS1:F-CCTGGG-TTCAAGCGATTCT,R-GGTGGCACACACCTGCTAT。
1.7 Western blot
根据说明书提取细胞中总蛋白,通过BCA试剂盒对蛋白进行定量后,取50 μg蛋白进行SDS-PAGE凝胶电泳,90 V电泳90 min,120 V电泳30 min,再将蛋白湿转到PVDF膜上(20 V湿转1 h)。PVDF膜用封闭液室温摇床封闭3 h,与特异性一抗(Bcl-2、Bax和GAPDH)在4 ℃下反应过夜,PBST洗涤5次,再于37 ℃下与二抗反应l h,PBST洗涤5次,滴加化学发光剂进行蛋白曝光,使用Image J软件分析目的蛋白与内参蛋白的灰度值,目的蛋白的相对表达量=目的蛋白灰度值/内参蛋白灰度值。
1.8 统计学分析

2 结果
2.1 FAM83H-AS1在胰腺癌组织、细胞和抗辐射PANC-1细胞中的表达
FAM83H-AS1在胰腺癌组织中的表达高于癌旁组织(P<0.01);PANC-1细胞中FAM83H-AS1表达高于HPDE细胞(P<0.01),见图1a、b;与经0 Gy X射线照射的PANC-1细胞相比,用2、4、6、8 Gy X射线照射PANC-1细胞后,FAM83H-AS1的表达水平随X射线照射剂量的增加而降低(P<0.05),见图1c。表明FAM83H-AS1在胰腺癌组织和细胞中表达上调,而在抗辐射胰腺癌PANC-1细胞中表达下调。

a~c:RT-qPCR检测FAM83H-AS1表达 **:与癌旁组织比较,P<0.01;##:与HPDE细胞比较,P<0.01;△:与未用X射线照射的细胞比较,P<0.05;△△:与未用X射线照射的细胞比较,P<0.01
2.2 上调FAM83H-AS1抑制PANC-1细胞的放射敏感性
与pcDNA-3.1(+)组相比,pcDNA-FAM83H-AS1组FAM83H-AS1表达、Bcl-2蛋白表达和细胞活力升高(P<0.05),Bax蛋白表达和细胞凋亡率降低(P<0.01);与pcDNA-3.1(+)组相比,pcDNA-3.1(+)+8 Gy组FAM83H-AS1表达、Bcl-2蛋白表达和细胞活力降低(P<0.05),Bax蛋白表达和细胞凋亡率升高(P<0.01);与pcDNA-3.1(+)+8 Gy组相比,pcDNA-FAM83H-AS1+8 Gy组的FAM83H-AS1表达、Bcl-2蛋白表达和细胞活力升高(P<0.01),Bax蛋白表达和细胞凋亡率降低(P<0.01),见图2。表明上调FAM83H-AS1能够抑制PANC-1细胞的放射敏感性。

a:RT-qPCR检测FAM83H-AS1表达;b:CCK-8法检测PANC-1细胞活力;c、d:Western blot检测Bcl-2、Bax蛋白表达水平;e、f:流式细胞仪测定PANC-1细胞凋亡率 1:pcDNA-3.1(+)组;2:pcDNA-FAM83H-AS1组;3:pcDNA-3.1(+)+8 Gy组;4:pcDNA-FAM83H-AS1+8 Gy组;*:与pcDNA-3.1(+)组比较,P<0.05;**:与pcDNA-3.1(+)组比较,P<0.01;△:与pcDNA-3.1(+)+8 Gy组对比,P<0.05;△△:与pcDNA-3.1(+)+8 Gy组对比,P<0.01
2.3 FAM83H-AS1和miR-4684-5p的关系
miRnada预测FAM83H-AS1和miR-4684-5p之间有直接结合位点。与FAM83H-AS1 WT+mimics NC组相比,FAM83H-AS1 WT+miR-4684-5p mimics组荧光素酶活性降低(P<0.01);与FAM83H-AS1 MUT+mimics NC组相比,FAM83H-AS1 MUT+miR-4684-5p mimics组荧光素酶活性无变化(P>0.05)。与siRNA NC组相比,FAM83H-AS1 siRNA组FAM83H-AS1表达降低(P<0.01)。与siRNA NC组相比,FAM83H-AS1 siRNA组miR-4684-5p表达升高(P<0.01);与pcDNA-3.1(+)组相比,pcDNA-FAM83H-AS1组miR-4684-5p表达降低(P<0.01),见图3。表明FAM83H-AS1和miR-4684-5p存在靶向和负调控关系。

a:miRnada预测FAM83H-AS1和miR-4684-5p之间的结合位点;b:荧光素酶活性的测定;c:RT-qPCR检测FAM83H-AS1表达;d:RT-qPCR检测miR-4684-5p表达 **:与FAM83H-AS1 WT+mimics NC组比较,P<0.01;##:与siRNA NC组比较,P<0.01;△△:与siRNA NC组比较,P<0.01;▲▲:与pcDNA-3.1(+)组比较,P<0.01
2.4 miR-4684-5p在胰腺癌组织、细胞和抗辐射PANC-1细胞中的表达
miR-4684-5p在胰腺癌组织中的表达低于癌旁组织(P<0.01),见图4a;PANC-1细胞中miR-4684-5p表达低于HPDE细胞(P<0.01),见图4b;与经0 Gy X射线照射的PANC-1细胞相比,经不同剂量(2、4、6、8 Gy)X射线照射后的PANC-1细胞中miR-4684-5p的表达水平随X射线照射剂量的增加而升高(P<0.05),见图4c。表明miR-4684-5p在胰腺癌组织和细胞中表达下调,而在抗辐射胰腺癌PANC-1细胞中表达上调。
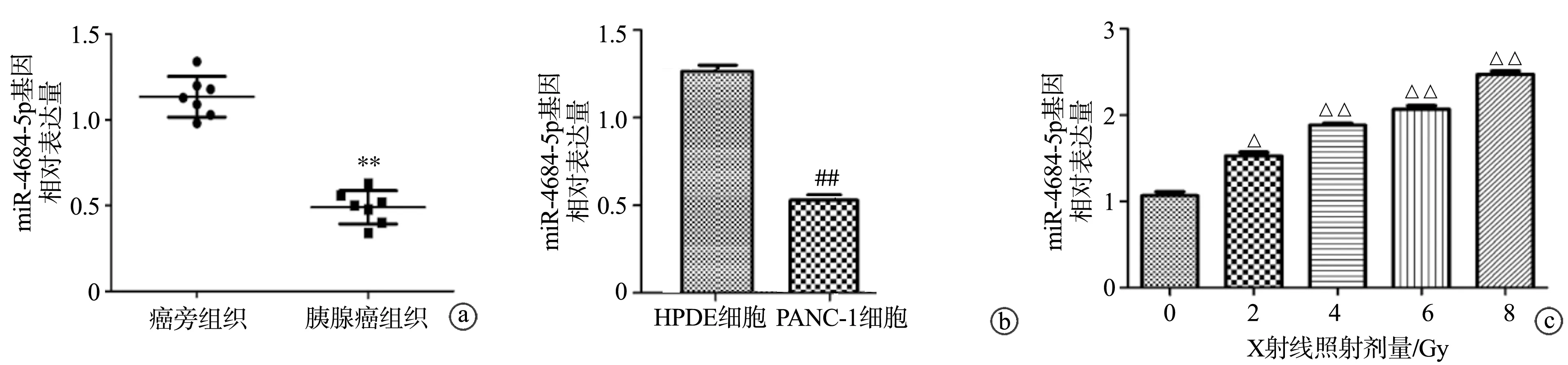
a~c:RT-qPCR检测miR-4684-5p表达 **:与癌旁组织比较,P<0.01;##:与HPDE细胞比较,P<0.01;△:与未经X射线照射的细胞比较,P<0.05;△△:与未经X射线照射的细胞比较,P<0.01
2.5 上调miR-4684-5p增强PANC-1细胞的放射敏感性
与mimics NC组相比,miR-4684-5p mimics组miR-4684-5p表达、Bax蛋白表达和细胞凋亡率升高(P<0.05),细胞活力和Bcl-2蛋白表达降低(P<0.05);与mimics NC组相比,mimics NC+8 Gy组miR-4684-5p表达、Bax蛋白表达和细胞凋亡率升高(P<0.01),细胞活力和Bcl-2蛋白表达降低(P<0.01);与mimics NC+8 Gy组相比,miR-4684-5p mimics+8 Gy组细胞内miR-4684-5p表达、Bax表达和细胞凋亡率升高(P<0.01),细胞活力和Bcl-2蛋白表达降低(P<0.05),见图5。表明上调miR-4684-5p能够增强PANC-1细胞的放射敏感性。

a:RT-qPCR检测miR-4684-5p表达;b:CCK-8法检测PANC-1细胞活力;c~d:Western blot检测Bcl-2、Bax蛋白表达水平;e~f:流式细胞仪测定PANC-1细胞的凋亡率 1:mimics NC组;2:miR-4684-5p mimics组;3:mimics NC+8 Gy组;4:miR-4684-5p mimics+8 Gy组;*:与mimics NC组比较,P<0.05;**:与mimics NC组比较,P<0.01;△:与mimics NC+8 Gy组比较,P<0.05;△△:与mimics NC+8 Gy组比较,P<0.01
2.6 FAM83H-AS1通过miR-4684-5p调控PANC-1细胞放射敏感性
PANC-1细胞经8 Gy X射线垂直照射后,与siRNA NC+inhibitor NC组相比,FAM83H-AS1 siRNA+inhibitor NC组细胞活力和Bcl-2蛋白表达降低(P<0.01),Bax蛋白表达和细胞凋亡率升高(P<0.01);与siRNA NC+inhibitor NC组相比,siRNA NC+miR-4684-5p inhibitor组的细胞活力和Bcl-2蛋白表达升高(P<0.05),Bax蛋白表达和细胞凋亡率降低(P<0.01);与siRNA NC+miR-4684-5p inhibitor组相比,FAM83H-AS1 siRNA+miR-4684-5p inhibitor组的细胞活力和Bcl-2蛋白表达降低(P<0.05),Bax蛋白表达和细胞凋亡率升高(P<0.01),见图6。表明下调FAM83H-AS1能够通过miR-4684-5p调控PANC-1细胞的放射敏感性。

a:CCK-8法检测PANC-1细胞活力;b、c:Western blot检测Bcl-2、Bax蛋白表达水平;d、e:流式细胞仪测定PANC-1细胞凋亡率1:siRNA NC+inhibitor NC组;2:FAM83H-AS1 siRNA+inhibitor NC组;3:siRNA NC+miR-4684-5p inhibitor组;4:FAM83H-AS1 siRNA+miR-4684-5p inhibitor组;*:与siRNA NC+inhibitor NC组比较,P<0.05;**:与siRNA NC+inhibitor NC组比较,P<0.01;△:与siRNA NC+miR-4684-5p inhibitor组比较,P<0.05;△△:与siRNA NC+miR-4684-5p inhibitor组比较,P<0.01
3 讨论
胰腺癌是一种高度转移性和侵袭性的恶性肿瘤,通常对放射治疗有耐药性[13]。越来越多的证据表明,lncRNAs的异常表达可能对肿瘤细胞的增殖和凋亡产生重要影响[14]。因此,探讨lncRNAs在胰腺癌发生和辐射耐受中的作用机制,对明确其是否可以成为胰腺癌治疗的潜在靶点至关重要。有研究发现,FAM83H-AS1在多种癌症中发挥着致癌基因的作用。如FAM83H-AS1是不同癌症驱动基因的潜在调制剂,也是ER/PR+乳腺癌患者的预后标志物[15]。在肝细胞癌中上调FAM83H-AS1可通过激活Wnt/β-catenin通路促进细胞增殖和侵袭[16]。另一项研究表明FAM83H-AS1可通过激活Notch信号通路促进大肠癌细胞增殖[17]。上述研究明确了FAM83H-AS1在癌症进展中的重要作用,然而目前对于FAM83H-AS1对胰腺癌细胞增殖与凋亡的影响尚无文献报道,因此,本研究对FAM83H-AS1在胰腺癌中的表达进行检测,结果显示,FAM83H-AS1在胰腺癌组织和细胞系中高表达,结合FAM83H-AS1在结直肠癌、乳腺癌等肿瘤中发挥的作用,我们猜测FAM83H-AS1在胰腺癌细胞中也可能具有致癌作用,而上调FAM83H-AS1后胰腺癌细胞增殖得到促进、细胞凋亡得到抑制,进一步证实了我们的推测。说明FAM83H-AS1在胰腺癌的发展中也发挥了明显的致癌基因作用,与FAM83H-AS1在其他癌症中发挥的作用一致。此外,本研究结果还表明,FAM83H-AS1在抗辐射胰腺癌PANC-1细胞中表达下调,上调其表达能够抑制PANC-1细胞的放射敏感性。
近期研究表明,lncRNAs作为miRNA海绵负调控miRNA表达,进而调控肿瘤的发展[18]。如FAM83A-AS1靶向miR-150-5p和修饰MMP14促进肺腺癌细胞迁移和侵袭[19]。另有研究发现,FAM83H-AS1可通过调控miR-136-5p促进三阴性乳腺癌进展[20]。结合前人的研究思路,本研究继续探讨了FAM83H-AS1的下游作用靶点,结果显示,FAM83H-AS1能够靶向miR-4684-5p,荧光素酶活性检测证实了FAM83H-AS1与miR-4684-5p的直接结合。有研究认为,在食管鳞癌中,FAM83H-AS1与miR-4684-5p具有靶向作用,并可通过调控miR-4684-5p/ZBTB38轴促进有氧糖酵解和肿瘤进展[21],表明miR-4684-5p与肿瘤进展密切相关。目前miR-4684-5p在胰腺癌细胞增殖、凋亡中的作用及其机制尚未完全阐明,因此本研究还探讨了miR-4684-5p在胰腺癌细胞中的表达情况及其生物学功能,结果显示,miR-4684-5p在抗辐射胰腺癌PANC-1细胞中表达明显上调,上调miR-4684-5p表达能够增强PANC-1细胞的放射敏感性;且下调FAM83H-AS1能够通过miR-4684-5p调控PANC-1细胞的放射敏感性。以上结果表明,FAM83H-AS1的下调通过海绵样作用在转录后水平负调控miR-4684-5p的表达,抑制胰腺癌细胞增殖,促进细胞凋亡,增强胰腺癌放射敏感性。说明FAM83H-AS1可以靶向miR-4684-5p调节胰腺癌细胞的放射敏感性,这可能是胰腺癌耐辐射的潜在靶点。
综上所述,FAM83H-AS1在胰腺癌组织和细胞系中高表达,其表达下调可通过负调控miR-4684-5p抑制癌细胞增殖,增强胰腺癌放射敏感性。因此,靶向FAM83H-AS1/miR-4684-5p轴可能是一种胰腺癌辐射耐受的新的治疗方向。
——一道江苏高考题的奥秘解读和拓展

