铊在土壤环境中的行为及其生态毒理学研究进展
刘仕翔,宁 晖,黄允豪,罗泽娇
(1.广西博世科环保科技股份有限公司土壤环境修复事业部,广西 南宁 530007;2.武汉一洋环保科技有限公司,湖北 武汉 430205;3.中国地质大学(武汉)环境学院,湖北 武汉 430078)
进入21世纪以来,随着工业的快速发展和城市化进程的加快,特别是城市产业结构“退二进三”的实施,大量受污染的退役场地暴露出来[1-2],土壤环境安全问题引起了社会的广泛关注。环境保护部2014年发布的《全国土壤污染状况调查公报》[3]中显示,我国土壤污染总体形势较为严峻,部分区域土壤污染较为严重,造成土壤污染的主要原因是工矿业、农业等人为活动以及土壤环境背景值高,土壤污染类型以无机型污染为主,土壤中重金属污染物镉(Cd)、汞(Hg)、铅(Pb)等含量分布呈现从西北到东南、从东北到西南方向逐渐升高的趋势。现有土壤重金属污染防治领域的研究主要集中在土壤中几类常见的重金属[如汞(Hg)、镉(Cd)、铬(Cr)、铜(Cu)、铅(Pb)、锌(zn)、镍(Ni)等][4-5],对土壤中丰度较低的重金属(如铊)的关注度则相对较低,也未纳入《土壤环境质量 建设用地土壤污染风险管控标准(试行)》(GB 36600—2018)[6]。
铊(Thallium,Tl)是一种典型的分散、剧毒元素,主要用于医疗方面如心血管成像和作为γ辐射探测设备的活化剂,也可作为无线通信领域高温超导体,此外还可应用于电子、合金、玻璃制造和制药等领域。近年来,伴随着含Tl矿石的开采与利用,大量Tl被释放到地表环境中,造成严重的土壤和水体Tl污染。Tl进入土壤、水体等生态环境后,可在植物体内富集,进而通过食物链等途径进入人体,威胁人体健康[7-8],造成Tl中毒事故时有发生[9-10]。相较于Cd、Cu、Pb、Hg等常见的重金属元素,Tl表现出更高的毒性[11]。Tl经胃肠道吸收时,对人体的急性中毒剂量为6~40 mg/kg,成人经胃肠道吸收的最小致死量(MLD)为12 mg/kg[12]。鉴于Tl的高毒性、强积累能力,Tl已被美国环境保护总局(USEPA)列为优先控制的污染物[13],我国也将其列入《水中优先控制污染物黑名单》中[14]。2021年,针对我国先后发生的湘江干流衡阳段Tl浓度异常、嘉陵江甘陕川交界断面Tl浓度异常和云南省曲靖市富源县饮用水水源地Tl超标等多起水体Tl污染事件,生态环境部印发了《关于开展涉铊企业排查整治工作的通知》(环办应急函〔2021〕153号),要求各地生态环境部门进一步加强涉铊企业监管及污染防治工作[15]。
综上,Tl作为一种分散、有毒害作用的重金属元素,随着矿产的开发与利用,对生态环境造成的威胁日益严重,但有关Tl的土壤污染防治措施、评价标准等存在一定的缺失,难以对其进行有效的环境管理。为此,本文对近年来Tl元素在土壤环境中的迁移行为特征及其生态毒理学相关研究成果进行了系统归纳、总结,以期为相关研究提供借鉴,为重金属Tl的土壤污染防治工作提供科学依据。
1 铊的地球化学背景及污染现状
1.1 铊的地球化学背景
分散元素一般指在地壳中丰度很低(多为10-9级)且在岩石中极为分散的元素。多数分散元素在自然界中成矿几率很低,且产地稀少,主要包括镓(Ga)、锗(Ge)、硒(Se)、镉(Cd)、铟(In)、碲(Te)、铼(Re)、铊(Tl)8种元素。金属Tl元素呈蓝白色到银白色,质软且具有延展性,在空气中不稳定,不能溶解于水,易溶于酸,自然界中Tl大多以一价形式存在。在自然界中,Tl的地壳丰度为0.48 mg/kg,排名第60位,根据《中国土壤元素背景值》[16],我国土壤中Tl的背景值含量在0.036~2.38 mg/kg范围内,95%范围值为0.292~1.172 mg/kg,算术平均值为0.520 mg/kg。Tl矿物主要存在于低温热液硫化物矿床中,同时由于其具有亲硫、亲石双重地球化学性质,Tl矿物往往与矿床中矿石矿物和脉石矿物共(伴)生产出。自然界已发现Tl的独立矿物48种,其中硫盐类矿物33种,硫化物矿物7种,硒化物矿物3种,硫酸盐类矿物3种,硫氯化物矿物1种和氧化物矿物1种。我国共计发现12种Tl矿物,主要包括斜硫砷汞铊矿(Christie)、红铊矿(Lorandite)、褐铊矿(Avicennite)、硫砷钝铅矿(Hutchinsonite)、辉铁钝矿(Picotpalie)、硫铁钝矿(Raguinie)、铊黄铁矿(Tallim prite)、铊明矾(Lanmuchangite)等含Tl矿物[17]。
根据美国地质调查局2021年最新的统计结果[18]显示,全球范围内只有少数几个国家商业性地生产Tl,其主要作为Cu、Pb和Zn矿石焙烧的副产品从烟道灰尘中回收,可回收Tl的主要来源为Cu、Pb、Zn和其他硫化物矿石,其中已探明的锌矿中所含Tl资源达1 700万kg,已探明的煤炭中所含Tl资源超过6.3亿kg。2020年,全球Tl的产量不到8 000 kg,中国、哈萨克斯坦和俄罗斯是主要的生产国。我国Tl资源较为丰富,已探明储量约为9 000 t,主要分布在云南、贵州、安徽、广东、广西、辽宁等地[19]。
1.2 铊的土壤风险筛选值及污染现状
1.2.1 铊的土壤风险筛选值
土壤风险筛选值的确定是开展土壤污染调查评估及污染防治工作的重要前提。我国现行的两个土壤环境质量标准《土壤环境质量 建设用地土壤污染风险管控标准》(GB 36600—2018)[6]和《土壤环境质量 农用地土壤污染风险管控标准(试行)》(GB 15618—2018)[20]中均未针对土壤中Tl元素制定相应的限值。在上述标准施行前,我国《展览会用地土壤环境质量评价标准(暂行)》[21]、《农用地土壤环境质量标准(三次征求意见稿)》[22]、《上海市场地土壤环境健康风险评估筛选值(试行)》[23]中曾制定了土壤中Tl的风险筛选值,但现均已废止或未正式施行。目前我国仅有江西省[24]和河北省[25]地方标准(2020年发布)针对第一类用地和第二类用地制定了土壤中Tl的风险筛选值。国际上有加拿大《土壤质量指南——基于保护环境和人类健康》[26]、美国环保局区域筛选值(Regional Screening Levels)总表(2021年5月)[27]、荷兰《污染土壤与地下水干预值》[28]、美国加州《受污染场地土壤及地下水筛选值》[29]等针对土壤/地下水中Tl制定了风险筛选值。归纳总结上述可参考的国内外标准(见表1)可知,针对第一类用地/居住用地,Tl的土壤风险筛选值集中在0.2~1.2 mg/kg范围内,针对第二类用地/工业用地,Tl的土壤风险筛选值集中在1.6~15 mg/kg范围内。

表1 相关文献中铊的土壤风险筛选值
Tl的土壤风险筛选值可基于《建设用地土壤污染风险评估技术导则》(HJ 25.3—2019)中人体健康风险评估方法,根据暴露情景外推得到。国内部分学者,如董迎雯等[30]基于该导则,针对敏感用地和非敏感用地场景下Tl的土壤风险筛选值进行了推导,计算结果表明:敏感用地场景下,基于人体健康风险的Tl土壤风险筛选值为1.335 mg/kg;非敏感用地场景下,基于人体健康风险的Tl土壤风险筛选值为6.669 mg/kg。但上述推导并未明确是针对何种含Tl化合物,相应的毒性和理化性质参数也并未在报道中给出,因此只能为实际工作提供有限的参考。
1.2.2 铊的污染现状及成因
从研究区域、污染来源、污染介质、污染状况等方面,对我国近年来有关Tl污染的相关文献报道进行了比较,见表2。
由表2可知,我国近几年土壤中Tl污染的相关报道主要集中在湖南、广西、广东、贵州等Tl资源丰富的地区,这是由于含Tl矿产的开发与利用会对其周边环境造成污染[31-32,39],使用受污染地表水进行灌溉也会使下游农田土壤受到污染,进而导致污染物在农作物体内产生富集,最终对人体健康产生危害[34-35]。如Liu等[41]通过Pb同位素示踪技术对华南珠江北部沉积物中Tl进行了源解析,结果表明沉积物样品中的Tl大部分来自于Pb-Zn冶炼废物,证实了冶炼活动向沉积物中排放了大量易迁移的重金属Tl。此外,部分区域矿区周边土壤中Tl含量高于背景值则归因于Tl矿的自然风化[34]。如贺州马尾河流域地下水中Tl含量超标主要是由于高背景值的地表岩层破坏致使还原状态较为惰性的Tl被活化,进入地下含水层中[33]。
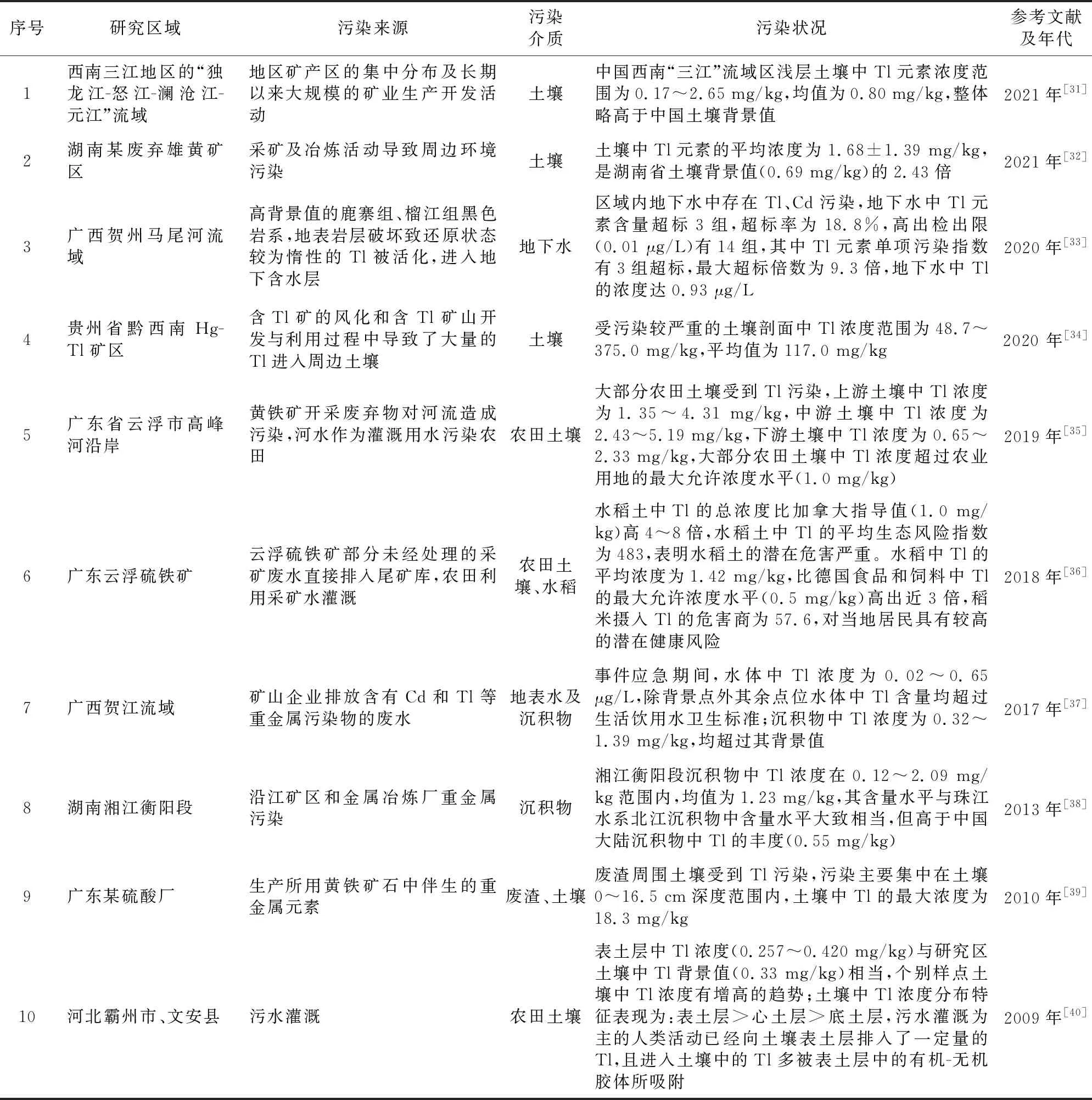
表2 我国近年来Tl污染的相关文献报道
由此可见,除矿产开发与利用等人为原因导致的Tl污染外,矿物中Tl的自然释放、迁移也是导致区域性Tl背景含量较高的原因。
2 铊在土壤中的赋存形态及其在环境介质中的迁移转化特性
2.1 铊在土壤中的赋存形态及其影响因素
研究污染物在土壤中的迁移转化特性对于土壤污染调查与防治等工作至关重要。与其他金属一样,Tl在土壤中的赋存形态对其迁移能力、毒性和生物有效性有较大的影响。传统的土壤中重金属的赋存形态分级提取方法(如Institute for Reference Materials and Measurements——IRMM分级提取法)主要针对常见的重金属(如Pb、Mn、Zn、Ni、Cd等),针对土壤中Tl的赋存形态分级提取则需要对传统的提取方法进行改进优化。如杨春霞等[42]通过对提取剂浓度、pH值和提取温度进行调整后,明显改善了铁锰氧化物结合态Tl的提取率;林景奋[43]利用改进的IRMM分级提取法对受矿渣污染的土壤中Tl进行了分级提取,结果发现土壤中Tl的酸可交换态和可氧化态占比都低于10%,主要是以可还原态和残余态为主,表明这部分的Tl主要来源于含Tl矿渣的溶解释放;相比之下,受矿渣淋滤雨水污染的土壤中Tl则表现出更强的迁移能力,土壤中Tl的酸可交换态、可还原态、可氧化态这3种迁移能力较强的形态占比较高。
但上述因素对土壤中Tl赋存形态的影响并非固定不变,如氧化条件下Mn对Tl的吸附性能显著下降,导致在Mn含量相同的条件下,不同氧化还原条件下土壤中Tl的赋存形态存在较大的差异[45]。除了土壤本身的性质外,外源Tl的输入方式及污染负荷对于土壤中Tl的赋存形态及迁移情况也有着明显的影响,如当土壤中Tl的吸附未达到饱和时,土壤对Tl的吸附量与外源Tl的输入量成正比,但土壤吸附点位受其粒径及矿物组成的影响[46-47],当外源Tl的输入量继续增加时,土壤介质所拥有的吸附点位逐渐趋于饱和,吸附过程趋缓,直至达到吸附平衡状态,此时外源Tl的继续输入后则其主要以可交换态等易迁移的形态赋存[48]。
2.2 铊在土壤-植物系统中的迁移转化特性
土壤中重金属污染物向植物体的迁移转化主要受土壤中重金属形态、污染物浓度、植物体对污染物的富集系数等因素的影响。一般认为,在一定污染浓度范围内,土壤中生物可利用态重金属含量越高,植物体对污染物的吸收量也就越高[34]。Tl与其他重金属一样遵循上述规律,植物通过根系对土壤溶液中Tl进行吸附,吸收至植物体内,在植物体内产生积累,并迁移至可食用部分,进而通过食物链的富集作用对人体健康产生威胁[49-50]。
不同植物体内Tl含量因植物品种、受污染程度的不同表现出极大的差异。如Doulgeridou等[51]的研究发现,植物体中Tl浓度的分布范围为0.001~338 mg/kg;贵州滥木场附近的农产品中Tl含量分析结果表明,在植物体中Tl的含量表现出物种依赖性偏好,Tl在作物可食性部位的富集程度依次为青菜、胡萝卜、辣椒、白菜、水稻、玉米,其中青菜中Tl浓度最高可达500 mg/kg(干重),超过了青菜所在土壤中Tl的浓度[52];Xiao等[53]的试验证实了当土壤中Tl浓度为40~124 mg/kg时,采集的青菜中Tl浓度高达495 mg/kg,远高过其他农作物,也超过了土壤中Tl的浓度,且在5.0 mg/kg Tl污染土壤中培育28 d后,植物体内Tl的富集浓度范围为3.68~122.73 mg/kg,其富集含量从高到低依次为水稻、甘蓝、肾蕨、狐尾藻、菜心,且不同品种甘蓝对于Tl的富集也存在较为明显的差异。此外,外源物质(如有机酸、K+、ATP酶抑制剂等)也可直接/间接对植物体吸收/转运Tl产生一定的影响[54-55]。
土壤中Tl向植物体迁移及Tl由地下部向地上部迁移的能力通常分别采用富集系数(植株各器官Tl含量/土壤全Tl含量)和转运系数[两个植物转运器官( 或土壤) 中后者Tl含量/前者Tl含量]来体现。当富集系数越大或转移系数越大时,植物体作为超富集植物提取土壤中Tl的能力也就越强,同时其作为农产品在Tl污染土壤进行种植,进而对人体健康产生风险的可能性也就越大。水培/半水培试验证实白芥菜体内Tl的积累潜力可达供试土壤中重金属总量的1%,且白芥菜体内对Tl的耐受浓度超过1.4 mg/100 mL,而其他植物在此浓度下往往会表现出明显的萎蔫症状[56];此外,白芥菜体内Tl的转运效率也较之其他植物有明显的不同,Tl在其根部的积累量最小(为5.1%~22.9%),其有33.1%~34.8%的Tl转移到茎,有43.0%~61.9%的Tl转移到叶。
3 铊的毒理学研究
3.1 铊的常见化合物及其毒性
Tl是ⅢA族金属,Tl盐在pH值为7时即形成不溶性氢氧化物。Tl主要以+1价和+3价存在,大部分Tl盐易溶于水,如氯化铊、醋酸铊在水中都是极易溶解的,只有三氧化二铊是不溶的[57]。Tl的毒性与离子活性相关,自然界中Tl3+可以通过络合剂稳定下来,暴露风险相对较小,而Tl+可稳定存在,是一种K+类似物,Tl+毒性的产生机理是其进入生物体后替代K+,影响K+参与的相关生理生化过程,如渗透调节、能量代谢、酶活性等。
Tl及其常见化合物的物理化学性质和毒理学数据见表3,其中毒理学数据来自中科院上海有机化学研究所化学专业数据库和美国国立医药图书馆ChemIDplus数据库数据检索结果[58-59]。LD50(大鼠经口)指动物在受试后一定时间内死亡概率在50%的剂量,是急性毒性参数中较为齐全且运用较多的一类参数。表3中所列Tl的几种常见化合物的LD50在16~44 mg/kg范围内,参考世界卫生组织(WHO)急性毒性分类标准[60],上述Tl化合物毒性存在一定的差异,但均属于高毒毒性,其中毒性最高的化合物为硫酸铊(Ⅰ)(LD50为16 mg/kg),毒性最低的化合物为三氧化二铊(Ⅲ)(LD50为44 mg/kg)。
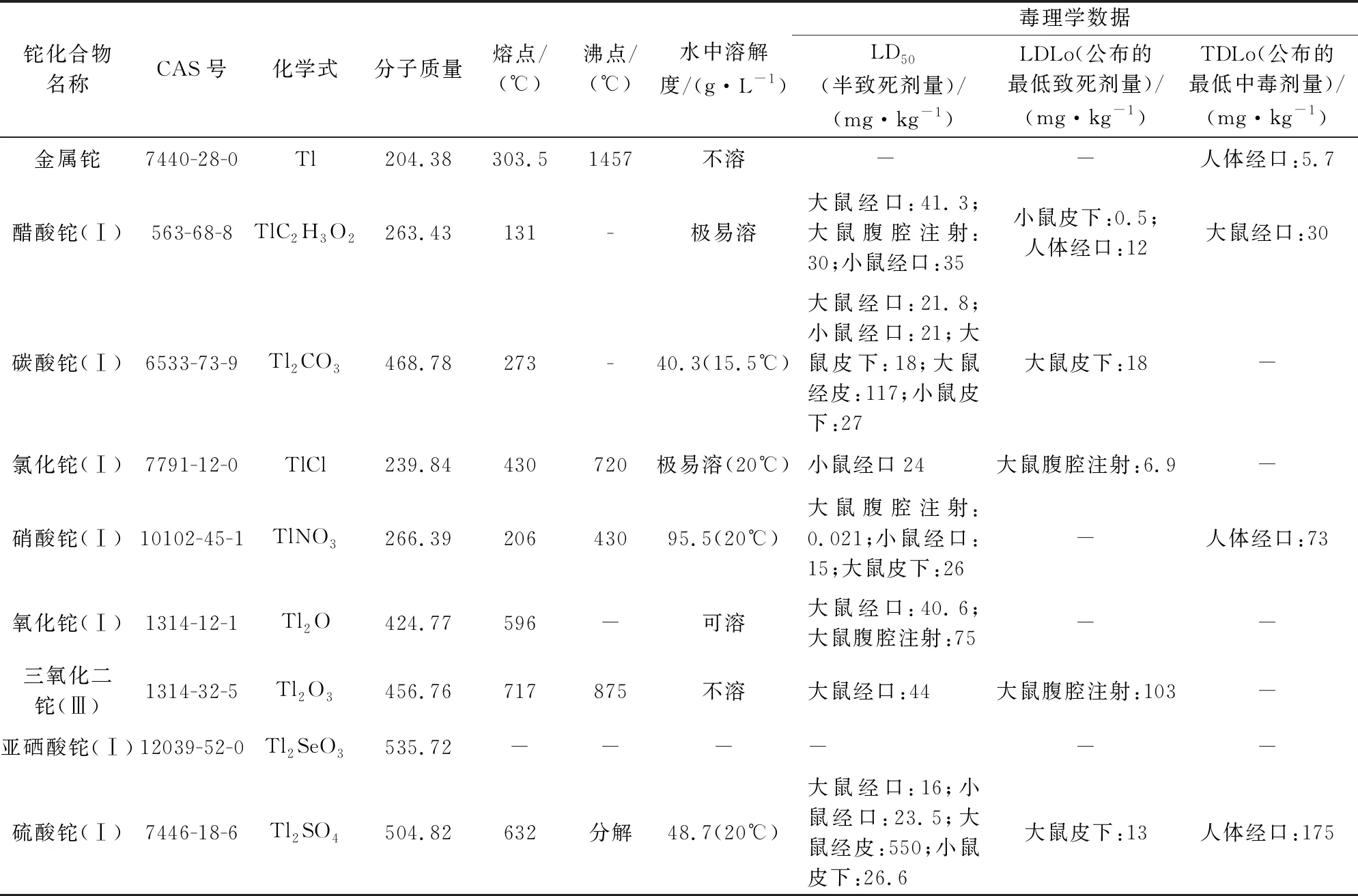
表3 Tl及其常见化合物的物理化学性质和毒理学数据[57-59]
Tl可通过消化道、呼吸、皮肤接触等途径进入人体,其中消化道为主要途径。进入人体的Tl可蓄积于全身各个组织和器官,其对人体的毒性作用主要表现为神经毒性,可引起肾脏、肝脏等多脏器的功能损害。Tl的慢性中毒主要由于长期职业性接触导致,症状与急性中毒相似,但临床表现往往较为缓慢,因此Tl中毒具有隐匿性较强的特点[61]。
此外,Tl还具有致畸和潜在的致癌作用。动物试验表明,当动物体内Tl达到一定浓度时,会诱发体外培养细胞形态转化,小鼠骨髓细胞核素增加,动物胚胎发育迟缓、畸形,骨骼短小弯曲、软骨发育不全等[62]。此外,Tl对于染色体的合成也有一定的影响,可诱发哺乳动物染色体畸变,抑制细胞有丝分裂,是潜在的致癌物[63]。
现行有关Tl的土壤风险筛选值大多以总Tl作为评价指标,仅美国环保局区域筛选值中针对氧化铊、硝酸铊、铊(可溶盐)、醋酸铊、碳酸铊、氯化铊、亚硒酸铊、硫酸铊等化合物根据其毒理性质及物理化学参数的不同分别给出土壤风险筛选值(详见表1备注)[27]。我国生态环境部2019年发布的《土壤和沉积物 铊的测定 石墨炉原子吸收分光光度法》(HJ 1080—2019)[64]也主要适用于土壤和沉积物中Tl总量的测定,并未对各类含Tl化合物进行详细区分。根据表3的统计结果可知,Tl的不同化合物毒性存在一定的差异,用土壤中Tl总量往往无法有效反映土壤中Tl的实际危害程度,此外由于土壤性质、土壤中有机质含量等因素的影响,Tl在土壤中有效态含量往往也存在明显的差异,因此如何有针对性、更为合理地对土壤中Tl毒性进行评估,对于Tl的毒理学研究及Tl污染防治有着重要的意义。
3.2 铊对植物的毒性
Tl对于植物体的胁迫作用主要表现在影响植物体生长、元素吸收、新陈代谢等几个方面。Tl对于植物体胁迫作用与Tl浓度存在较大的相关性,当土壤中Tl浓度相对较低时,植物体对Tl的胁迫表现出一定的耐受性,其生长情况并未表现出明显的抑制作用;但当土壤中Tl浓度增加到一定程度时,植物体的生长及代谢将受到明显的影响。土壤中Tl浓度达10 mg/kg时会对水稻幼芽产生明显的胁迫作用,其会出现色泽异常、黄化,水稻体内叶绿素总量、可溶性糖也会随Tl浓度的增加而呈现下降的趋势,同时Tl对水稻的胁迫作用还会影响对其他元素(如Fe、Mn、Ni、Ba)的吸收,并可能造成重金属Ag、Pb在籽粒中的积累[65]。Tl对水生生物毒性效应的研究表明,Tl胁迫下小球藻细胞的氧化应激则表现为低浓度Tl能一定程度提高超氧化物歧化酶活性;但当Tl浓度增加到一定浓度时,则会对其活性产生明显的抑制,小球藻细胞细胞膜脂质过氧化作用明显增强,MDA丙二醛在体内产生积累[66]。
3.3 铊对微生物的毒性
微生物对于重金属胁迫的敏感性往往高于动、植物,是评价污染物毒性的重要指标。已有研究表明,Tl污染会导致微生物量的大幅降低,微生物量与土壤中Tl浓度呈显著负相关[67]。与此同时,Tl也是调节微生物群落的重要因素。通过对不同浓度Tl污染矿山废石中微生物进行基因测序分类,结果显示:Tl浓度较高的样品中微生物主要以厚壁菌、变形菌和酸杆菌为主;Tl浓度中等的样品中微生物主要以变形杆菌为主;Tl浓度较低的样品中微生物以变形菌、酸杆菌、放线菌为主[68]。此外,土壤/沉积物中微生物群落由于对Tl污染的敏感性不同而存在差异,其中真菌对Tl的耐受性相对于放线菌和细菌较强,其对Tl的耐受性归因于亚细胞水平的区隔化作用[69]。
4 铊污染土壤修复技术
相较于其他重金属,针对Tl污染土壤修复技术的研究报道较少,现有报道中Tl污染土壤修复技术主要包括固化/稳定化修复技术、淋洗修复技术、植物修复技术和微生物修复技术等。
固化/稳定化修复技术主要采用生物炭[70]、硅肥[71]、钠锰石[72]等来降低土壤中Tl的生物有效性、毒性以及减少Tl在农作物中的积累。如Vaněk等[72]的研究证实,添加钠锰石可将土壤中可溶性Tl转化为还原性Tl,降低了土壤中Tl的生物有效性,并减少了植物体对Tl的吸收和积累,而伊利石则未表现出明显的稳定化作用。
淋洗修复技术主要是通过淋洗剂与Tl的螯合作用,将土壤中Tl从不溶态转换为可溶态,进而彻底将其从土壤中去除。污染土壤淋洗修复常用的淋洗剂包括EDTA、CA、EDDS等,已有研究证实单一淋洗剂或者复配淋洗剂对土壤中重金属具有较好的淋洗效果[5]。而淋洗修复往往与植物修复联合使用,可增加植物提取重金属的效率。已有研究证实,选用DTPA和草酸作为淋洗剂,能有效增加土壤中可溶态Tl含量,促进植物体对土壤中Tl的提取[73]。
微生物修复技术的原理主要分为两类:一类是通过微生物代谢过程产生的生物酶,促进碳酸根的生成,加速土壤中污染物的固结,减小其环境风险[74-75],但应用该技术修复土壤中Tl的研究尚未见报道;另一类则主要是通过筛选耐Tl微生物,强化微生物对土壤中Tl的吸附和积累。从Tl污染土壤中筛选出的耐Tl真菌能对其进行有效积累,最大浓度可达7 189 mg/kg干重,进一步证明了利用微生物修复技术分离水体和土壤中Tl的可行性[76]。
5 结论与展望
随着我国经济社会的发展,土壤污染问题日益严峻。近年来,我国各地区土壤Tl污染事故频发,管理部门开展了一系列土壤Tl污染整治、排查工作,如何有效地开展各类污染物的毒性和环境风险评价是土壤污染防治的现实需要,也是亟需解决的难点问题。
本文对近年来Tl元素在土壤环境中的迁移转化行为及毒理学相关研究成果进行了归纳、总结,并对仍需加强的研究方向提出以下建议:
(1) 我国现阶段针对Tl的土壤环境质量标准尚不完整,土壤中不同类型Tl污染物的检测标准尚不完善,推动相关标准的制定可有效促进我国重金属Tl的土壤污染防治工作。
(2) 针对土壤中Tl的毒理性质研究相较于其他重金属仍显不足,系统、全面地开展土壤中Tl及其化合物的毒理学研究可为土壤Tl污染环境风险评价工作提供基础数据支撑。
(3) 针对Tl的土壤修复技术研究工作报道相对较少,且主要集中在固化/稳定化修复技术层面,Tl污染土壤微生物修复技术以及利用不同价态Tl的毒性和迁移能力差异研发相应的修复技术等方向均值得进一步开展研究工作。

