基于网络药理学的三七治疗结直肠癌的分子作用机制研究*
王锦,张海,曲素欣
1.青岛妇女儿童医院,山东 青岛 266034; 2.上海市第一妇婴保健院,上海 201204
结直肠癌是一种恶性肿瘤,最新版全球肿瘤发病情况统计结果显示,其发病率排名第3;病死率位居第2,仅次于肺癌[1]。在我国,结直肠癌的发病率也呈上升趋势[2]。结直肠癌的发生受饮食、年龄、肠道微生物、炎症性肠病等多种因素影响。现阶段,手术切除辅以放化疗和生物疗法仍为结直肠癌主要治疗手段[3]。随着化疗方案的不断改进,部分患者的无进展生存期延长,但结直肠癌患者的化疗后常出现不同程度的不良反应,这不仅降低了患者的生活质量,也限制了化疗疗效。
中药由于其多靶点、低毒性的特点,在结直肠癌治疗中的作用不容忽视。三七[Panaxnotoginseng(Burk.)F.H.Chen]为五加科人参属草本植物,是我国传统名贵草药之一[4]。其主要成分皂苷类具有抗炎、抗氧化、神经保护、抗肿瘤等多种药理活性[5-7]。课题组前期研究表明,三七总皂苷可能是结直肠癌预防和治疗的活性物质[8]。另有研究显示,三七可有效抑制结直肠癌细胞的增长,缓解AOM/DSS诱导的结直肠癌模型小鼠的肿瘤生长,降低炎症因子表达[9-10]。不仅其中的初级皂苷,如三七皂苷R1、人参皂苷Rb1、人参皂苷Rd等具有抗结直肠癌活性[11-12];其次级代谢产物,如人参皂苷 C-K 也表现出较好的抗结直肠癌活性[13]。三七治疗结直肠癌的机制可能与激活活性氧簇/c-Jun氨基末端激酶/p53途径诱导细胞凋亡[14],抑制基质金属蛋白酶(matrix metalloproteinases,MMPs)家族蛋白阻止肿瘤细胞的迁移、侵袭[15]以及调控肠道菌群平衡[8]等相关,但其具体治疗结直肠癌的活性成分和机制尚不明确。
网络药理学可以在分子水平方面分析化合物多靶点、多通路调控疾病的可能机制,提供药物-靶点-疾病之间的相互作用关系,为重要的药理研究提供了更多的方向。因此,本研究采用网络药理学方法构建了三七的“成分-靶点-疾病”网络,并进行基因本体(gene ontology,GO) 功能富集分析和京都基因和基因组百科全书(Kyoto encyclopaedia of gene and genomes,KEGG)通路富集分析,以探索三七治疗结直肠癌的潜在机制,同时为后续相关研究提供一定的理论支持,也为抗结直肠癌药物开发提供新的思路。
1 资料与方法
1.1 三七主要活性成分及相关靶点筛选通过中药系统药理数据库和分析平台(traditional Chinese medicine systems pharmacology,TCMSP,https://old.tcmsp-e.com/tcmsp.php)[16]检索三七中化学成分,以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18为初步筛选条件。此外,检索已发表文献补充非此范围内的重要化合物信息。将上述所有候选化合物导入Gene Cards数据库(http://www.genecards.org/)获得相应的靶点信息[17]。
1.2 结直肠癌相关靶点自基因表达综合(gene expression omnibus,GEO)数据库(http://www.ncbi.nlm.nih.gov/geo/)检索“Colorectal Cancer”,筛选相关数据集,最终选择GSE25070数据集[18]。该数据集来源于GPL6883芯片平台,为结直肠癌及其匹配的临近非肿瘤结直肠组织的基因表达分析阵列,共26例患者信息。使用GEO2R进行分析,筛选其中P<0.05及|logFC|>1的差异基因作为结直肠癌相关靶标,并使用微生信进行作图(http://www.bioinformatics.com.cn/)。
1.3 三七治疗结直肠癌靶点并构建三七“活性成分-作用靶点-疾病”网络利用在线Venn工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)将三七有效成分靶点与结直肠癌相关靶标取交集,得到三七主要成分对结直肠癌的治疗靶点。将这些差异基因与相应的活性成分作为节点(Node),相互作用作为连接(Edge)导入Cytoscape软件(3.7.2版本)[19],构建三七治疗结直肠癌的“活性成分-靶点-疾病”网络图。
1.4 PPI网络构建将三七药物和结直肠癌交集靶点导入STRING数据库(https://string-db.org)构建蛋白互作(protein-protein interaction,PPI)网络模型[20]。其中生物种类设置为“Homo spaiens”,隐去无连接靶点,其余采用默认设置,获得PPI网络后导入Cytoscape(版本3.7.2)进一步可视化,根据度值(Degree)大小设定节点大小和颜色,结合分数的大小设定边(Edge)粗细。
1.5 三七成分-结直肠癌靶点功能及通路富集分析将三七治疗结直肠癌的靶点录入Metascape平台(http://metascape.org/gp/index.html)[21],设置P<0.01,最小富集值1.5,最小重合靶点3,富集分析其主要生物学过程及代谢通路,结合log10的值及P<0.01和文献研究结果选取排名前20的数据,上传至微生信平台(http://www.bioinformatics.com.cn/)和Origin 9可视化分析。
1.6 三七活性成分-结直肠癌靶点-通路网络拓扑图构建利用Cytoscape 软件(3.7.2版本)构建“三七活性成分-结直肠癌靶点-通路”网络图,通过软件内置插件对三七活性成分及靶点拓扑参数进行分析,参数主要为度值、介度和紧密度,并根据这些参数判断核心靶点和主要药效活性成分。
1.7 活性成分-靶点分子对接从PDB数据库(http://www.rcsb.org)获得靶点蛋白结构,在Pymol软件(www.pymol.org)中除去配体和其他不相关分子,使用Autodock软件进行分子对接,Pymol软件对结果进行可视化分析。
2 结果
2.1 三七主要活性成分及作用靶点获取TCMSP平台符合筛选条件的三七化学成分共8个,分别为:豆甾醇、槲皮素、十八碳十二烯、人参皂苷Rh2、人参皂苷F2、邻苯二甲酸二异辛酯、食脂素、β-谷甾醇。同时查阅文献,检索结果显示,三七入血成分中三七皂苷R1、人参皂苷Rb1、人参皂苷Rg1、人参皂苷Rd均为三七抗结直肠癌的重要活性成分[22-23]。此外,三七中多种皂苷经肠道菌群代谢后产生的人参皂苷CK也是潜在的抗结直肠癌活性成分[24-25]。因此,结合筛选的三七化学成分和文献检索结果,共获得13个有效成分,具体活性成分基本信息见表1。将13种化合物导入Gene Cards数据库中获取相应靶标,使用相关分数(relevance score)≥1进行筛选,合并后删去重复值,共得到相关靶点614个。

表1 三七活性成分基本信息
2.2 结直肠癌相关靶点分析自GEO数据库GSE25070数据集筛选得到756个结直肠癌差异基因,删除重复基因后,共获得706个与结直肠癌相关靶点,其中下调基因462个,上调基因244个。分别采用火山图和热图展示差异基因及标志差异基因的分布情况。在火山图中,红色代表上调基因,蓝色代表下调基因,见图1。

图1 结直肠癌差异基因表达热图(A)、火山图(B)
2.3 三七活性成分治疗结直肠癌的“活性成分-作用靶点-疾病”网络构建获取三七主要活性成分的作用靶点和结直肠癌疾病靶点的交集,交集结果见图2。共得到三七活性成分-结直肠癌共同靶点63个,参与调控的三七活性成分12个。基于此结果构建“三七化合物-作用靶点-结直肠癌”网络,结果见图3。该网络包含77个节点和219条边,其中槲皮素有34个靶点,十八碳十二烯有38个靶点,人参皂苷F2有13个靶点,人参皂苷Rb1有14个靶点,人参皂苷Rd有17个靶点,人参皂苷CK有14个靶点,每个有效成分均关联两个或以上作用靶点,每个靶点也均关联两个或以上成分,充分展现了中药“多成分-多靶点”治疗疾病的特点。

图2 三七成分-结直肠癌靶点韦恩图
2.4 PPI网络构建及分析将获得的“三七成分-结直肠癌”共同靶点63个提交到STRING平台,获得靶点蛋白互作网络,将此数据导入Cytoscape软件(版本3.7.2)进一步可视化,结果见图4。该网络图中共有62个节点,279条边。节点大小和颜色与度值相对应,节点越大,由蓝色到橙色对应的度值越大,边的粗细与结合分数值相对应,结合分数值越大边越粗。其中最靠前的靶点分别为血管内皮生长因子A(vascular endothelial growth factor,VEGFA),丝裂原活化蛋白激酶-3(mitogen activated protein kinase,MAPK3),白细胞介素-1β(interleukin-1β,IL-1β),细胞周期素D1(cyclin D1,CCND1),重组人趋化因子8(recombinant human eotaxin 8,CXCL8)及MMPs,这些靶点为潜在的关键靶点。

图4 三七-结直肠癌核心靶点PPI网络
2.5 靶点功能及通路富集分析通过Metascape平台对三七调控结直肠癌相关靶点进行富集分析,并使用微生信平台和Origin 9.0可视化结果,见图5。从图5中可见多个靶点和结直肠癌的产生有紧密联系。图5A表明,三七主要参与的生物学过程有脂肪酸代谢过程、一元羧酸代谢过程、炎症性应答、上皮细胞分化调控等方面;图5B表明,相关靶点治疗结直肠癌的功能主要富集于一元羧酸结合、细胞因子活动、氧化还原酶活性、信号受体激活活动等;图5C表明,发生变化细胞组分主要包括细胞膜小凹、血小板微粒膜及内质网。利用Metascape平台分析三七治疗结直肠癌潜在靶点的KEGG通路(P<0.01),见图6和表2,三七治疗结直肠癌的潜在靶点主要涉及IL-17信号通路、TNF信号通路、PPAR信号通路、药物代谢等。GO及KEGG通路富集涉及细胞凋亡、免疫调节、细胞生长等多个生物学过程;涉及疾病通路包括结直肠癌和炎症性肠炎等通路以及IL-17、Toll样受体、核因子-κB等炎症相关通路和胆汁酸代谢。

表2 三七治疗结直肠癌靶点通路富集结果

注:A:GO-BP分析;B:GO-MF分析;C:GO-CC分析
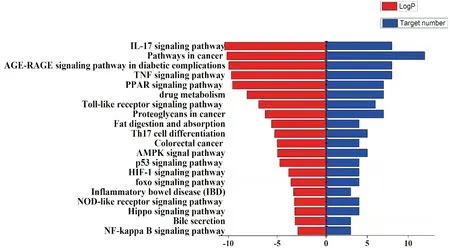
图6 三七治疗结直肠癌主要成分潜在靶点的KEGG通路富集分析
2.6 三七成分-结直肠癌-通路网络构建采用Cytoscape软件进行三七成分-结直肠癌-通路网络构建,使用软件内置Network Analyzer对三七治疗结直肠癌的网络拓扑学参数进行分析,获得核心成分和作用靶点,结果见图7和表3。该网络有77节点和236条边。其中度值较大的活性成分包括十八碳十二烯(度值28,介度0.337 6及紧密度0.517 0),槲皮素(度值26,介度0.248 3及紧密度0.524 1),人参皂苷Rd(度值15,介度0.050 9及紧密度 0.444 4),人参皂苷CK(度值13,介度0.036 1及紧密度 0.434 3),人参皂苷Rb1(度值13,介度 0.037 1 及紧密度0.429 4),人参皂苷F2(度值12,介度 0.030 4 及紧密度0.429 4)等。度值较大的靶点蛋白主要有CCND1、IL-1β、MAPK3、FOS等,见表4,这些可能是三七治疗结直肠癌的潜在作用靶点。

注:椭圆形节点为药物活性成分,矩形为作用靶点,倒三角形为通路;节点的面积代表其度值,面积越大表明该节点越重要
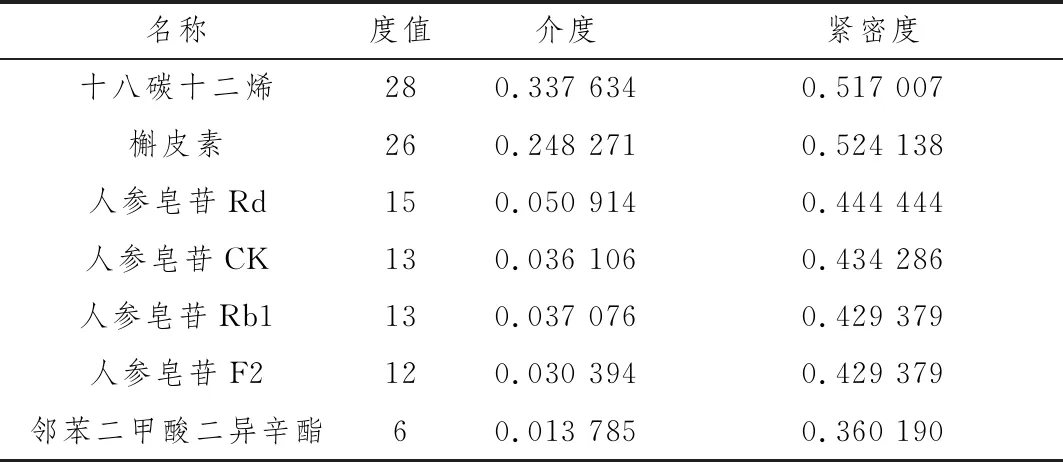
表3 三七主要活性成分网络节点特征参数

表4 主要靶点网络节点特征参数
2.7 活性成分-靶点分子对接结果将2.6项中核心活性成分,与关键靶点CCND1(6p8e)、IL-1β(2nvh)、MAPK3(4qtb)进行分子对接和结合能力预测,见表5。分子结合能小于-5 kcal·mol-1为结合能力较佳,从结果可以看出人参皂苷CK和槲皮素与各蛋白亲和力较好,可能是三七发挥抗结直肠癌作用的主要活性成分,而其他活性成分与这些蛋白亲和力一般。

表5 活性成分-靶点结合能
3 讨论
结直肠癌的发生是一个复杂而连续的过程。它涉及了遗传、蛋白质组学、代谢和微生态网络,包括对DNA损伤、基因突变、种群动态、炎症和代谢-免疫平衡的反应、肠道菌群失调等[26-28]。传统中药具有天然来源、多靶点和整体理念等独特优势,在治疗复杂疾病,特别是对单独使用西药反应差的疾病方面具有优势。课题组前期结果表明,三七可以抑制结直肠癌小鼠肿瘤的进程,但具体机制尚不明确[8]。本研究采用基于网络药理学的方法揭示三七治疗结直肠癌的药理作用,为治疗结直肠癌提供新的治疗策略。
本研究采用网络药理学的方法,初步从三七中筛选出化学成分13个及作用靶基因614个,通过与结直肠癌的靶点取交集,共获得12个活性成分及63个靶基因,并构建了三七“活性成分-结直肠癌靶点”网络。结果表明,三七中多数化合物均调控两个以上靶点,其中槲皮素、人参皂苷Rd、人参皂苷CK、人参皂苷Rb1分别作用34个、17个、14个、14个靶点,在网络中具有重要地位,可能是潜在的治疗结直肠癌的关键物质。不同的成分作用于不同的靶点,同时也有一些成分同时作用于同一靶点。由此可以看出,三七的多种活性成分或许可以协同调控多个靶点来发挥作用。
槲皮素是一种类黄酮物质,可通过调节多种生物途径治疗结直肠癌在内的多种疾病[29-30]。研究表明,其可通过调控β-catenin和APC蛋白表达,诱导肿瘤细胞凋亡,抑制肿瘤细胞增殖等途径治疗小鼠结直肠癌[31]。人参皂苷Rd对结直肠癌的转移具有较好的抑制作用,该作用可能是通过调控表皮生长因子受体实现[32]。此外,人参皂苷Rd还可通过调控结直肠癌小鼠肠道有益菌和有害菌数目、提高肠黏膜免疫功能、恢复肠黏膜结构等方面治疗结直肠癌[33]。人参皂苷Rb1是一种人参属植物中重要的活性物质,其经肠道菌群代谢后可转化为人参皂苷CK,而人参皂苷CK在抗炎和促进肿瘤细胞凋亡方面作用更强[34-35],这与分子对接结果中人参皂苷CK可以更好地结合炎症相关因子IL-1β和凋亡相关蛋白CCND1结果一致。
PPI网络结果显示,MAPK3、IL-1β、CCND1、VEGFA、CXCL8、FOS和MMPs等位于PPI网络核心位置的基因,提示这些靶点可能是三七治疗结直肠癌的关键靶点。IL-1β和CXCL8均为免疫反应中较为重要的细胞因子,二者都可诱发炎症反应,促进肿瘤炎症性微环境的产生。IL-1β结合IL-1受体(IL-1R)后,可激活p38、MAPK、JNK、核因子-κB等多条通路[36-37]来调控肿瘤发生发展。此外,IL-1β可以通过调控CXCL8、MMP-1、MMP-9 增强肿瘤细胞的迁移性和侵袭性,进而可促进肿瘤转移[38]。FOS也是结直肠癌转移的关键基因。研究证实,随着结直肠癌组织中c-FOS蛋白表达增加,患者的存活率明显下降[39]。VEGFA通过VEGFA/VEGFAR通路激活p38-丝裂原活化蛋白激酶(p38-MAPK)和磷脂酰激酶B(AKT)来诱导MMPs基因表达,进而促进肿瘤细胞的侵袭[40],靶VEGF/VEGFR信号通路的药物在结直肠癌治疗中也显示出较好疗效[41-42]。CCND1在结直肠癌组织中的表达显著高于癌旁组织[43];且其作为Wnt/β-catenin的末端靶基因之一,与结直肠癌发生发展都有紧密联系[44]。这些研究与本研究结果共同表明,IL-1β、MAPK3、CCND1、VEGFA、CXCL8、FOS和MMPs可能是三七治疗结直肠癌的关键靶点。分子对接结果显示,槲皮素和人参皂苷CK与IL-1β和CCND1具有较好的结合能力。这也证明了三七可能通过结合这些靶点来调控结直肠癌的发生发展。
GO功能富集分析和KEGG通路富集分析结果表明,三七治疗结直肠癌主要与脂肪酸代谢、炎症反应、细胞凋亡等有关。其中IL-17信号通路、TNF信号通路、Toll样受体信号通路、p53信号通路和核因子-κB信号通路都已被证实与结直肠癌的病理进程相关。IL-17是一种促炎因子,在结直肠癌组织中显著升高[45]。研究表明,IL-17可通过刺激结直肠癌细胞中VEGF的产生来促进血管生成[46];刺激PGE2、MMP-9和MMP-13的产生来促进结直肠癌细胞的迁移[47-48]。TNF-α在结直肠癌细胞的增殖、分化、转移中起关键作用[49-50]。Toll样受体信号通路是促进结直肠癌发生的重要通路,它在结直肠上皮止血和激活先天和适应性免疫应答中发挥重要作用[51]。目前,已有部分针对Toll样受体的相关制剂应用于治疗结直肠癌的临床试验中[52]。肿瘤抑制蛋白p53是细胞应激下诱导细胞周期阻滞、衰老和凋亡的转录因子。其突变发生在40%~50%的散发性结直肠癌中,与结直肠癌的预后息息相关[53]。核因子-κB信号通路是结直肠癌细胞增殖、凋亡、炎症、血管生成、转移和耐药的关键调控因子[54]。研究表明,抑制NF-kB通路还可使结直肠癌细胞对化疗和放疗敏感,为肿瘤治疗提供更有效的策略[55-56]。
高摄入量的膳食脂肪和炎症性肠炎均被认为是诱发结直肠癌的高风险因素[57-58]。高脂肪饮食的促肿瘤活性可能归因于其对肠道微生物群组成和代谢的影响,特别是在胆汁酸方面。而KEGG富集分析结果表明,脂肪吸收和消化、炎症性肠炎以及胆汁分泌均与三七治疗结直肠癌作用相关。研究证实,三七皂苷治疗结直肠癌作用与调控肠道菌群丰度相关[8],表明三七或可通过介导肠道菌群治疗结直肠癌。此外,三七还可能通过PPAR信号通路、AMPK信号通路、HIF-1信号通路、Hippo信号通路发挥作用。
本研究结果显示,三七中同一物质可对不同靶点进行调控,而同一靶点也可对不同信号通路进行干预,体现了三七可通过多通路、多靶点联合调控结直肠癌的特点。这为后续三七抗结直肠癌研究提供了理论依据,为后续挖掘三七药物-靶点相互作用机制奠定了基础,但仍需后期的实验研究进一步论证。

