当归芍药散治疗卵巢癌的网络药理学及分子对接分析*
赵欣杰,司富春,张漂,刘子提
河南中医药大学/河南省中医方证信号传导重点实验室/河南省中医方证信号传导国际联合实验室,河南 郑州 450046
卵巢癌作为严重威胁女性生殖健康的恶性肿瘤,因缺乏早期症状与体征,患者发现时已多处于中晚期,病死率高,5年生存率为20%~25%[1]。据统计,全球范围内共有295 414例新发卵巢癌确诊和184 799例死亡病例[2],对女性健康产生了巨大威胁,对卵巢癌的治疗与防控应该引起更高的重视。当归芍药散源于《金匮要略》,临床用于治疗盆腔炎性疾病[3]、卵巢癌[4]、卵巢囊肿[5]、痛经[6]等妇科疾患,效果显著。结合药理学研究结果发现:当归对肿瘤细胞增生的抑制作用是通过抗炎、抗氧化、抗肿瘤等药理作用实现的[7];赤芍除常见中药功效之外,还有保肝、抗肿瘤等多种药理作用,通过免疫系统调节、周期凋亡基因表达调控等途径诱导肿瘤细胞死亡[8];白术通过下调卵巢癌细胞CDK1表达阻止细胞增殖,抑制肿瘤的进一步进展[9];茯苓、泽泻等通过对细胞周期的调节达到抑制肿瘤进展的效果[10-11];川芎在肿瘤的治疗作用中集中表现为抑制细胞增殖和基因表达,从而诱导细胞凋亡[12]。成分多、靶点多、通路多是中药复方治疗疾病的突出特点,本文采用网络药理学方法研究当归芍药散对卵巢癌的作用机制,以期为临床治疗提供借鉴。
1 资料与方法
1.1 获取药物活性成分和对应靶标在中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php)检索“当归”“赤芍”“白术”“茯苓”“泽泻”“川芎”的主要活性成分,并选定口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18的活性成分[13],查询获取相应候选靶标。
1.2 分析预测靶标对应基因以“人”为限定种类,对当归芍药散药物候选靶标导入Uniprot数据库(https://www.uniprot.org/),获取对应基因和UNIPROTKB。
1.3 获取卵巢癌靶标基因及药物潜在作用靶标利用Genecards数据库(https://www.genecards.org/)检索“ovarian cancer”,获取疾病基因,并对比复方靶标,获取重合基因作为潜在作用靶标。
1.4 构建成分-靶标网络图利用Cytoscape3.8.0软件对药物活性成分及作用靶标进行分析,绘制网络关系图。
1.5 核心靶标互作网络构建限定STRING数据库种类为“人类物种(Homo sapiens)”,获取潜在靶标蛋白互作关系,利用绘图软件做出关系图。
1.6 富集分析基因本体(gene ontology,GO)功能富集分析、京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析结果从DAVID数据库(https://david.ncifcrf.gov/)获取,利用Rstudio对P<0.05的前20个通路进行高级气泡图的绘制。
1.7 绘制成分-靶标-通路图将所得可能与卵巢癌相关的通路、作用靶标和活性成分导入Cytoscape3.8.0软件,绘制网络关系图。
1.8 预后生存分析对预测核心基因进行Kaplan-Meier Plotter数据库在线识别,获取预后信息,并通过Gene Expression Profiling Interactive Analysis(GEPIA)网站对卵巢癌和正常人基因水平进行深入鉴定。
1.9 分子对接将PPI网络中排名靠前的有效活性成分结构保存为mol2格式,并在PDB数据库(http://www.rcsb.org/)下载靶蛋白数据文件,借助Autodock Tools软件对其进行去水、加氢、计算电荷并进行分子对接分析。
2 结果
2.1 当归芍药散候选活性成分利用TCMSP数据库,获取复方中单味药活性成分共计568个,以OB≥30%、DL≥0.18为限定条件,挑选符合条件的活性成分70个,见图1。

图1 当归芍药散活性成分
2.2 候选靶标预测活性成分对比Uniprot数据库,获取药物作用靶标,并将其对比疾病基因,选取可能与卵巢癌相关作用靶标72个,见表1。

表1 当归芍药散潜在作用靶标信息
2.3 活性成分-靶标网络利用Cytoscape3.8.0软件构建成分-靶标网络图(图2)。其中含节点101个(活性成分30个,作用靶标71个),边181条,红色节点代表活性成分,紫色代表靶标,对应关系用灰色线条展现。由图2可得,活性成分与靶标并非单纯一一对应,而是复杂多样的对应关系,这说明当归芍药散治疗卵巢癌存在多靶点的特点。

图2 当归芍药散成分-靶标网络图
2.4 核心基因互作分析利用STRING数据库获取核心靶标,并使用Cytoscape3.8.0软件构建相互作用网络图(图3)。其中包含77个节点和952条边。节点越大、颜色越深,则表示连接度越高。故而肿瘤抑制因子(TP53)、血管内皮生长因子A(VEGFA)、前列腺素G /H合酶2(PTGS2)、转录因子p65(RELA)、转录因子AP-1(JUN)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)、孕激素受体(PGR)7个靶标可作为核心靶标。

图3 当归芍药散核心靶标相互作用网络图
2.5 GO功能富集分析和KEGG通路富集分析在DAVID数据库获取GO和KEGG富集结果,筛选P<0.05的通路和生物过程进行进一步分析,P值越小,说明该通路与当归芍药散治疗卵巢癌关系越密切(图4、图5、图6中,横坐标是Gene Ratio,纵坐标是富集出来的通路,点越大表示富集基因越多,颜色越深表示P值越小,关系越密切)。GO富集分析中细胞组分(cellular component,CC)富集化比例较大体现在胞质(Cytosol)、胞核(Nucleus)等(图4),分子功能(molecular function,MF)主要为酶结合(Enzyme binding)(图5),生物过程(biological process,BP)的是药物反应(Response to drug)、RNA聚合酶Ⅱ启动子转录的正调控(Positive regulation of transcription from RNA polymerase Ⅱ promoter)、雌二醇反应(Response to estradiol)等(图6)。KEGG通路富集结果(图7)显示乙型肝炎通路、肿瘤通路等通路与当归芍药散治疗卵巢癌的密切相关。

图4 当归芍药散活性成分对应靶标的CC分析

图5 当归芍药散活性成分对应靶标的MF分析
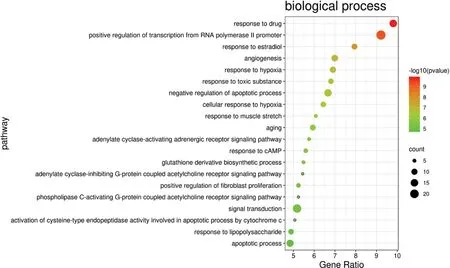
图6 当归芍药散活性成分对应靶标的BP分析

图7 当归芍药散活性成分对应靶标的BP分析
2.6 分析构建成分-靶标-通路关系在Cytoscape3.8.0软件中绘制如图8所示成分-靶标-通路网络图,并使用蓝色三角形、红色圆形、绿色六边形分别代表活性成分、靶标基因和相关通路。黄芩素(baicalein)、β-谷甾醇(beta-sitosterol)、豆甾醇(Stigmasterol)、杨梅酮(Myricanone)、鞣花酸(ellagic acid)等是药物作用的主要成分,靶标基因主要是TP53、VEGFA、RELA、JUN等,关联到磷酸酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase-Akt signal transduction pathway/protein kinase B,PI3K/Akt)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等信号通路。

图8 成分-靶标-通路网络图
2.7 基因生存分析将采用Cytoscape3.8.0软件筛选出的VEGFA、TP53、PTGS2、RELA、JUN、MMP9、PGR等7个核心基因导入到Kaplan-Meier Plotter中,结果显示:上述7个基因的表达与卵巢癌患者的生存率呈负相关,提示卵巢癌患者预后可能与VEGFA等基因表达水平密切相关(图9)。为明确卵巢癌与正常人基因表达水平,利用GEPIA网站分析7个与预后不良靶标基因,发现5个基因具有显著的表达水平,见图10。

图9 基因表达与患者预后的生存曲线(P<0.05)

注:红色表示肿瘤组织,灰色表示正常组织
2.8 分子对接结果选取度值靠前的黄芩素(baicalein)、β-谷甾醇(beta-sitosterol)、豆甾醇(Stigmasterol)、杨梅酮(Myricanone)、鞣花酸(ellagic acid)等5个活性成分与排名靠前的TP53、VEGFA、RELA、JUN进行分子对接验证。如结合能<0,则配体和受体蛋白可以自发结合,结合能<-5.0 kcal·mol-1,表明结合活性良好[14],见表2。结果发现,黄芩素、β-谷甾醇、豆甾醇、杨梅酮、鞣花酸均与TP53有较好的结合能力,VEGFA与杨梅酮不具备自发结合能力,RELA和黄芩素、鞣花酸结合能力较好,JUN则仅与β-谷甾醇有较好结合能力。随后,利用 PyMOL 软件对靶点蛋白和成分对接进行可视化分析,直接展现其构象关系(以黄芩素为例),见图11。

图11 黄芩素与核心标点基因的分子对接

表2 成分与靶点结合能
3 讨论
“妇人腹中诸疾痛,当归芍药散主之[15]。”临床对当归芍药散的应用很多,集中表现在妇科领域。方中药物所含主要成分当归多糖[16]、赤芍总苷[17]、川芎挥发油[18]、白术内酯Ⅰ[19]、茯苓多糖[20]、泽泻醇B[21]等都可以通过不同途径抑制肿瘤细胞生长。刘刚[22]通过文献研究发现,当归芍药散加味治疗卵巢癌的总体有效率达到89.76%。高升等[23]发现,当归芍药散可以降低肿瘤坏死因子-α的表达,抑制炎症反应,提高生存质量。此外,复方药物还可以通过免疫调节“下丘脑-垂体-卵巢”轴治疗妇科疾病。本文通过网络药理学对方病进行了关联性研究,进一步明确当归芍药散的作用机制,以期为临床治疗提供借鉴。
研究发现,当归芍药散发挥作用的主要成分是黄芩素、过氧麦角甾醇、鞣花酸。其中,黄芩素可通过激活Caspases和Bcl-2家族蛋白诱导卵巢癌HO-8910细胞凋亡[24],过氧麦角甾醇会随着药物剂量的增加影响卵巢癌细胞A2780S早期凋亡率[25],鞣花酸经实验验证有较广泛的抗肿瘤作用,可通过降低体内基质金属蛋白酶抑制肿瘤生长水平[26]。
作用靶标网络图结果显示,肿瘤抑制因子、转录因子p65、MMP9、孕激素受体等是当归芍药散作用于卵巢癌的核心靶标。其中肿瘤抑制因子基因上调后可抑制卵巢癌细胞周期进程,促进癌细胞凋亡[27],NF-κB/p65可能通过增强APR3的表达,促进卵巢癌的发生、发展[28];MMP9通过诱导细胞形态变化,使细胞逐渐分离、扩散,从而影响卵巢癌细胞膜MUC16蛋白表达[29];孕激素可能通过细胞周期进程,从而影响卵巢癌SKOV3、HO-8910细胞的增殖、迁移及侵袭能力[30]。预后分析结果发现,肿瘤抑制因子、MMP9、孕激素受体与预后关系十分密切,之后研究可着重分析。
经过文献检索和KEGG通路富集分析,当归芍药散治疗卵巢癌主要涉及Pathways in cancer、Hepatitis B、PI3K-Akt、MAPK、VEGF等通路。焦晓路等[31]在研究中发现,PI3K-AKT信号通路与卵巢癌发生、发展以及化疗耐药程度都有明显相关性,可以介导细胞迁移、侵袭,抑制自噬凋亡,在临床上可根据这一表现将其作为治疗靶点;MAPK信号通路受到PFKFB3对肿瘤细胞糖代谢影响,从而调控促进卵巢癌细胞的增殖迁移,可将阻断MAPK信号通路作为卵巢癌生物治疗的研究方向[32];通过低剂量分次照射抑制VEGF表达可影响卵巢癌细胞对顺铂的敏感性[33]。
最后,本研究通过分子对接技术对排名前5位的活性成分和靶点蛋白进行分析,结果显示黄芩素、鞣花酸与关键靶点蛋白结合时的结合能均小于 5.0 kcal·mol-1,提示其有良好的结合活性,说明当归芍药散对卵巢癌发挥作用时主要通过黄芩素、鞣花酸等对靶点来实现。
综上,当归芍药散主要通过黄芩素、鞣花酸等活性成分实现对TP53、MMP9、PGR等细胞基因的表达,从而调控PI3K-Akt、MAPK、VEGF等通路,抑制卵巢癌细胞的增殖迁移过程。由此可见,当归芍药散治疗卵巢癌具有多成分、多靶标、多通路的特点,且预后效果良好。本研究针对药物活性成分、靶标基因进行了成方治疗卵巢癌作用机制的探讨,但未进行实验验证,下一步应从多方面展开实验验证,以期为临床提供指导。

