抗纤益心方通过调节RhoA/ROCK2信号通路改善扩张型心肌病大鼠心肌纤维化*
杨凤鸣,边汝涛,王振涛
河南中医药大学第二附属医院,河南 郑州 450002
扩张型心肌病(dilated cardiomyopathy,DCM)是一种以心室扩大并伴有收缩功能障碍为特征的非缺血性心肌病,临床以心力衰竭为主要表现,并可出现心律失常、猝死等并发症[1]。患者病情呈进行性加重,常因心力衰竭症状加重而反复住院,约50%的患者可在5年内出现死亡,临床预后差。目前,本病治疗方案同其他原因引起的心力衰竭相似,以β受体阻滞剂、利尿剂、血管紧张素转化酶抑制剂等药物为主,尚无特异性治疗药物[2]。
抗纤益心方是河南中医药大学第二附属医院王振涛教授根据DCM的病机特点研制的有效方药,方药组成:黄芪30 g,红参12 g,丹参15 g,茯苓15 g,升麻9 g,益母草15 g,泽兰15 g,麦冬12 g,白术15 g。方中重用黄芪以补宗气,红参善补脾胃又可大补元气,白术可运脾强胃,进而维持胃纳脾运正常,辅以升麻升阳举陷;因DCM患者病机复杂,常有瘀血、水湿停留,故加入茯苓、益母草、丹参、泽兰等化瘀利水,佐以麦冬防止过燥伤阴。前期研究表明,本方不仅可以改善DCM患者心功能,促进心室逆重构[3],还可以减轻DCM大鼠心肌组织病理损伤,通过调节基质金属蛋白酶的活性改善胶原合成和降解之间的平衡,降低心肌间质Ⅰ、Ⅲ型胶原表达水平[4-6],但其抑制心肌纤维的机制仍不明确。研究表明,Ras 同源蛋白家族成员A (ras homologous family member A,RhoA)及调控因子Rho相关卷曲螺旋形成蛋白激酶2(rho associated coiled coil forming protein kinase 2,ROCK2)在心肌纤维化中发挥重要的作用[7],本研究以RhoA/ROCK2 信号通路为切入点,建立DCM大鼠模型,探讨抗纤益心方抑制心肌纤维化的可能作用机制,为临床治疗DCM提供新的理论依据。
1 材料
1.1 实验动物4周龄SPF 级Wistar雄性大鼠80只,体质量为(50±18)g,购买自北京维通利华实验动物技术有限公司,合格证编号:SYXK(京)-2016-0006,饲养于河南省中医院实验动物中心,恒温恒湿,温度控制在(22±2) ℃,湿度为50%~60%,12 h/12 h明暗交替。所有动物实验操作均符合相关管理准则并通过河南省中医院实验动物伦理委员会审查(审查批号:2019-03-07)。
1.2 药物与试剂抗纤益心方颗粒(四川新绿色药业科技发展有限公司,批号:17010092);卡托普利(上海信谊药厂有限公司,规格:每片20 mg,批号:63470904);呋喃唑酮(天津力生制药股份有限公司,规格:每片0.1 g,批号:1905012)。HE染色试剂盒、Masson染色试剂盒(北京索莱宝科技有限公司,货号:G1120、G1340);可溶性生长刺激表达基因2蛋白(soluble growth stimulating factor 2,sST2)试剂盒、半乳糖凝集素-3(galectin-3,Gal-3)试剂盒(武汉华美生物工程有限公司,货号:CSB-E13789h、CSB-EL012887RA);β-actin、RhoA抗体、ROCK2抗体、肌球蛋白磷酸酶靶标亚基1(myosin phosphatase target subunit 1,MYPT1)抗体(武汉三鹰生物技术有限公司,货号:60008-1-LG、10749-1-AP、21645-1-AP、22117-1-AP);磷酸化肌球蛋白磷酸酶靶标亚基1(phospho-MYPT1,p-MYPT1)抗体(美国Cell Signaling Technology公司,货号:4563T);辣根过氧化物酶(horseradish peroxidase,HRP)标记的兔抗山羊lgG、HRP标记的山羊抗小鼠lgG(武汉赛维尔生物科技有限公司,货号:GB23204、GB23301)。
1.3 仪器Acuson Cypress型西门子超声仪(德国西门子公司);FC-51119150型酶标仪(赛默飞仪器有限公司);HD-330型生物切片机(湖北惠达仪器有限公司);ICES-003型高倍显微镜(日本尼康公司);170-4070型垂直电泳仪、170-8265型凝胶图像分析系统(美国Bio-Rad公司)。
2 方法
2.1 模型建立、分组与给药4周龄SPF 级Wistar雄性大鼠80只,适应性喂养1周后,随机数字表法选取10只作为正常组,其余70只参照本课题组前期造模方法,用呋喃唑酮溶液(700 mg·L-1)自饮水喂养建立DCM模型[8-9]。10周后行超声心动图检测,与正常组比较,造模大鼠左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左心室收缩末期内径(left ventricular end-systolic diameter,LVESD)显著升高(P<0.01),左心室射血分数(left ventricular ejection fraction LVEF)、左心室短轴缩短率(left ventricular short axis shortening rate,LVFS)显著降低(P<0.01)为造模成功。将45只造模成功大鼠随机分为模型组、抗纤益心方高、中、低剂量组及卡托普利组,每组9只。根据人与实验动物用药剂量换算方法[10],大鼠的等效剂量相当于人的 6.3 倍,抗纤益心方颗粒成人每日用量17.2 g,成年人体质量按60 kg计算,抗纤益心方高、中、低剂量组大鼠按3.6 g·kg-1、1.8 g·kg-1、0.9 g·kg-1的剂量灌胃,卡托普利组大鼠灌胃剂量为 10.125 mg·kg-1,正常组、模型组灌胃等体积的生理盐水。药物干预同时,除正常组,其余组大鼠继续饮用呋喃唑酮溶液以保证致病因素的持续存在。药物连续干预4周,末次给药后禁食不禁水12 h,采用体积分数4%水合氯醛以8 mL·kg-1剂量腹腔注射麻醉,麻醉成功后进行各指标检测。
2.2 心脏功能检测将大鼠仰卧位固定于大鼠板上,选择合适角度通过M型超声心动图在左侧胸骨旁检测LVEDD、LVESD,选取3个不同心动周期结果取平均值,采用Teichholtz法[11],计算大鼠LVEF和LVFS。
2.3 病理组织学检查腹主动脉取血后迅速开胸摘取心脏,在预冷的无菌生理盐水中冲洗残留血液,切取部分左心室组织用体积分数4%多聚甲醛溶液固定。将固定好的心室组织包埋脱水后以5 μm厚度行石蜡切片,根据试剂盒提供的方法行HE染色和Masson染色,随机选择5个视野进行观察,光学显微镜下观察各组心肌组织中肌红蛋白、细胞结构形态及心肌纤维化情况并记录,并计算每张切片心肌中胶原容积分数(collagen volume fraction,CVF)[12]。
2.4 ELISA法检测血清中sST2和Gal-3的水平超声检测后,在无菌工作台用无菌手术剪打开腹腔,分离出腹主动脉进行取血,每只约2 mL,室温静置30 min,3 000 r·min-1离心15 min,取上清即为血清。按照试剂盒说明书检测血清中sST2和Gal-3的水平。
2.5 Western Blot法检测心肌组织中RhoA、ROCK2、MYPT1、p-MYPT1蛋白表达水平将心室组织在RIPA裂解缓冲液中匀浆,离心后提取总蛋白上清液。BCA法蛋白定量后电泳分离总蛋白,随后转移至PVDF膜上,以5%脱脂蛋白奶粉 37 ℃ 封闭,4 ℃过夜孵育一抗(RhoA、ROCK2、MYPT1及p-MYPT1稀释比例分别为:12 000、11 500、12 000、1500)。洗涤后二抗孵育 1.5 h(特异性兔抗山羊IgG抗体145 000稀释;山羊抗小鼠IgG抗体16 000稀释)。化学发光试剂盒显影,Image Lab凝胶图像系统分析各条带的光密度值,以β-actin为内参标化各样品蛋白电泳条带的光密度值,以正常组蛋白表达水平为基准进行统计分析。

3 结果
3.1 抗纤益心方对DCM大鼠心脏功能的影响在药物干预过程中,模型组大鼠死亡2只,抗纤益心方中、低剂量组大鼠各死亡1只,正常组和卡托普利组大鼠因灌胃操作不当各死亡1只。超声心动图检查大鼠心脏功能发现,与正常组相比,模型组大鼠LVEDD、LVESD显著升高(P<0.01),LVEF、LVFS显著降低(P<0.01);与模型组比较,抗纤益心方高、中剂量组和卡托普利组大鼠LVEDD、LVESD显著降低(P<0.05),LVEF、LVFS显著升高(P<0.05),而抗纤益心方低剂量组大鼠的心功能改善不明显。见表1。

表1 各组大鼠心脏功能的比较
3.2 抗纤益心方对DCM大鼠心肌组织病理的影响HE染色显示,正常组大鼠心肌细胞排列整齐,结构完整。模型组大鼠心肌肿大、紊乱、死亡,肌红蛋白排列紊乱;抗纤益心方高、中剂量组和卡托普利组大鼠心肌细胞水肿减轻,肌红蛋白排列改善明显;而抗纤益心方低剂量组大鼠病理改善不明显,仍有大量心肌细胞肿大、肌红蛋白排列紊乱。Masson染色结果显示,正常组大鼠心肌组织胶原蛋白沉积不明显。与正常组比较,模型组大鼠心肌组织胶原蛋白过度沉积,心肌纤维化明显,CVF显著增加(P<0.01);与模型组比较,抗纤益心方高、中剂量组和卡托普利组大鼠心肌组织胶原蛋白沉积改善,心肌纤维化明显减轻,CVF显著降低(P<0.05);而抗纤益心方低剂量组大鼠心肌组织胶原蛋白沉积改善不显著。见图1-图2,表2。

表2 各组大鼠CVF结果的比较
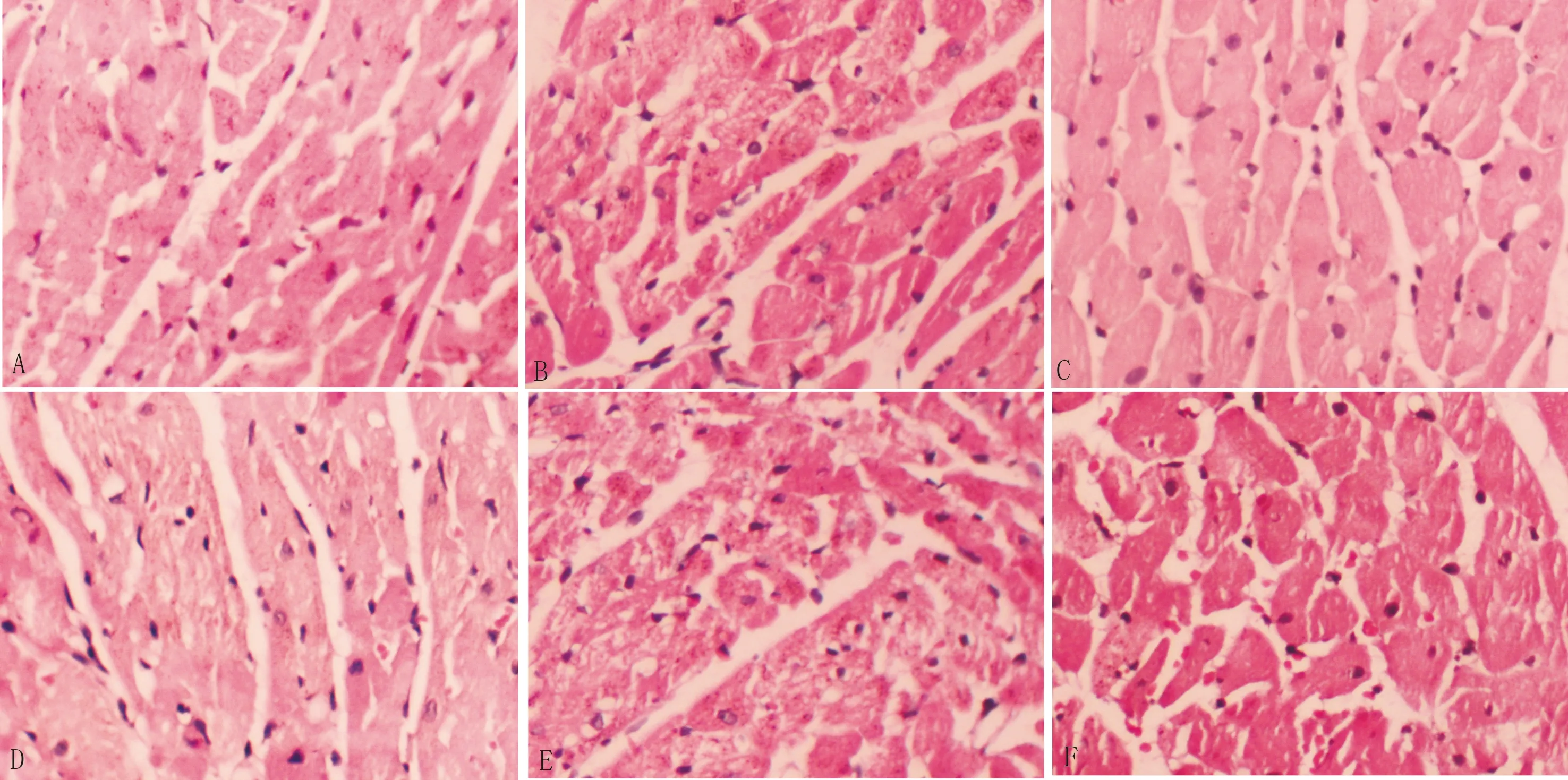
注:A:正常组;B:模型组;C:抗纤益心方高剂量组;D:抗纤益心方中剂量组;E:抗纤益心方低剂量组;F:卡托普利组

注:A:正常组;B:模型组;C:抗纤益心方高剂量组;D:抗纤益心方中剂量组;E:抗纤益心方低剂量组;F:卡托普利组
3.3 抗纤益心方对DCM大鼠血清中sST2和Gal-3含量的影响与正常组相比,模型组大鼠血清中sST2和Gal-3含量明显增加(P<0.01);与模型组相比,抗纤益心方高、中剂量组和卡托普利组大鼠血清中sST2和Gal-3含量降低(P<0.05),抗纤益心方低剂量组大鼠血清中sST2和Gal-3的水平变化不显著。见表3。

表3 各组大鼠血清中sST2和Gal-3含量的比较
3.4 抗纤益心方对DCM大鼠心肌组织中RhoA、ROCK2、MYPT1、p-MYPT1蛋白表达水平的影响与正常组比较,模型组大鼠心肌组织中RhoA、ROCK2蛋白表达水平显著升高(P<0.01),MYPT1蛋白磷酸化水平显著升高(P<0.01);与模型组比较,抗纤益心方高、中剂量组与卡托普利组RhoA、ROCK2蛋白表达水平降低(P<0.05),MYPT1蛋白磷酸化水平显著降低(P<0.05);而抗纤益心方低剂量对各蛋白的表达量无明显影响。见图3,表4。

注:A:正常组;B:模型组;C:抗纤益心方高剂量组;D:抗纤益心方中剂量组;E:抗纤益心方低剂量组;F:卡托普利组

表4 各组大鼠RhoA、ROCK2、MYPT1及p-MYPT1蛋白表达的比较
4 讨论
DCM根据临床表现与中医的“心胀”“喘证”“胸痹”等相对应。既往研究认为,DCM多为心气亏虚。本课题组通过长期理论研究和临床观察发现宗气下陷为DCM的基本病机,在宗气“贯心脉”理论指导下,研制了具有益气活血的方药抗纤益心方,在临床使用中根据患者舌脉、心率、血压等变化调整使用剂量,取得了良好的疗效。抗纤益心方作为中药复方,通过网络药理学、蛋白组学、代谢组学等联合分析发现,其可通过调节细胞凋亡、细胞能量代谢及部分与心肌纤维化相关的蛋白而发挥作用[13-14]。现代药理学研究表明,抗纤益心方组成药物中的黄芪甲苷、黄芪多糖、人参皂甙Re等有效成分具有抑制心肌纤维化作用[15-16],这可能是本方发挥治疗作用的物质基础。
心室重构是DCM的主要病理表现,而过度的心肌纤维化使心室收缩、舒张功能受损,是导致本病恶化的重要机制[17-18]。在DCM的早期,心肌细胞代谢异常可导致细胞凋亡、坏死,而心肌为了维持收缩功能导致纤维化增加,过度的心肌纤维化可增加心肌的硬度、降低心脏功能、改变心脏电生理结构。心肌纤维化的主要特征在于胶原代谢的异常和心肌各型细胞比例的失调,而胶原代谢失调主要来源于心肌成纤维细胞的转化和胶原蛋白的异常分泌,进而导致各型胶原比例失调。心肌纤维化受多种刺激因子调控,如血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)、儿茶酚胺、生长转化因子-β1等。研究表明,呋喃唑酮可通过抑制儿茶酚胺清除,导致心肌细胞肿胀、坏死,进而导致心肌纤维化的发生[19],能够反应DCM心室重构的病理过程,故本研究选用呋喃唑酮复制的DCM大鼠模型用于抗纤益心方的机制研究。卡托普利作为治疗DCM的基础用药,可改善并抑制心肌纤维化[20],因此本实验选择卡托普利作为阳性对照药物。本研究发现,抗纤益心方可以改善心脏功能,抑制DCM大鼠心肌纤维化水平,改善心肌组织病理损伤,与前期研究结果一致[4-8]。
近年来,多种血清标志物用于预测心肌纤维化与不良事件之间潜在联系,sST2和Gal-3作为心肌纤维化的生物标志物和心力衰竭、DCM患者预后评估的重要指标[21]。多项研究证实,抑制Gal-3水平会减缓心肌纤维化的进展。本研究发现,抗纤益心方可以降低模型大鼠血清中sST2和Gal-3含量,可能与改善心肌纤维化水平有关。此外,在DCM心肌中存在神经体液系统的过度激活,而过度激活的RAS系统可升高心肌局部AngⅡ 水平,AngⅡ 作为重要的神经体液因子,不仅对心血管系统具有调节功能,还是多种病理活动的重要因素。研究发现,AngⅡ 可通过激活RhoA/ROCK2信号通路表达促进心肌纤维化的发生,但其机制仍需进一步探索。
RhoA属于小Ras超家族中小分子G蛋白之一,生理状态下参与平滑肌收缩、细胞分裂和细胞运动等。RhoA及下游效应分子ROCK是细胞内多种信号通路的中转站[22]。ROCK包括两个高度同源亚基,即ROCK1和ROCK2,两者普遍存在于各种组织中。ROCK2过度激活可促进成纤维细胞转分化,使胶原蛋白代谢失衡,从而引起心肌纤维化[23-24]。目前研究认为,ROCK2是平滑肌收缩功能中最重要的下游效应靶蛋白,其表达水平可通过检测其下游底物MYPT1磷酸化水平评估。因此,MYPTI与p-MYPTI的表达水平常可反映ROCK的活性[25]。RhoA/ROCK2信号通路在成纤维细胞增殖、转分化中占有重要的地位,既可以直接促进肌成纤维细胞对胶原蛋白的分泌,也可以激活其他纤维化相关信号通路,因此,抑制RhoA/ROCK2信号通路过度上调是治疗心肌纤维化的新靶点[26-27]。本研究同样发现,DCM模型大鼠心肌组织中RhoA/ROCK2信号通路过度激活,而抗纤益心方可以通过调节RhoA/ROCK2信号通路中关键分子RhoA、ROCK2、p-MYPTI的表达水平抑制心肌纤维化。
综上所述,抗纤益心方可能是通过调节RhoA/ROCK2信号通路的表达发挥改善DCM大鼠心肌纤维化的作用。本研究为临床上DCM的治疗提供理论依据,并为更好地了解抗纤益心方的作用机制提供新的信息。

