血清胃蛋白酶原和幽门螺旋杆菌抗体检测对胃癌及萎缩性胃炎的早期诊断价值
郭金香
萎缩性胃炎为胃黏膜腺细胞出现损伤所导致的一种慢性炎症发展过程,也是胃癌的癌前病变状态。胃癌作为较常见的消化道恶性肿瘤之一,具有较高的致死率,早期胃癌应用内镜实施根治性治疗,提升患者生存率,但现阶段临床对早期胃癌的诊治率较低,尚不足10%[1-2]。胃镜与胃黏膜组织活检作为胃癌诊断的金标准,但均具有侵入性,因此不适用于筛查或普查中,还需寻求方便、快捷、非介入性、重复性良好、可动态监测的检查项目为筛查方法,以便于早期确诊,防治病情的进一步发展[3-4]。血清学检查在临床应用较为广泛,具有检测结果准确、创伤性小等优势,PG是胃蛋白酶的无活性前体,随着疾病的发展,血清PGⅠ与PGⅡ水平出现上升,但PGⅠ随后会逐渐下降,进而维持在较低的水平,而PGⅡ升高到一定水平后,将维持这一水平直至癌变,因此PGR变化能有效反映出患者胃黏膜组织情况。幽门螺旋杆菌(Hp)是目前公认的胃癌危险因素,当机体感染幽门螺旋杆菌会出现活动性慢性胃炎,主要于胃窦定植,后续可发展为肠化生、黏膜萎缩[5-6]。本文分析了血清PG和HP-IgG抗体检测对胃癌及萎缩性胃炎的早期诊断价值。
1 资料与方法
1.1 一般资料 选取2019年5月—2021年5月信阳市人民医院消化科接收的82例行胃镜检查患者为研究对象,依据病理学检查结果进行分组,21例胃黏膜正常者为对照组,28例萎缩性胃炎患者为萎缩性胃炎组,15例早期胃癌(癌细胞仅限于机体黏膜及黏膜下层)患者与18例进展期胃癌(癌细胞侵润肌层、浆膜层和(或)浆膜外层)患者为胃癌组(33例)。其中对照组男11例,女10例,年龄37~68(50.15±4.47)岁;萎缩性胃炎组男15例,女13例,年龄36~68(50.21±4.42)岁;胃癌组男17例,女16例,年龄37~69(50.18±4.46)岁。3组患者的基线资料比较差异均无统计学意义(P>0.05)。本研究经我院医学伦理委员会审批同意。纳入标准:(1)患者对本研究知情且自主同意参与;(2)患者参与本研究前均接受胃镜检查和(或)黏膜病理学组织活检检查;(3)患者符合各项胃镜检查、活检检查指征。排除标准:(1)参与本研究前3个月内使用可影响研究结果的特殊药物,如H2受体拮抗剂、质子泵抑制剂等;(2)确诊其他恶性肿瘤者;(3)存在肝脏、肾脏功能障碍者;(4)合并高血压等慢性疾病患者。
1.2 检验方法 患者检查前均已禁食8 h,采集静脉血进行离心处理,离心转速为1 000 r/min,时间为10 min,并将获取的血清标本置于-70°的冰箱中储存,应用上海研尊生物科技有限公司生产的PGⅠ、PGⅡ检测试剂盒测定PGⅠ、PGⅡ水平,检测方法为酶联免疫吸附测定法,并计算PGR比值;应用上海酶联生物科技有限公司生产的HP-IgG抗体试剂盒测定HP-IgG抗体结果,检测方法为酶联免疫吸附测定法。
1.3 观察指标 (1)3组患者血清PGⅠ、PGⅡ、PGR水平、HP-IgG抗体检测结果;(2)ROC曲线确定血清PGⅠ、PGR诊断胃癌的诊断效能,分析血清PGⅠ、PGR、HP-IgG抗体单一及联合检测胃癌效能。

2 结果
2.1 3组血清PGⅠ、PGⅡ、PGR、HP-IgG抗体检测结果比较 3组血清PGⅠ、PGⅡ、PGR水平、HP-IgG抗体阳性率比较差异有统计学意义(P<0.05),胃癌组与萎缩性胃炎组PGⅠ、PGR水平均低于对照组(P<0.05),PGⅡ、HP-IgG抗体阳性率均高于对照组(P<0.05),胃癌组PGⅡ、HP-IgG抗体阳性率高于萎缩性胃炎组(P<0.05),PGⅠ、PGR低于萎缩性胃炎组(P<0.05)。见表1。
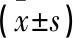
表1 3组血清PGⅠ、PGⅡ、PGR、HP-IgG抗体检测结果比较
2.2 分析血清PGⅠ、PGR、HP-IgG抗体单一检测与PGⅠ、PGR、HP-IgG抗体联合检测胃癌的诊断效能 ROC曲线分析显示,以42.84μg/L为最佳截断值,PGⅠ检测胃癌的约登指数为0.452,AUC为0.768(95%CI:0.716~0.843),灵敏度为69.70%,特异度为75.51%%,准确度为73.17%;以3.13为最佳截断值,PGR检测胃癌的约登指数为0.503,AUC为0.802(95%CI:0.784~0.815),灵敏度为72.73%,特异度为77.55%,准确度为75.61%;HP-IgG抗体单一检测胃癌的约登指数为0.563,AUC为0.842(95%CI:0.803~0.875),灵敏度为84.85%,特异度为71.43%,准确度为76.83%;PGⅠ、PGR、HP-IgG抗体联合检测胃癌的约登指数为0.633,AUC为0.897(95%CI:0.861~0.932),灵敏度为93.94%,特异度为69.39%,准确度为79.27%;PGⅠ、PGR、HP-IgG抗体联合检测灵敏度、准确度、约登指数高于PGⅠ、PGR、HP-IgG单一检测。见表2、图1。
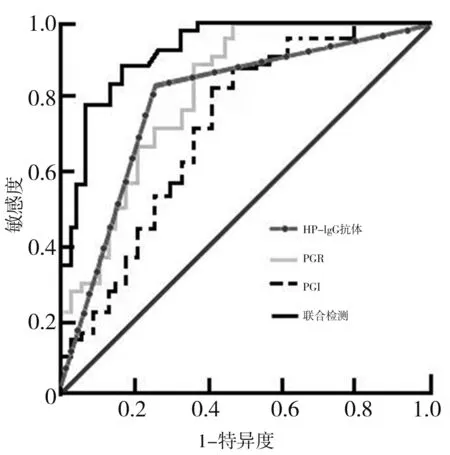
图1 血清PGⅠ、PGR、HP-IgG抗体诊断胃癌的ROC曲线
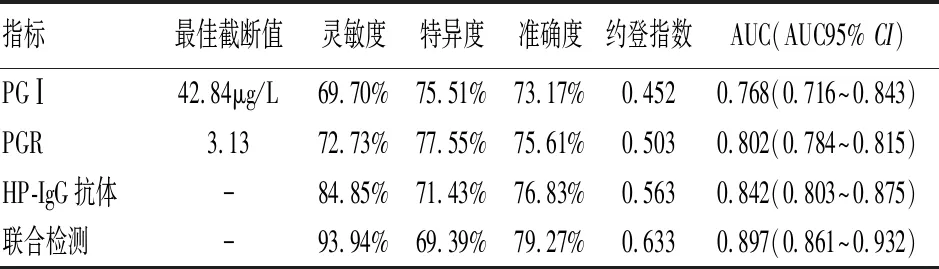
表2 血清PGⅠ、PGR、HP-IgG抗体单一检测与联合检测诊断胃癌的效能
3 讨论
胃癌的发展过程为非萎缩性慢性胃炎-萎缩性胃炎-肠上皮生化-胃癌,胃癌病程较缓,早期不易被发现,预后较差,因此需实施早期诊断[7-8]。临床通常以电子胃镜或病理学检查方式进行确诊胃癌,但所需费用较高,且具有侵入性,较难开展大范围的筛查工作,需寻求无创性筛查方法,继而提升胃癌早期诊出率[9]。
血清学指标是临床应用最广泛的疾病辅助诊断方式,因血清检查给患者带来的创伤性较小,检查结果特异度高,受检人群较容易接受。PG为天冬氨酸水解蛋白酶中的一种,于酸性环境中可被激活,进而转化为胃蛋白酶(具有消化功能),PG主要有PGⅠ、PGⅡ 2种,PGⅠ主要存在于机体胃底限与胃体的颈黏液细胞及主细胞,PGⅡ于胃窦、胃体、十二指肠腺及十二指肠近端部位较多[10]。PG经分泌后大部分可进入消化道,约有1%可进入血液系统,且进入的PG量较为稳定,能在患者血液中检测出,当机体胃黏膜出现病理性变化时,患者血清PG检测水平也会随着改变,称为“血清学活检”,可作为胃癌诊断的依据[11]。结果显示对照组、萎缩性胃炎组、胃癌组3组血清PGⅠ、PGⅡ、PGR水平比较差异有统计学意义,这与胃黏膜的萎缩肠化致使主细胞分泌的PGⅠ水平下降有关。
HP感染为胃炎、胃癌、消化性溃疡、淋巴瘤等胃部疾病的相关致病因素,患者感染HP后胃内的亚硝胺水平会出现升高,影响DNA损伤修复,继而出现异型增生或肠上皮化生,增加细胞恶变风险[12-13]。段超英等[14]学者研究表明,低水平的PGI、PGR及高水平的Hp阳性率提示患者存在萎缩性胃炎或早期胃癌风险,但并未深入研究以上指标诊断萎缩性胃炎及胃癌风险的诊断效能。孔凡立等[15]学者研究了PGⅠ、PGⅡ、Hp-IgG联合检测在胃部癌前病变及早期胃癌的诊断效能,并未研究其在萎缩性胃炎的诊断价值。本资料结果显示,对照组、萎缩性胃炎组、胃癌组3组HP-IgG抗体阳性率比较差异有统计学意义,提示HP-IgG抗体用于胃癌诊断特异性较高。ROC曲线分析显示,以42.84 μg/L为最佳截断值,PGⅠ检测胃癌的约登指数为0.452,AUC为0.768(95%CI:0.716~0.843),灵敏度为69.70%,特异度为75.51%%,准确度为73.17%;以3.13为最佳截断值,PGR检测胃癌的约登指数为0.503,AUC为0.802(95%CI:0.784~0.815),灵敏度为72.73%,特异度为77.55%,准确度为75.61%;HP-IgG抗体单一检测胃癌的约登指数为0.563,AUC为0.842(95%CI:0.803~0.875),灵敏度为84.85%,特异度为71.43%,准确度为76.83%;PGⅠ、PGR、HP-IgG抗体联合检测胃癌的约登指数为0.633,AUC为0.897(95%CI:0.861~0.932),灵敏度为93.94%,特异度为69.39%,准确度为79.27%;PGⅠ、PGR、HP-IgG抗体联合检测灵敏度、准确度、约登指数高于PGⅠ、PGR、HP-IgG单一检测。PGⅠ、PGR、HP-IgG抗体联合检测具有较高的准确度及灵敏度,误诊率较低。
综上所述,PGⅠ、PGR、HP-IgG抗体均可作为胃癌及萎缩性胃炎早期诊断方法,PGⅠ、PGR均可作为胃癌诊断评价标准,且联合检测准确度、灵敏度较高,值得临床大力推广。

