复合微生态制剂对小鼠肠道免疫功能的影响
白培钿 ,裴婷 ,孔佳美,杨逢清,李涛,王海东,任玉红
(山西农业大学 动物医学学院,山西 晋中 030801)
随着我国养殖业的迅速发展,抗生素作为饲料添加剂被大量用于畜禽疾病防治及促进畜禽生长。然而,抗生素的滥用导致耐药细菌大量产生,大大降低了药物疗效,同时药物在畜禽产品中大量残留,直接危害动物源性食品安全和人类健康。2017年6 月,我国农业农村部发布《全国遏制动物源细菌耐药行动计划(2017~2020 年)》的通知,要求我国从2020 年起在动物养殖生产中全面禁止使用人兽共用或容易产生耐药性的抗菌药物作为动物促生长剂[1]。微生态制剂能够改善动物肠道健康,提高生长性能,增强机体免疫力,但是微生态制剂存在活菌数低,不易保存等问题。酶制剂能够补充动物体内酶类的不足,消除抗营养因子,增强机体免疫力,但是酶制剂也存在稳定性差,不易保存等一系列的问题。近年来,研究者开始对益生菌和酶制剂的共同作用效果进行研究,提高益生菌剂和酶制剂的质量和作用效果。本课题组成功研制一种酶与微生态制剂复合组剂(申请公布号:CN113439798A)[2],以期应用于畜禽生产中,为养殖业“减抗禁促”提供新的饲料添加剂。本研究通过对小鼠灌胃不同剂量复合微生态制剂,研究其对小鼠肠道黏膜免疫功能、免疫器官指数及血液溶菌酶含量的影响,旨在为复合微生态制剂在养殖业的应用提供理论依据,同时为养殖业研制能替代抗生素的安全、高效及绿色的饲料添加剂提供理论参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
80 只28 日龄清洁级BALB/C 小鼠,体重为(16 ±2)g,雌雄各半购自山西医科大学实验动物中心【SCXK(晋)2019-0005】。饲养于山西农业大学动物实验室【SYYK(晋)2020-0003】,维持饲料购自山西医科大学动物实验中心。实验期间同室分笼喂养,饲养温度为(22 ± 2)℃,湿度为40%~60%,自由采光和饮水。本实验方案符合山西农业大学动物护理与使用委员会的要求(SXAU-EAW-2020SD0201)。
1.1.2 主要试剂与仪器
复合微生态制剂:由枯草芽孢杆菌、嗜酸乳杆菌、啤酒酵母菌、中性蛋白酶及纤维素酶所组成(总活菌数1.0×1011CFU/g),由微生态制剂研发课题组研制(专利申请号:20211059339 2.7)。IL-4、IL-10、IFN-γ、SIgA 检测试剂盒购自上海酶联生物科技有限公司;溶菌酶(LZM)检测试剂盒购自南京建成生物工程研究所;实时荧光定量试剂盒诺购自唯赞生物科技有限公司;TRIzol(美国life);反转录试剂盒为TaKaRa 产品等。
SpectraMax M5 酶标仪(Molecular Devices,美国);StepOnePlus 实时荧光定量PCR 仪(ABI,美国)等。
1.2 方法
1.2.1 实验动物分组
小鼠正常饲喂饲养7 d 后,按照随机分组原则分为4 组,每组雌雄各10 只,实验组持续灌胃复合微生态制剂28 d,对照组灌胃生理盐水。实验动物分组及处理见表1。

表1 实验动物分组Table 1 Groups of experimental animals
1.2.2 样品采集
在第14 天和第28 天,从各组随机选取10 只小鼠(雌雄各半),麻醉后采血,置于非抗凝采血管内,分离血清,用于溶菌酶含量的测定。采血后处死小鼠,取胸腺、脾和肠系膜淋巴结并称重,用于免疫器官指数测定。小鼠空肠样品的采集处理方法参照文献[3],用于总RNA 的提取和免疫细胞因子含量的测定,小鼠空肠黏膜免疫细胞因子(IL-4、IL-10、IFNγ)检测方法参照文献[4-5]。
1.2.3 生长性能的测定
在实验期间0、7、14、21 和28 d 时,对每组小鼠进行空腹称重,计算平均体重。
叙府变电站500 kV 11回出线A相CVT的连续24个时刻的量测值如图 1所示,其中,上半部分是原始数据,下半部分是利用基于经验模态分解的信号去噪法处理后的数据。
1.2.4 免疫器官指数的测定
免疫器官指数=免疫器官重量(mg)/体重(g)
1.2.5 溶菌酶的测定
按试剂盒说明测定各组小鼠血清溶菌酶浓度。计算数据以每毫升血清中所含微克溶菌酶表示,即μg/mL。严格按照试剂盒操作要求检测溶菌酶的活力,按公式计算溶菌酶含量。
溶菌酶含量=(测定透光度-空白透光度)/(标准透光度-空白透光度)×标准品浓度×样本测试前稀释倍数
1.2.6 空肠黏膜细胞因子及SIgA 含量测定
空肠黏膜细胞因子IL-4、IL-6、IFN-γ 以及SIgA含量测定参照ELISA 试剂盒说明书进行所有标准品和样本均设复孔。酶标仪检测各孔OD 值,计算肠道黏膜内细胞各细胞因子的浓度。
根据NCBI 上基因数据库查找目的基因IL-4、IL-10 和IFN-γ 以及内参GAPDH 相对应的基因序列,运用Primer 5.0 软件设计各基因的上下游引物(如表2 所示)。PCR 反应条件:95℃预变性10 min,95℃变性15 s,60℃退火30 s,65℃延伸30 s,40个循环。目的基因的相对表达水平用2-ΔΔCT表示。

表2 引物序列Table 2 Primer sequence
1.3 统计学分析
用SPSS 25.0 软件进行统计学处理,各组数据均采用单因素方差分析(one-way ANOVA),实验结果用平均值± 标准误差(¯x)表示,用GraphPad Prism 5 绘制柱状图。P<0.05 为差异具有统计学意义。
2 结果
2.1 复合微生态制剂对小鼠体重的影响
小鼠灌胃微生态复合制剂后,各阶段体重变化如表3 所示。从表3 可知小鼠在灌胃不同剂量的复合微生态制剂第7 天和第14 天,各组小鼠体重均有所增加,但无显著差异性(P>0.05);在第21 天和第28 天,中剂量组和高剂量组的小鼠体重增加明显,差异具有显著性(P<0.05),低剂量组的小鼠体重无显著性差异(P>0.05)。

表3 各组小鼠体重变化情况(g)Table 3 Changes of mice body weight in different groups(g)
2.2 复合微生态制剂对小鼠免疫器官指数的影响
由表4 可以看出,灌胃复合微生态制剂第14天,不同剂量的复合微生态制剂均能不同程度提高小鼠的免疫器官指数,且中剂量组差异具有显著性(P<0.05)。第28 天,低剂量组和高剂量组小鼠的脾指数和胸腺明显高于对照组,且差异具有显著性(P<0.05);中剂量组免疫器官指数极显著高于对照组(P<0.01)。
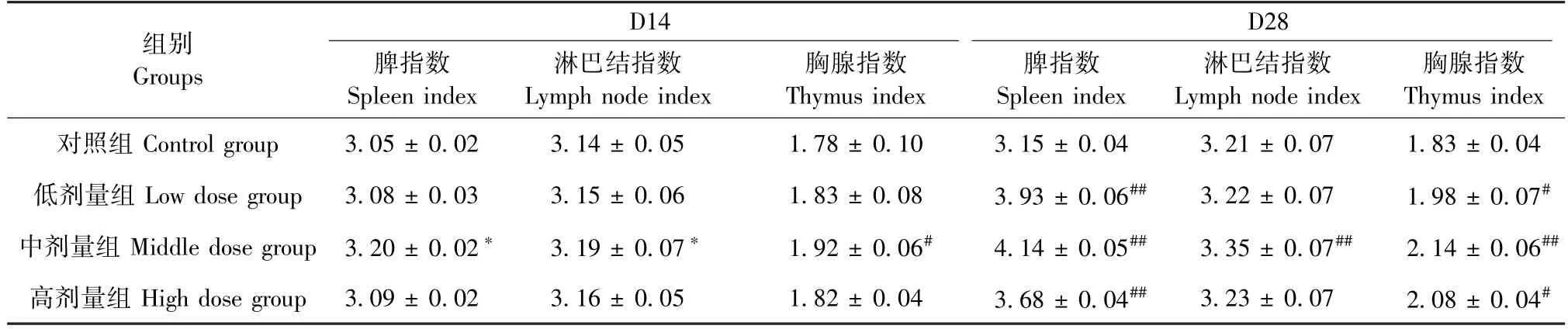
表4 复合微生态制剂对免疫器官指数的影响Table 4 Effect of the compound probiotics on immune organ index
2.3 复合微生态制剂对血清溶菌酶含量的影响
由图1 可知,在灌胃复合微生态制剂第14 天和第28 天,不同剂量的复合微生态制剂均能不同程度的提高小鼠血清中溶菌酶的含量。第14 天,低剂量组和中剂量组小鼠的溶菌酶含量均明显高于对照组,且差异极具显著性(P<0.01);高剂量组小鼠的溶菌酶含量增加,差异具有显著性(P<0.05)。第28 天,各实验组溶菌酶含量均明显高于对照组,差异极具显著性(P<0.01)。

图1 复合微生态制剂对小鼠血清溶菌酶含量的影响Note.Compared with control group,#P <0.05,##P <0.01.Figure 1 Effect of the compound probiotics on lysozyme in serum
2.4 复合微生态制剂对空肠黏膜免疫细胞因子含量的影响
由图2 可知,小鼠灌胃复合微生态制剂第14 天和第28 天,低剂量组空肠黏膜的IL-4 含量均呈不同程度高于对照组(P<0.05 或P<0.01);中剂量组空肠黏膜IL-4 含量显著高于对照组(P<0.01);高剂量组空肠黏膜IL-4 含量均无显著性差异(P>0.05)。第14 天,中剂量组空肠黏膜IL-10 含量高于对照组,差异具有显著性(P<0.05)。低剂量组和高剂量组空肠黏膜IL-10 含量与对照组无显著性差异(P>0.05);第28 天,各实验组小鼠空肠黏膜IL-10 含量呈不同程度高于对照组,其中,低剂量组和高剂量组显著高于对照组(P<0.05),中剂量组空肠黏膜IL-10 含量极显著增加(P<0.01)。小鼠在灌胃复合微生态制剂第14 天和第28 天,各实验组小鼠肠道黏膜IFN-γ 含量呈不同程度高于对照组。与对照组相比,中剂量组空肠黏膜IFN-γ 含量明显增加,差异极显著(P<0.01);低剂量组和高剂量组空肠黏膜IFN-γ 含量明显增加,差异显著(P>0.05)。

图2 微生态复合制剂对IL-4、IL-10 和IFN-γ 含量的影响Figure 2 Effect of the compound probiotics on IL-4,IL-10 and IFN-γ content
2.5 复合微生态制剂对空肠黏膜免疫细胞因子mRNA 表达水平的影响
由图3 可知,小鼠灌胃复合微生态制剂第14 天和第28 天,低剂量组空肠黏膜IL-4、IL-10 mRNA 表达量与对照组无显著性差异(P>0.05),IFN-γ mRNA 表达水平显著高于对照组(P<0.05)。中剂量组空肠黏膜IL-4、IL-10 和IFN-γ mRNA 表达量增加,差异极具显著性(P<0.01)。高剂量组空肠黏膜IL-4、IL-10 和IFN-γ mRNA 表达量不同程度高于对照组(P<0.01 或P<0.05)。

图3 复合微生态制剂对IL-4、IL-10 及IFN-γ mRNA 表达水平的影响Figure 3 Effect of the compound probiotics on the relative expression of IL-4,IL-10 and IFN-γ mRNA
2.6 复合微生态制剂对空肠黏膜SIgA 含量的影响
由图4 可知,小鼠灌胃复合微生态制剂第14天,低剂量组SIgA 含量显著高于对照组(P<0.05),中剂量组SIgA 含量明显高于对照组,且差异极具显著性(P<0.01);高剂量组的含量无显著性差异(P>0.05)。第28 天,各实验组小鼠空肠黏膜SIgA 含量均明显高于对照组,其中,中剂量组的SIgA 含量显著高于对照组,差异极具显著性(P<0.01);低剂量组和高剂量组SIgA 含量增加,差异均具有显著性(P<0.05)。

图4 复合微生态制剂对空肠黏膜SIgA 含量的影响Figure 4 Effect of the compound probiotics on SIgA content in jejunal mucosa
3 讨论
免疫器官指数是评价机体免疫力的一项重要指标[6],能反映身体免疫反应的水平,免疫器官指数升高代表机体免疫力提高,免疫器官指数降低则为机体免疫能力降低[7-8]。脾、胸腺和淋巴结是机体的免疫器官,具有免疫功能,其中脾是免疫细胞储存的场所,能清除血液中异物、抗原及衰老死亡的红细胞[9];胸腺是T 细胞成熟的场所,参与机体细胞免疫[10]。淋巴结具有滤过淋巴、产生淋巴细胞的作用,还能进行免疫应答。张雷等[11]研究发现微生态制剂能够使雏鸡的免疫器官指数的增加,提高免疫力。本实验结果表明,不同剂量复合微生态制剂均可不同程度提高小鼠胸腺、淋巴结和脾的免疫器官指数,且中剂量组免疫器官指数高于其它两组,此结果与胡影等[12]的研究结果一致。这说明复合微生态制剂在一定程度上促进小鼠免疫器官的生长、发育,可增强小鼠机体的免疫力。
溶菌酶作为一种体内碱性小分子量的蛋白水解酶,是单核细胞、中性粒细胞和巨噬细胞的产物,对革兰氏阳性菌有显著的抑菌效果[13]。在动物体正常的防御、非特异性免疫和免疫反应中起着重要的作用,是构成机体非特异性免疫系统的重要因子之一。通过测定溶菌酶的活力,可估测机体的非特异性免疫的能力[14]。本研究中,灌胃不同剂量复合微生态制剂均可以增加小鼠血清中溶菌酶的含量,此结果与刘宇等[15]的研究一致。由此可见,复合微生态制剂作用于小鼠后,可促进小鼠产生并释放出溶菌酶,从而增加机体杀菌、抗感染的能力。
肠道黏膜免疫系统是肠道屏障的重要组成部分,与肠道上皮细胞相互作用、相互影响,保护肠道免受细菌、病毒等微生物的粘附和入侵及防止异物的吸收,起到机体第一道防线的作用。复合微生态制剂是由酶制剂和益生菌复合制成的复合组剂,其中的益生菌能够在肠道内定殖并改善菌群平衡,对宿主健康有益。益生菌进入机体后可参与活化肠道相关淋巴组织,诱导T、B 淋巴细胞和巨噬细胞分泌细胞因子,也可作用于肠道黏膜上皮细胞使黏膜局部T 细胞增殖和活化产生白介素-4(IL-4)、白介素-10(IL-10)和干扰素-γ(IFN-γ)等细胞因子以及使B 细胞产生Ig,直接或者间接调控肠道黏膜免疫[16-18]。其中IL-4 能够促进Th0 细胞向Th2 细胞分化,促进B 淋巴细胞增殖分化,诱导IgE 和IgG 产生,也可促进NK 细胞的增殖、分化使产生IFN-γ 的能力增强,调节免疫反应应答[19-20]。IL-10 属于Th2型细胞因子,主要由Treg 细胞分泌,有抑制Th1 细胞分泌IL-2、IL-3、集落刺激因子和肿瘤坏死因子-α的作用而发挥抗感染作用。同时,也可刺激B 细胞分化增生,促进抗体生成[21]。IFN-γ 主要由活化的Th1 细胞和NK 细胞产生,可刺激巨噬细胞活化的作用,促进抗原呈递细胞表达MHCⅡ类分子,提高抗原递呈能力,增强NK 细胞和CTL 细胞的杀伤活性,促进B 淋巴细胞分化、增殖;抗病毒感染和抗肿瘤作用[22]。本研究发现复合微生态制剂可增加空场粘膜IL-4、IL-10 和IFN-γ 的含量及mRNA 表达水平,其结果与崔畅婉等[23]的研究结果一致。低剂量组和中剂量组可促进小鼠肠道黏膜分泌IL-4 和IL-10,这可能是由于益生菌在黏膜表面和黏膜下层被肠黏膜淋巴样组织中的巨噬细胞吞噬并提取特征抗原传递给T、B 淋巴细胞和其他免疫细胞。适量的益生菌可刺激调节性T 淋巴细胞分化,使Th0 细胞分化为Th2 细胞,增加IL-4、IL-10 的含量[24-25]。复合微生态制剂可能通过不同途径来改善小鼠免疫功能。Rizzello 等[26]认为,乳酸菌的免疫调节功能主要体现在刺激NK 细胞增殖并增强其细胞功能,从而增强动物机体的抵抗力。Fink 等[27]报道嗜酸乳杆菌和干酪乳杆菌显著提高NK 细胞的活力和杀菌能力。本研究中,灌服复合微生态制剂可以提高小鼠空肠黏膜IFN-γ mRNA 表达水平及含量,这可能是由于嗜酸乳杆菌可通过Toll 样受体9 传导信号,增加小鼠派尔集合淋巴结中INF-γ 阳性细胞的数量[28-29],且添加适量复合微生态制剂可以促进树突状(DC)细胞分泌白介素-12,白介素-12 可以激活NK 细胞并促使其合成、分泌INF-γ[27,30]从而抑制病毒的复制,起到免疫调节作用和增强抗病毒能力。
肠道黏膜免疫系统由多种免疫成分组成,分泌性免疫球蛋白A(SIgA)是肠道黏膜免疫的主要保护效应,是防御病原菌在肠道粘附和定植的第一道防线。SIgA 通过结合聚合免疫球蛋白受体(pIgR)[31],从基底外侧表面传输到黏膜表面,用于保护肠黏膜上皮细胞,提升消化道黏膜防御功能[32]。有研究表明微生物种群的变化会影响固有免疫的激活,以维持黏膜稳态。Nagayama 等[33]给小鼠灌胃酵母补充物后,小鼠的空肠的SIgA 含量增加。本研究发现复合微生态制剂能够增加肠道黏膜SIgA 的分泌,这可能是益生菌在肠道定植后,自身及代谢产物作为抗原物质被M 细胞吞噬或内化形成内体,M 细胞内的抗原快速释放并被树状突细胞摄取,后者随之迁移至派尔集合淋巴结的T 淋巴细胞区或系膜淋巴结,将抗原提呈给初始T 淋巴细胞,激活Th2 细胞,产生大量白介素-5,活化派尔集合淋巴结生发中心的B 淋巴细胞,使其转化为浆细胞分泌IgA,提高SIgA 的含量水平[34]。表明复合微生态制剂可促进小鼠空肠粘膜IgA 浆细胞分泌SIgA,提高SIgA 在空肠黏膜的含量,增强小鼠空肠黏膜的免疫功能,减少肠道病原微生物的感染。
4 结论
复合微生态制剂能促进小鼠的生长,提高小鼠免疫器官指数及血液中溶菌酶的含量,增强小鼠抗感染的能力;复合微生态制剂能提高肠道黏膜免疫细胞因子的表达水平,促进肠道粘膜分泌免疫球蛋白,进而增强肠道黏膜免疫功能,减少肠道感染性疾病的发生。

