生物有机肥调控的碱性植烟土壤微生物群落多样性特征
濮永瑜,包玲凤,杨佩文,沈广材,张 庆,尹兴盛,施竹凤,裴卫华,刘月静,杨光伟,杨明英
(1.云南省烟草公司保山市公司,云南 保山 678000;2.云南省农业科学院农业环境资源研究所,昆明 650205;3.云南省烟草公司文山州公司,云南 文山 663000)
【研究意义】施肥作为农业生产中维持土壤肥力、提高作物产量和质量的重要农艺措施,可通过改变土壤理化性质、生物学活性和土壤环境,塑造土壤微生物群落,影响作物生长发育[1]。然而现代农业生产中存在化肥过量施用和施肥模式不合理等现象,给土壤养分、耕地质量和微生物群落结构带来巨大压力[2]。为了缓解化肥长期施用造成的负面影响,通常采用添加有机肥来改善耕地质量,有机肥释放的养分具有稳定持久的优点,更利于作物生长[3]。有研究表明,向耕地中添加有机肥替代部分化学肥料在农业可持续生产中具有巨大潜力[4]。【前人研究进展】土壤理化性质、养分含量和酶活性是评价土壤质量的关键指标,有机肥的添加可改善土壤理化性质和养分含量,提高土壤酶活性[5-6]。土壤微生物是土壤中最为活跃的部分,是衡量土壤质量的重要指标,直接或间接作用于土壤养分转化和物质循环,对维持土壤生产力和健康起重要作用,参与了土壤质量演替的全过程[7-8]。有机无机配施的施肥模式不仅可以快速提升土壤肥力,改善作物品质,还可以缓解长期单施化肥导致土壤生态环境恶化这一问题[9]。添加不同有机肥土壤理化性质、酶活性、微生物多样性和群落组成存在显著差异。桑文等[10]研究发现,化肥减量10%配施液体有机肥可显著提高番茄土壤肥力、改善微生物群落结构,营造一个良好的土壤微生态环境。王鹏等[11]研究表明,有机肥施用可有效提升山东烟区棕壤有机碳含量和酶活性。李银科等[12]研究发现,施用牛粪的高粱土壤微生物量、酶活性和土壤微生物丰度显著增加。因此,阐明生物有机肥输入后土壤理化性质和微生物群落组成差异,对于优化烤烟栽培具有参考价值。【本研究切入点】近年来,关于生物有机肥对土壤理化性质的报道较多,但对微生物群落结构的影响,特别是对细菌和真菌类群的功能研究相对较少。为此,本研究设置植烟土壤耕作前、深耕后以及深耕单施化肥、深耕配施有机肥和深耕配施生物有机肥等处理,分析测试土壤主要理化性质、酶活性和微生物种群结构组成。【拟解决的关键问题】解析土壤主要理化性质和酶活性与微生物种群丰度间的关系,揭示深耕配施生物有机肥模式下植烟土壤微生物群落构建机制,为完善保山地区烟草产业高效合理施肥和农业可持续健康发展提供科学依据。
1 材料与方法
1.1 试验设计
试验设置在云南省保山市西邑乡王寨村,99°18′15″E,24°58′34″N,海拔1620 m,年均温17.2 ℃,年均降雨量969 mm,土壤类型为黄壤,试验地作物种植模式为烤烟—蚕豆轮作。试验设5个处理:植烟土壤耕作前(处理BP)、植烟土壤深耕后(处理PA),深耕+化肥(处理CK)、深耕+化肥+有机肥(500 kg/hm2)(处理CN)、深耕+化肥+生物有机肥(4000 kg/hm2)(处理CS),每个处理3次重复。化肥∶复合肥(8∶16∶26)900 kg/hm2+氮钾肥300 kg/hm2;有机肥:农家肥发酵而成;生物有机肥:以菌渣、中药渣和草炭为原料,经充分腐熟发酵后,添加微生物菌剂经二次发酵即得,其中,N 质量分数19.82 g/kg,P2O533.78 g/kg,K2O 29.26 g/kg,ω(C)/ω(N)为20.97,多粘芽孢杆菌有效活菌数 ≥ 2.0 亿/g。全部的有机肥和生物有机肥作为基肥(环状塘肥)施用,其它主要栽培技术参照当地烤烟标准化生产技术方案执行,烤烟品种云烟系列(云烟105)。
1.2 试验方法
1.2.1 土壤样品采集 2020年10月烤烟收获期按照常规取样法取样。五点取样法取10~20 cm烤烟根际土,将5个点的土样混合为一个样本,挑出根系杂质,冰盒保存,带回实验室分为2份,1份过60目筛-80 ℃冷冻干燥,用于DNA提取;1份自然风干室温储藏,用于理化性质和酶活测定。
1.2.2 土壤理化指标测定 土壤容重(Bulk density,BD):环刀法;土壤pH:pH 仪测定;有机质(Organic matter,OM)含量:重铬酸钾外加热法测定;全氮(Total nitrogen,TN)含量:凯氏定氮法测定;碱解氮(Alkaline-ydrolyzed nitrogen,AN)含量:碱解扩散法测定;全磷(Total phosphorus,TP)含量:氢氧化钠熔融—钼锑比色法测定;速效磷(Available phosphorus,AP)含量:碳酸氢钠提取法测定;全钾(Total potassium,TK)含量:氢氧化钠熔融—火焰光度法测定;速效钾(Available potassium,AK)含量:盐酸浸提-AAS法测定。土壤蔗糖酶(Invertase,INV)和脲酶(Urease,URE)活性采用试剂盒(苏州瑞思公司生物科技有限公司)微板法测定,测定方法按照试剂盒说明书进行。
1.2.3 土壤微生物高通量测序 采用OMEGA试剂盒提取土壤微生物总DNA,提取方法参照操作说明书进行。提取的DNA 溶液经NanoDrop ND-2000 分光光度计和0.8%琼脂糖凝胶电泳检测所提取DNA 的质量、浓度和片段长度。土壤样本送至上海美吉生物医药科技有限公司进行Illumina MiSeq测序,引物对应区域:16S V3~V4区[338F/806R(5’-ACTCCTACGGGAGGCAGCA-3’/5’-GGACTACHVG GGTWTCTAAT-3’)];真菌ITS扩增引物序列为[ITS1F/ITS2R(5’-GGAAGTAAAAGT CGTAACAAG G-3’/5’-GCTGCGTTCTTCATCGATGC-3’)]。采用Qiime 2(v2020.2)分析流程进行序列去噪或ASV(Amplicon sequence variants)聚类,Bayes分类器进行物种注释,对比数据库为silva138/16s-bacteria和unite8.0/its-fungi,根据ASV在不同样本中的分布,评估每个样本的Alpha多样性水平。计算各样本的距离矩阵,衡量不同处理间的Beta多样性。根据16S rRNA测序结果,对土壤细菌进行BugBase表型预测,采用FUNGuild v1.0对土壤真菌进行FUNGuild功能预测,找出处理间的差异。
1.3 数据分析
通过上海美吉生物云平台进行PCoA分析、RDA分析,采用Excel 2010、SPSS 20、SigmaPlot 12.5进行统计分析、方差分析和绘图。
2 结果与分析
2.1 有机肥对土壤理化性质的影响
由表1可知,与处理PB相比,处理PA、CK、CN、CS土壤容重显著降低(P<0.05,下同),处理CK、CN、CS的pH、全钾含量显著降低,处理PA有机质、全磷、速效磷含量显著降低,处理CK、CN、CS有机质、全磷、速效磷和速效钾含量显著提升。与处理CK相比,处理CN土壤pH、速效钾降低;处理CS土壤pH、速效钾含量显著降低,有机质、全磷、速效磷含量显著增加。

表1 植烟土壤主要理化性质
2.2 土壤酶活性变化特征
从图1可见,蔗糖酶活性为45.36~64.81 d/(mg·g),脲酶活性为0.39~2.06 d/(mg·g)。与处理PB相比,处理CN、CS蔗糖酶显著提升,处理PA、CK、CN、CS脲酶显著提升。与处理CK相比,处理CN、CS蔗糖酶和脲酶活性显著增加。

图1 不同处理植烟土壤酶活性分析
2.3 土壤微生物群落结构特征
2.3.1 微生物群落Alpha多样性分析 土壤细菌16S rRNA、真菌ITS1基因高通量测序数据统计分析,分别得到Clean tags条数为205 725、630 030,基于≥97%的相似度水平,通过ASV划分和分类地位鉴定,去重后得到ASV总数为4251、3764。与处理PB相比,处理PA细菌、真菌Chao1指数显著降低,真菌Shannon指数显著降低,细菌Shannon指数无显著变化;处理CK真菌Chao1指数、Shannon指数降低,处理CN、CS真菌Chao1指数、Shannon指数显著增加。与处理CK相比,处理CN、CS细菌Chao1指数和Shannon指数无显著变化,真菌Chao1指数和Shannon指数显著提高(表2)。
表2 不同处理植烟土壤微生物Alpha多样性分析
2.3.2 微生物群落Beta多样性分析 基于ASV分类学水平的PCoA分析,采用bray-curtis距离算法,细菌(图2-a)群落和真菌(图2-b)群落的PCoA第一坐标贡献度分别为22.80%、38.46%。处理CK、CN、CS土壤细菌和真菌群落距离处理PB、PA均较远,即细菌和真菌物种组成有一定的差异性。处理CN、CS细菌、真菌群落与处理CK相似,表明深耕配施有机肥和生物有机肥细菌、真菌群落组成基本相似。真菌群落R值>细菌群落,表明不同施肥处理对真菌群落结构组成差异性的影响更为显著。

图2 不同处理植烟土壤中细菌(a)/真菌(b)ASV组成的主成分分析
2.3.3 微生物物种Venn图分析 不同样本中16S rRNA(图3-a)和ITS(图3-b)的ASV分析结果显示,与处理PB相比,处理PA细菌独有ASV数目增加,真菌ASV数目减少;处理CK细菌和真菌ASV数目均减少;处理CN细菌ASV数目减少,真菌ASV数目增加;处理CS细菌和真菌ASV数目均增加。与处理CK相比,处理CN、CS细菌和真菌独有ASV数目均增加。

图3 基于ASV分类水平植烟土壤中细菌(a)/真菌(b)Veen分析
2.3.4 微生物群落结构分析 由图4-a可以看出,所有样本在门水平上的细菌优势菌门为放线菌门Actinobacteria(29.94%~37.33%)、变形菌门Proteobacteria(14.07%~28.13%)、绿弯菌门Chloroflexi(14.20%~21.92%)、酸杆菌门Acidobacteria(9.44%~16.23%),占总丰度和的83.26%~86.78%。其中,与处理CK相比,处理CN Acidobacteri和Actinobacteria丰度无显著变化,Proteobacteria丰度显著增加,Chloroflexi丰度显著降低;处理CS Acidobacteria丰度显著增加,Chloroflexi、Actinobacteria丰度显著降低,Proteobacteria丰度无显著变化。由图4-b可知,所有样本在门水平上的真菌优势菌门为子囊菌门Ascomycota(58.05%~78.81%)、担子菌门Basidiomycota(3.51%~19.08%)、被孢霉门Mortierellomycota(0.97%~13.44%),占总丰度84.79%~93.60%。与处理CK相比,处理CN Basidiomycota丰度降低,Mortierellomycota丰度显著增加;处理CS Ascomycota丰度增加,Basidiomycota和Mortierellomycota丰度显著降低。

图4 基于门分类水平植烟土壤细菌(a)和真菌(b)群落组成
2.3.5 属水平上LEfSe物种差异分析 基于LEfSe分析,查找各处理在细菌属分类学水平上具有显著性差异的土壤微生物物种,结果见图5-a。处理PB、CN、CS分别有4、9、11个属的细菌种群存在显著性差异,处理PA和CK属的细菌种群则不存在差异显著性。真菌LEfSe分析见图5-b,处理PB、PA、CK、CN和CS分别有23、11、10、16、10个属的真菌种群存在显著性差异。

图5 基于属分类水平植烟土壤细菌(a)和真菌(b)LEfSe分析
2.4 土壤微生物群落与环境因子之间的相关性
细菌、真菌优势菌门与土壤理化性状相关性分析(图6)结果表明,Actinobacteria相对丰度与URE呈显著负相关(P<0.01);Proteobacteria与TP、AP、INV、URE呈极显著正相关,与pH、TK呈极显著负相关,与OM呈显著正相关(P<0.05,下同);Chloroflexi与TP呈极显著负相关,与TK呈显著正相关,与INV呈显著负相关。Ascomycota与TK呈极显著正相关,与INV、URE呈极显著负相关,与AP、AK呈显著负相关;Basidiomycota与TP呈显著负相关;Mortierellomycota与pH、TK呈极显著负相关,与AP、AK、INV、URE呈极显著正相关,与TP呈显著正相关。由图7-a可知,pH、有机质、全氮、全磷、全钾、有效磷、土壤容重、蔗糖酶和脲酶显著影响细菌群落结构,其中土壤容重影响最为显著。由图7-b可知,pH、有效磷显著影响真菌群落结构组成,其中pH影响最为显著。
X轴和Y轴分别为环境因子和物种,通过计算获得R值和P值。R值在图中以不同颜色展示,P值若小于0.05则用 * 号标出,右侧图例是不同R值的颜色区间。P值若小于0.05则用 * 号标出,* 代表0.01 < P ≤ 0.05,**代表0.001 < P ≤ 0.01,***代表P ≤ 0.001

图7 土壤环境因子与不同处理土壤细菌(a)/真菌(b)群落结构的冗余分析
2.5 BugBase表型预测
通过BugBase表型预测出个样本中土壤细菌的9种潜在类型为:好氧(Aerobic)、厌氧(Anaerobic)、移动元件(Mobile Element Containing)、兼性厌氧(Anaerobic Facultatively)、生物膜形成(Biofilm Forming)、革兰氏阴性(Gram Negative)、革兰氏阳性(Gram Positive)、致病性(Pathogenic)、氧化胁迫耐受(Oxidative Stress Tolerant)。各样本中均以好氧菌、含可移动元件菌、革兰氏阴性菌、致病性菌和氧化胁迫耐受菌为主。与处理PB相比,处理PA、CK、CN厌氧菌、革兰氏阴性菌和氧化胁迫耐受菌丰度降低,致病性菌丰度增加;处理CS好氧、含可移动元件、致病性和氧化胁迫耐受菌丰度显著增加,革兰氏阴性菌丰度降低。与处理CK相比,处理CN好氧和致病性菌丰度增加,处理CS好氧菌、含可移动元件菌和氧化胁迫耐受菌丰度增加。

图8 BugBase表型预测
2.6 FUNGuild功能预测结果
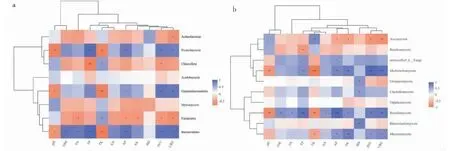
根据FUNGuild功能预测分析(图9-a)结果,真菌群落营养类型可分为9类,病理营养型(Pathotroph)、腐生营养型(Saprotroph)、共生营养型(Symbiotroph)、病理—腐生营养型(Pathotroph-Saprotroph)、病理—共生营养型(Pathotroph-Symbiotroph)、腐生—共生营养型(Saprotroph-Symbiotroph)、病理—腐生—共生营养型(Pathotroph-Saprotroph-Symbiotroph)、腐生—病理—共生营养型(Saprotroph-Pathotroph-Symbiotroph)和病原菌—腐生—共生营养型(Pathogen-Saprotroph-Symbiotroph)。处理PB以腐生营养型(36.38%)和病理—腐生—共生营养型(21.77%)为主,处理PA以病理营养型(27.13%)、腐生营养型(23.10%)和病理—腐生—共生营养型(25.51%)为主,处理CK以腐生营养型(44.09%)和病理—腐生—共生营养型(30.87%)为主,处理CN、CS均以腐生营养型(63.01%、44.62%)为主。
图9 FUNGuild功能预测
通过功能类群鉴定,检测出81种功能群,针对其中9种功能群进行分析(图9-b),病理营养型主要功能群为动物病原菌(Animal Pathogen)、真菌寄生菌(Fungal Parasite)和植物病原菌(Plant Pathogen);腐生营养型主要有木质腐生菌(Wood Saprotroph)、粪腐生菌(Dung Saprotroph)、叶子腐生菌(Leaf Saprotroph)和未定义腐生菌(Undefined Saprotroph);共生营养型主要为丛枝菌根真菌(Arbuscular Mycorrhizal)和外生菌根真菌(Ectomycorrhizal)。各样本均以植物病原菌和未定义腐生菌为主,与处理PB相比,处理PA和CK植物病原菌丰度显著增加,未定义腐生菌丰度下降;处理CN、CS植物病原菌和未定义腐生菌呈下降趋势。与处理CK相比,处理CN、CS植物病原丰度降低,未定义腐生菌丰度增加。
3 讨 论
3.1 深耕配生物有机肥对土壤微生物群落结构的影响
深耕配施生物有机肥对土壤微生物多样性和种群丰度影响不同。大量研究表明,长期单施化学肥料会导致土壤细菌、真菌丰富度和多样性降低,配施有机肥或单施有机肥可提高土壤细菌、真菌的丰富度和多样性[13-15]。本试验中,相较于处理CK,处理CN、CS植烟土壤细菌丰度和真菌丰度显著增加,其中细菌多样性无显著变化,真菌丰度显著增加。有研究表明,土壤微生物种群间存在着一定的竞争关系,某一种群的快速生长必然会因竞争营养、空间和生态位点,对其他种群的生长产生一定的抑制作用[16]。本研究中,相较于处理PB、PA,处理CN、CS土壤细菌丰度和多样性显著降低,真菌种群丰度和多样性显著增加,说明生物有机肥的投入对土壤真菌生长繁殖起了促进作用,可能是生物有机肥增加了适宜真菌生存的空间和增强了真菌对营养元素的竞争,从而抑制了细菌的数量;也可能是适宜细菌生存的pH为中性或微碱性,适宜真菌生长的pH为弱酸性或酸性,施用生物有机肥后土壤pH降低,促进真菌数量的增加[17]。土壤真菌/细菌(F/B)数量比可反映土壤肥力和健康状况,有研究指出F/B值较高时微生物对周围环境响应积极,农田生态系统具有较高的可持续性[18]。张明等[19]研究发现有机肥较单施化肥处理显著促进细菌、真菌生长和F/B,本研究结果与之相一致。
大量施肥方式的研究表明,各类土壤样本细菌优势菌门主要包括Proteobacteria、Acidobacteria、Chloroflexi、Actinobacteria等,且总相对丰度占细菌群落的70%以上[20-21];与细菌群落一样,有机无机配施土壤中真菌门子囊菌门(Ascomycota)占主导地位[22-23],本研究也得出相似结论。土壤微生物种群组成结果表明,细菌优势菌门为Acidobacteria、Proteobacteria、Chloroflexi、Actinobacteria,真菌优势菌门为Ascomycota、Basidiomycota、Mortierellomycota,各处理优势菌门组成基本相似,相对丰度差异性达到显著性水平。与处理CK相比,处理CN Proteobacteria、Mortierellomycota丰度增加,Chloroflexi、Basidiomycota丰度降低;处理CS Acidobacteria、Ascomycota相对丰度增加,Chloroflexi、Actinobacteria、Basidiomycota、Mortierellomycota丰度降低。进一步查找各处理间在属水平上具有显著性差异的物种,基于LEfSe分析结果表明单施化肥导致细菌和真菌差异性物种数减少,种群多样性呈降低趋势,而增施有机肥和生物有机肥可提高细菌和真菌差异物种数。
3.2 土壤环境因子与土壤微生物群落结构的耦合关系
土壤环境因子与土壤微生物是相互作用、相辅相成的,共同影响耕地生产力和作物生长。一方面,施肥可通过改变土壤理化性质和养分含量,间接引起微生物生长、代谢过程和群落组成发生变化,同时土壤养分作为土壤酶的代谢底物,其含量变化也影响土壤酶的活性;另一方面,土壤微生物会参与土壤有机质的分解和转化,其活性和组成的改变也导致自身代谢、死亡和沉积等改变,进而改变土壤理化特征[24]。本研究中添加有机肥和生物有机肥后,土壤pH由弱碱性向中性转化,原因可能是有机肥中有机物质在分解过程中产生的腐殖酸是包含有多种酸性功能团的弱酸,可增强土壤的酸碱缓冲能力,达到缓冲土壤pH的效果[25]。通过对环境因子和微生物种群间的Spearman相关性分析和冗余分析,结果表明不同的环境因子对微生物种群丰度和群落组成的影响不同,总体上来看,pH和有效磷对土壤细菌和真菌的影响较为显著。
3.3 深耕配施生物有机肥对土壤微生物功能类群的影响
本研究通过BugBase表型预测来揭示细菌功能性状对不同施肥模式的响应,结果发现配施生物有机肥处理好氧细菌丰度显著增加,相反厌氧菌的丰度下降。酸杆菌门宜在厌氧和微氧、pH低的环境中生存[26],配施生物有机肥后pH、酸杆菌丰度下降,土壤厌氧细菌丰度变化趋势一致。研究发现配施生物有机肥后可移动元件含量、细菌的生物膜形成、兼性厌氧菌和氧化胁迫耐受菌丰度增加,原因可能是这些功能类群涉及较多部分的是变形菌门一类,变形菌门大多是兼性或专性厌氧菌,大多数外膜由脂多糖组成,同时放线菌门和变形菌门具有较高的生态位偏好[27],而本研究中放线菌门和变形菌门配施生物有机肥后丰度呈上升趋势。FUNGuild功能预测结果表明,配施生物有机肥后真菌群落的营养类型主要是腐生营养型,群落功能主要是植物病原菌和未定义腐生菌。其中,营养类型中腐生营养型和病理营养型丰度呈上升趋势,粪腐生菌和未定义腐生菌丰度增加,说明向植烟土壤中添加生物有机肥增强了土壤真菌的分解能力;群落功能中植物病原菌丰度降低,说明向植烟土壤中添加生物有机肥降低了烟草的发病风险,从而减少经济损失。
4 结 论
深耕配施生物有机肥显著提高土壤有机质、全磷和速效磷含量以及蔗糖酶和脲酶活性,显著降低土壤pH;显著提高真菌Chao1指数和Shannon指数,并显著促进细菌和真菌群落差异性增强,而且对其群落结构组成差异性的影响更为显著;显著提高了放线菌门(Acidobacteria)、变形菌门(Proteobacteria)和子囊菌门(Ascomycota)的种群丰度,降低了绿弯菌门(Chloroflexi)、酸杆菌门(Actinobacteria)、担子菌门(Basidiomycota)和被孢霉门(Mortierellomycota)的种群丰度,导致属水平的细菌和真菌显著差异性物种增加。深耕配施生物有机肥显著影响土壤微生物功能类群,其中致病性细菌和植物病原真菌丰度显著下降。影响土壤细菌和真菌群落结构的主要理化因子分别是土壤容重和pH。总之,深耕配施生物有机肥可通过降低土壤容重和pH,增加植烟土壤养分含量,提高土壤生物活性,促进土壤微生物功能多样性形成,是碱性植烟土壤质量提升的有效措施。

