猕猴桃苗不同生长时期根际细菌群落结构分析
任春光,苏文文,饶念贤,龙云川,王加国,李苇洁
(1.贵州省山地资源研究所,贵阳 550001;2.印江土家族苗族自治县农业农村局,贵州 铜仁 555200;3.贵州省生物研究所,贵阳 550025)
【研究意义】猕猴桃果实细嫩多汁,清香鲜美,酸甜宜人,营养极为丰富,维生素C含量比柑桔、苹果等水果高几倍甚至几十倍,同时还含大量的糖、蛋白质、氨基酸等多种有机物和人体必需的多种矿物质,素有“果中珍品”的美誉[1]。猕猴桃产业在贵州经济发展中具有重要地位,目前栽培面积约3.73万hm2,是贵州省水果类栽培面积最大的水果。猕猴桃种子繁殖出苗率高,生产上主要采用种子繁殖方式培育实生苗,但实生苗质量的好坏直接影响猕猴桃后期的产量和品质。因此,研究猕猴桃苗不同生长时期与根际土壤细菌群落结构及土壤养分之间的关系,明确不同生长时期土壤优势菌群和主要营养元素的变化,对生产中通过改变土壤养分和微生物菌群结构,从而培育健壮的苗具有重要意义。【前人研究进展】培育健壮的苗木是猕猴桃产业可持续健康发展的重要保障。有研究证明,植物的不同生长时期与土壤根际微生物群落的组成密切相关,根际菌群能够促进植物根系对养分的吸收,从而提高其产量和品质[2-6]。也有研究表明,根际细菌通过能量转换与宿主互作改变根际土壤营养状态、pH、氧化状况等特性,促进植物根际土壤速效养分的转换与储存,加快植物根系对养分的吸收,从而提高产量和品质[7-8]。仝利红等[4,9-10]分别研究了草莓、黑果枸杞、马铃薯等作物中土壤细菌群落的多样性和数量,发现微生物数量和多样性与植物不同生育期和植物病害密切相关。【本研究切入点】目前关于猕猴桃苗不同生长时期土壤中主要营养成分和细菌群落结构变化研究较少。因此,采用16S rDNA的高通量测序技术,对猕猴桃苗不同生长期根际土壤中的细菌群落结构进行分析。【拟解决的关键问题】探讨猕猴桃苗不同生长期与细菌群落组成及土壤养分之间的相互关系,了解猕猴桃苗生长过程中根际环境的变化,寻求更适宜猕猴桃苗生长的土壤环境,为改良猕猴桃苗圃地中微生物种群和土壤养分结构,培育健壮苗木提供参考。
1 材料与方法
1.1 研究区概况
研究区位于贵州省水城县米箩镇俄嘎村猕猴桃产学研基地。年平均气温17.8 ℃,无霜期280~320 d,年降水量为1100~1350 mm。美味猕猴桃于2019年3月播种,在播种与苗木生长过程中未施用任何肥料。苗圃土壤类型为壤土。
1.2 土壤样本采集
采用5点“S”采样法,分别于2019年6月8日(猕猴桃主茎未木质化时期)、8月13日(猕猴桃主茎木质化刚形成时期)和10月24日(猕猴桃苗生长后期,即主茎木质化已经完全形成,植株不再生长时期)采集猕猴桃苗生长前期(mc)、速生期(mz)和生长后期(mh)的根际土壤样品。每个时期采样尽量选取株高和主根直径大小基本一致的植株进行。根际土壤取样采用“抖落法”,起苗后抖掉与根系结合松散的土壤,收集与根系粘附的土壤作为根际土壤。每期土壤取样3次重复。土壤样品装入无菌自封袋中,低温带回实验室,分别于4 ℃和-80 ℃冰箱保存备用。
1.3 土壤养分的测定
土壤样品35 ℃烘箱烘干后进行有机碳、速效钾、速效氮、速效磷含量及pH测定,土壤性质的测定参考《土壤农化分析》第3版中的方法进行。有机碳采用重铬酸钾分光光度法测定(HJ615—2011),速效钾采用醋酸铵浸提火焰原子光度计法测定,速效磷采用NaHCO3浸提—钼锑比色法测定,速效氮采用碱解扩散法测定(DB13T843—2007)。pH采用pH计测定。数据均为平均值±标准误。
1.4 细菌基因组DNA提取、扩增和测序
每个样品总DNA采用CTAB法进行提取,提取的DNA利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的DNA样品于离心管中,使用无菌水稀释样品DNA至1 ng/μL,于-80 ℃超低温保存备用,每个样品3次重复。以稀释后的DNA为模板,扩增引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rDNA基因的V3~V4高度可变区片段进行PCR扩增。PCR反应体系(25 μL):DNA模板4 μL,2×Phusion Master Mix 8 μL,Primer各1.5 μL,ddH2O210 μL。PCR反应条件:97 ℃ 1 min;97 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 4 min。PCR产物使用2%的琼脂糖凝胶电泳检测,使用Thermo Scientific公司提供的胶回收试剂盒进行回收纯化。针对16S rDNA V3~V4区进行MiSeq扩增子测序。
1.5 序列预处理及统计分析
对原始序列数据使用FLASHF软件进行质量过滤、拼接、去接头之后得到有效数据。采用QIIME软件将序列达97%以上的相似度归为1个操作分类单元OTUs,并计算多样性和丰富度指数,使用R语言软件绘制稀释曲线。
基于UPGMA法,使用STAMP软件进行样本层次聚类分析,同时进行Heatmap的构建。采用RDP classifier对OTU代表序列进行注释,同时对物种注释在各个分类水平上进行群落结构的统计分析。使用SPSS(21.0)软件进行单因素方差(One-way ANOVA)和新复极差法(Duncan)进行差异显著统计比较分析,分析供试样品的细菌群落结构差异,然后进行其多样性指数与土壤养分的相关性分析,测序与信息分析由上海美吉生物医药科技有限公司完成。
2 结果与分析
2.1 猕猴桃不同生长时期根际土壤养分含量变化
由表1可知,根际土壤pH和速效N含量均表现为mz>mc>mh,速效P含量表现为mz>mh> mc,土壤pH、速效N和速效P含量均为mz与mc、mh间存在显著差异(P<0.05),而mc与mh间无显著差异(P>0.05);速效K含量表现为mc>mh>mz,mc与mz、mh间差异显著(P<0.05),mz与mh间无显著差异(P>0.05)。随着猕猴桃苗不断生长,3个生长时期的土壤pH、速效N、速效P均出现先升高后降低趋势,速效K则出现降低趋势,有机碳则在猕猴桃苗生长期间稍有降低,但差异不大。此研究结果表明,根际土壤养分发生变化受猕猴桃生长发育影响。

表1 猕猴桃不同生长时期根际土壤的养分含量
2.2 猕猴桃不同生长时期土壤细菌数量构成及多样性
由表2可知,通过高通量测序的9个土壤样品共获得498 072条有效序列,平均长度为418.65 bp,以97%相似水平下对序列进行OTUs聚类,共得到25 822个OUT,各样品测序覆盖度在99%以上。所有样品的OTUs的稀释曲线均趋于平缓(图1),说明取样基本合理,细菌群落多样性能够准确反映出样品在不同生长时期的细菌群落信息。随着猕猴桃苗逐渐生长,各时期土壤细菌群落丰富度指数和多样性指数基本一致。mc时期与mz和mh时期存在显著差异,mz和mh之间无显著差异。

图1 猕猴桃苗不同生长时期土壤样品的稀释曲线

表2 猕猴桃苗不同生长时期根际土壤的细菌丰富度及多样性
由表3可知,猕猴桃苗各生长时期在纲、科、属分类水平下,mc>mz>mh,随着苗的生长,其菌群数量逐渐减少。由图2可知,3个不同生长时期共有的属572个,其中mc、mz和mh中所特有的属分别为25、16和14个,说明随着猕猴桃苗逐渐生长,其菌群组成数量和特有菌属均随着植株根系不断生长而逐渐递减,也表明根际土壤细菌群落组成受猕猴桃不同生长时期的影响。

图2 猕猴桃苗不同生长时期土壤细菌属的数量构成

表3 不同生长时期土壤细菌门、纲、科、属的数量构成及特有属
2.3 猕猴桃不同生长时期细菌群落分类
2.3.1 门水平分类 9个土壤样品的25 822个OTU分属于28门53纲172科266属。从图3可知,3个不同生长期细菌群落组成除未确定种属外,其余各组成种类基本相似,未确定种类归属于其它菌类。相对丰度较高的前12个菌门分别为变形菌门(Proteobacteria,35.84%)、酸杆菌门(Acidobacteria,17.69%)、放线菌门(Actinobacteria,12.6%)、绿弯菌门(Chloroflexi,11.23%)、拟杆菌门(Bacteroidetes,6.03%)、芽单胞菌门(Gemmatimonadetes,4.97%)、浮霉菌门(Planctomycetes,2.34%)、己科河菌门(Rokubacteria,1.97%)、Latescibacteria(1.42%)、蓝菌门(Cyanobacteria,1.08%)、疣微菌门(Verrucomicrobia,1.03%)、Patescibacteria(0.94%),变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)为猕猴桃苗不同生长期土壤的优势菌群。对不同生长时期相对丰度大于1%的菌门占比分析发现,随着猕猴桃苗的生长,Acidobacteria、Rokubacteria、Planctomycetes、Latescibacteria、Verrucomicrobia、Planctomycetes的相对含量先升高后降低,而Gemmatimonadetes、Actinobacteria、Chloroflexi、Proteobacteri则先降低后升高。其中Cyanobacteria、Latescibacteria和Acidobacteria菌门在不同生长时期差异显著,其它菌门则无显著差异。
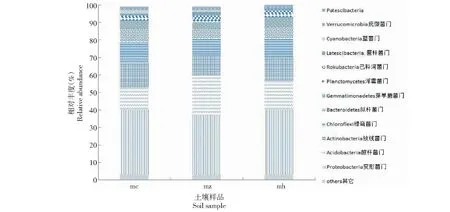
图3 猕猴桃不同生长时期苗根际土壤门水平的菌群分布
2.3.2 纲水平分类 在纲分类水平上,9个土壤样品分属于53个纲,有4.21%~6.32%的细菌类群依据目前分类学研究无法划分到任何菌纲水平。在mc时期,细菌分属于51个纲,在mz和mh阶段细菌均分属于50个纲(表3)。从图4看出,各土壤样品间的细菌群落组成相似,除了未确定种属的其他菌类,对未明确纲的分为其他。相对丰度大于1%的纲分别为Gammaproteobacteria(16.64%)、Alphaproteobacteria(13.32%)、Actinobacteria(12.62%)、Deltaproteobacteria(5.9%)、Bacteroidia(5.81%)、Gemmatimonadetes(4.99%)、Anaerolineae(3.55%)、Chloroflexia(2.34%)、Latescibacteria(1.42%)、Phycisphaerae(1.11%)、Oxyphotobacteria(1.06%)、Verrucomicrobiae(1.01%)、Dehalococcoidia(1.0%)、Acidobacteriia(1.0%)、Other(18.39%),Gammaproteobacteria、Alphaproteobacteria和Actinobacteriags是猕猴桃苗不同生长期的优势菌纲,且随着猕猴桃苗逐渐生长,这些优势菌纲均出现先升高后降低趋势,在猕猴桃苗不同生长时期大部分优势菌纲存在显著差异,少部分菌纲差异不显著。
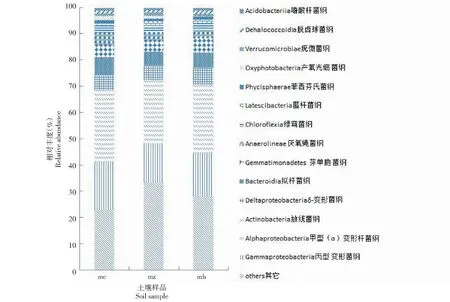
图4 猕猴桃不同生长时期苗根际土壤纲水平的菌群分布
2.4 猕猴桃不同生长时期细菌优势群落与土壤特性的关联性
从图5可知,RDA1轴和RDA2轴的解释率分别为67.05%和9.65%,累计解释率达76.7%,说明RDA1轴和RDA2轴能很好地反映细菌群落与土壤特性之间的相互关系。其中,优势酸杆菌门(Acidobacteria)与速效P、速效N、pH箭头方向相同,与有机C、速效K方向相反;放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)与速效P、速效N、pH方向相反,与有机C、速效K 方向相同,说明这些优势菌群与速效养分密切相关。进一步通过Spearman相关性系数数值评估物种与土壤特性之间的相关性。将总丰度前30个物种通过相关性热图更详细和直观展示物种与土壤养分之间的关系(图6)。速效K与衣原体门(Chlamydiae)、放线菌门(Actinobacteria)、Entotheonellaeota、Rokubacteria呈显著相关;有机碳仅与厚壁菌门(Firmicutes)呈显著相关;速效N与疣微菌门(Verrucomicrobia)呈显著相关;速效P与放线菌门(Acidobacteria)和Deinococcus-Thermus呈极显著相关,与Latescibacteria、Elusimicrobia、Actinobacteria、Bacteroidetes、Dependentiae呈显著相关;pH与Actinobacteria呈显著相关;大部分物种如Zixibacteria、Fibribacteria、Proteobacteria、Nitrospirae等与速效养分无显著相关。因此,对猕猴桃苗根际细菌群落结构比例具有影响因素的土壤指标有土壤有机碳、速效N、速效K、速效P和pH,其中速效K、速效P与优势菌群相关性最为显著(图5~6)。以上分析表明,猕猴桃苗不同生长期根际优势菌群的相对丰度受土壤特性的影响。

图5 门分类水平下细菌优势类群与土壤环境因子的RDA分析

*为相关性显著(0.01 研究发现,猕猴桃苗速生期,根际土壤pH、速效N、速效P含量达到高峰,在猕猴桃苗生长后期其含量又下降,逐渐恢复到生长初期的水平,速效K随着植株根系生长逐渐减少,土壤有机碳几乎不变。原因可能是猕猴桃苗速生期植株根系活动增强,代谢旺盛,根系分泌物增多导致。根系分泌物是土壤微生物的主要营养物质和来源,此时土壤微生物获得更多有利于优势菌群生长的营养物质,微生物活性和繁殖能力增强后,通过分泌更多氮磷胞外酶来分解土壤中有机质[11-15],所以出现猕猴桃苗速生期有效养分升高。反之,随着植株根系活性减弱,土壤中微生物活性和分解能力也随之减弱,土壤微生物的改变反调控土壤养分的改变,所以出现生长后期土壤中速效养分又开始降低。土壤养分状况随根系分泌物的组成和数量的不同而不同[16-18]。根际是植物与土壤养分、能量交换的场所,一方面植物通过呼吸和分泌有机物质影响根际土壤特性,另一方面,土壤又通过根际以各种传递方式向植物体提供各种营养,土壤酶参与土壤中许多物质能量交换、物质循环和重要的生物化学反应,也是影响土壤养分的重要因素。但由于本研究未进行根系分泌物和土壤酶活性检测,根系分泌物和土壤酶活性对土壤pH和养分变化是否存显著影响,其影响机理均有待进一步研究。 根际微生物对植株生长和品质的改善逐渐受到人们的重视。随着Illumina MiSeq高通量测序技术在农业微生物领域的迅速应用,已有大量研究证明根际微生物菌群组成具有植物特异性,不同的根际菌群与植物种类有关,在不同的植物生长阶段,根系生理、根系分泌的物质和量都不同,植物的发育阶段在决定菌群结构方面起着关键作用[19-24]。目前,根际微生物菌群多样性研究主要集中于模式植物,例如烟草、拟南芥、玉米、水稻等[20-23],而对猕猴桃等浆果类植物的研究报道较少。本研究采用高通量测序技术分析不同生长期猕猴桃苗微生物群落的多样性发现,猕猴桃苗不同生长期根际细菌群落的优势菌群为变形菌门、酸杆菌门和放线菌门。土壤速效P、速效N、速效K及pH变化受猕猴桃苗生长期的影响。 研究发现,随着猕猴桃根系不断生长,细菌丰富度和多样性指数随之发生变化,表明猕猴桃苗在不同生长时期根际土壤微生物的丰富度和多样性有显著差异。此研究结果与康捷等[23]报道的麻山药不同生长时期根际细菌群落特征结果有差异。与仝利红等[4,9,22]研究不同生长季节黑果枸杞、草莓和黄瓜的根际细菌群落多样性部分结果相似。有研究发现,作物生长处于高峰期时,根际生理代谢活动较强,根系分泌物质仅利于某些特定菌群的繁殖,出现优势菌群,一些菌群在竞争中被抑制或毒害而繁殖受阻,数量大减,从而引起土壤微生物区系变化[12]。本研究虽然没有检测猕猴桃苗的根系分泌物,但据前人的研究报道,可初步推测随着猕猴桃根系逐渐生长,不同时期分泌了某些特殊类物质,从而改变土壤微生物区系结构比例发生变化。 研究还发现,在猕猴桃苗不同生长时期变形菌门(Proteobacteria,35.84%)、酸杆菌门(Acidobacteria,17.69%)及放线菌门(Actinobacteria,12.6%)是猕猴桃苗不同生长期土壤的优势菌门,将相对丰度大于1%的菌门进行差异分析发现,菌门Acidobacteria、Latescibacteria和Cyanobacteria 存在显著差异,表明这些菌群的生长也依赖于猕猴桃根际环境,在猕猴桃根际富集,部分菌群成为优势菌门(如Actinobacteria、Acidobacteria),可能是根际分泌某类特殊物质抑制其它菌群的繁殖,而更有利于这类优势菌群繁殖和宿存。 放线菌(Actinobacteria)是植物根际土壤中一类重要的微生物,在促进植物生长与拮抗方面发挥重要作用,可以调节植物致病菌以及土壤的微生态平衡,从而达到防治病害的目的[13]。此外,有学者研究药用植物根际细菌群落特性发现,变形菌门(Proteobacteria)和放线菌门(Actinobacteria)是药用植物的主要菌群,且这类菌群能显著提高药用植物产量及品质[13-14]。杨美玲等[25]研究裕民红花根际土壤细菌群落特征发现,放线菌门(Actinobacteria,32.9%)和变形菌门(Proteobacteria,28.7%)是优势菌群,这些优势细菌的存在可能对红花道地性的形成有积极作用。本研究发现,变形菌门(Proteobacteria)和放线菌(Actinobacteria)的相对丰度分别为35.84%和12.6%,是猕猴桃根际优势群落,与前人在其他作物不同生长时期发现的优势菌群结果基本一致[4,13-14]。此外,本研究发现酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)在猕猴桃苗速生期相对丰度较高。多数研究结果表明,酸杆菌门细菌具有降解植物残体、具有光合功能,还参与单碳化合物代谢,是土壤微生物的重要成员,对土壤物质循环和平衡生态环境均起到非常重要的作用。放线菌是很多植物根际环境中重要的微生物,在促进植物健康生长方面具有重要作用。 土壤pH、含水量、有机碳、速效氮、速效钾、速效氮均等属于土壤的基本组成成分,土壤微生物群落与这些因素密切相关,根际微生物群落对植物营养和植物健康具有重要意义。有研究表明,土壤细菌种群数量和多样性的变化主要受土壤pH、电导率、温度、海拔、光照、氮、钾、铁、含盐量、脱氢酶、纤维素酶和蔗糖酶的影响[14-18],其中土壤pH、速效氮、速效磷、有机质和有机碳是土壤微生物群落分布的主要驱动因子[15-18]。早在20世纪90年代已有学者报道,在植物根系分泌物中酚酸物质能够抑制部分细菌在根际生存,进而改变根际微生物数量和多样性[26]。油菜和鹰嘴豆2种植物在缺磷条件下,能高效释放有机酸,这些有机酸对土壤微生物有显著影响,磷元素也是影响土壤群落结构的主要因子之一[27]。本研究采用RDA分析探讨猕猴桃苗不同生长期细菌群落与土壤环境因子之间的关系,结果显示土壤环境因子对微生物群落结构组成累计解释率达76.7%,大部分优势菌群(如Proteobacteria、Acidobacteria、Actinobacteria、Latescibacteria、Bacteroidetes等)与土壤的pH、速效N、速效P、速效K、有机碳关系密切,其中速效P和速效K与优势菌门相关性较显著。此研究结果与前人研究结果基本一致。 一直以来,关于根系菌群变化与土壤环境因子的关系研究成为微生物学者研究热点。大量研究发现,土壤微生物所处的外界环境条件(如土壤养分、pH、光照、水分、温度、二氧化碳)对土壤微生物群落组成产生一定的影响[12-17],土壤pH变化可导致土壤放线菌门、酸杆菌门和变形菌门的丰度改变,微生物在土壤pH接近中性时多样性偏高,土壤pH偏离中性,微生物群落会受到环境胁迫压力,群落组成和多样性会降低[15]。此外还有研究认为土壤氮是调控土壤碳源供给和微生物活性的关键因子[15,18]。本研究发现,放线菌门(Actinobacteria)与pH呈负相关,速效N与Verrucomicrobia呈正相关,速效P与Acidobacteria、Latescibacteria、Elusimicrobia呈显著正相关,而与Actinobacteria、Bacteroidetes、Dependentiae、Deinococcus-Thermus呈负相关,本研究结果与与前人部分研究结论一致[28]。目前,部分优势菌群如Elusimicrobia、Dependentiae与土壤养分的相关性报道较少。 随着猕猴桃苗不断生长,3个生长时期土壤pH、速效N、速效P均出现先升高后降低趋势,速效K则出现降低趋势,有机碳则在猕猴桃苗生长期稍有降低,但差异不大。随着猕猴桃苗逐渐生长,其菌群组成数量和特有菌属均随着植株根系不断生长而逐渐递减。通过对3个不同生长期猕猴桃苗根际土壤在门水平的菌群分布发现,有12个菌门为优势菌群,其中Cyanobacteria、Latescibacteria和Acidobacteria菌门在不同生长时期差异显著。在纲分类水平上,有Gammaproteobacteria、Alphaproteobacteria和Actinobacteriags是猕猴桃苗不同生长期的优势菌纲,且随着猕猴桃苗逐渐生长,这些优势菌纲均出现先升高后降低趋势,且存在显著差异,少部分菌纲差异不显著。此外对3个生长时期细菌优势群落与土壤特性的关联性分析发现,速效P与Acidobacteria、Deinococcus-Thermus呈极显著相关,少部分物种与速效养分和土壤pH呈显著相关,大部分物种与速效养分无显著相关性。表明,猕猴桃苗不同生长时期土壤根际群落结构比例发生了变化,土壤主要养分和pH是影响土壤细菌群落结构比例变化的重要因子,根际土细菌群落组成和根际土壤养分发生变化受猕猴桃苗不同生长时期的影响。3 讨 论
4 结 论

