槟榔间作香露兜对土壤细菌群落结构和多样性的影响
钟壹鸣,张 昂,王志勇,秦晓威,廖 丽,吉训志,鱼 欢
(1.中国热带农业科学院香料饮料研究所/海南省热带香辛饮料作物遗传改良与品质调控重点实验室/农业农村部香辛饮料作物遗传资源利用重点实验室,海南 万宁 571533;2.热带特色林木花卉遗传与种质创新教育部重点实验室/海南大学林学院,海口 570228)
【研究意义】槟榔(ArecacatechuL.)广泛分布于包括我国在内的东南亚和南亚地区[1],其中海南是我国最主要的槟榔产地[2]。槟榔种植株行距一般在2.5 m左右,适宜在槟榔林下间作可可、香草兰、咖啡、胡椒和香露兜等作物[3]。香露兜(PandanusamaryllifoliusRoxb.)又称斑兰叶、香兰叶,是一种喜湿耐荫蔽的多年生草本香料植物[4],在食品、化妆品等行业均有广泛应用[5],适宜发展成为槟榔林下间作的高价值经济作物。土壤微生物在维持土壤健康和服务农业生态方面具有重要意义[6],土壤微生物群落结构和多样性的变化是表征土壤健康程度的理想生物学指标,通过观察土壤微生物短时间内的变化能够反映土壤健康状况[7]。探究土壤微生物多样性和群落变化与种植模式间的关系可深入了解土壤的健康程度,为土壤改良及作物绿色生态种植提供科学依据和理论指导[8]。因此,研究槟榔间作香露兜模式下土壤微生物的变化特征对该模式的推广应用具有重要意义。【前人研究进展】间作模式下植株可充分利用光温水肥等环境资源并促进植物生长发育、提高作物产量并增加单位面积产值[9]。然而目前国内外对槟榔间作香露兜体系的研究尚处于起步阶段,前期研究表明,槟榔间作香露兜后土壤中速效磷含量增加,间作模式促进作物对养分的吸收,养分吸收效率和根系形态呈显著正相关[10]。槟榔间作香露兜可促进槟榔干物质积累并增加槟榔叶片SPAD值,间作后槟榔的根系指标显著增加,土壤酶活显著提高[11]。类似研究也表明,槟榔间作平托花生模式下的酸性速效磷、全磷、全钾、速效钾含量及pH显著提高[12],土壤细菌的物种丰富度和群落多样性均有所提高。王华等[13]研究发现,槟榔间作香草兰后土壤pH、有机质、微量元素、速效及全量养分含量均显著提高,并有效改良土壤微生物群落比例。吴红英等[14]研究表明,梨园间作芳香植物能显著提高各发育时期和不同深度土层中土壤微生物数量,调节真细菌及放线菌比例。同时,土壤中不同种类的微生物与土壤养分及理化性质等诸多因子间也存在显著相关。瓮巧云等[15]研究发现玉米/大豆间作后能够明显改善土壤养分含量及微生物群落结构。李艳春等[16]研究发现,间作灵芝后,茶园土壤变形菌门丰度显著提高,酸杆菌门和芽孢菌门丰度显著降低,土壤有益微生物菌群伯克氏菌属、鞘氨醇单胞菌属和戴氏菌属均显著提高。赵雅姣等[17]研究发现,紫花苜蓿—小黑麦间作后,根际土壤放线菌门相对丰度显著降低,酸杆菌门、拟杆菌门和疣微菌门相对丰度显著增加。【本研究切入点】槟榔间作香露兜后土壤细菌群落结构变化尚未可知,该间作模式下土壤细菌群落关键调控因子也有待进一步探究。【拟解决的关键问题】通过探究土壤细菌群落结构在不同种植模式下丰度和多样性变化及其与土壤理化性质指标间的互作关系,明确槟榔间作香露兜模式影响土壤细菌群落的关键调控因子,为优化槟榔间作香露兜模式及热带农田经济的发展提供理论依据。
1 材料与方法
1.1 试验地概况
试验采样地位于海南省万宁市兴隆热带植物园内(109°56′E,18°31′N,海拔36 m),海南省地处热带北缘,属热带季风气候,阳光充足,雨量丰富,年平均气温23 ℃,年均降水量在2100 mm左右,年光照为1750~2650 h,光照率为50%~60%,年无霜期大于350 d。采样地土壤理化性质:土壤pH 6.15,有机质含量22.06 g/kg,全氮1.49 g/kg,全磷1.28 g/kg,全钾6.29 g/kg,碱解氮93.80 mg/kg,速效磷8.86 mg/kg,速效钾39.25 mg/kg。
1.2 研究方法
1.2.1 试验设计 采用大田试验的方法,设槟榔单作、香露兜单作和槟榔间作香露兜3种种植模式,各种植模式下均设3块20 m×20 m的样方。样方内槟榔与香露兜种植株行距分别为2.5和0.5 m。于2019年布置试验,试验期间各样地水肥管理、病虫害防治等田间管理均保持一致。
1.2.2 土壤理化性质测定 于2020年6月对土样进行收集,以环刀法采集距离植株20~30 cm处的耕层土壤,用于土壤含水量(Soil moisture content,SM)、电导率(Electrical conductivity,EC)和容重(Bulk density,BD)测定;称量鲜重后,将土壤样品烘干后再次称重,得到土壤干重并计算质量差值,与鲜重比值即为土壤含水量,土壤容重=土壤干重/土壤体积。通过五点法进行采样,将同一样点所取土样混匀并自然风干,过筛(80目,约0.18 mm)后用于土壤养分测定;pH使用FE28型pH计测定、电导率使用DDS-307A型电导率仪测定、有机质(Soil organic matter,SOM)采用总有机碳分析仪(Multi N/C 3100)测定、全氮(Total nitrogen,TN)采用半微量凯氏法测定、全磷(Total phosphorus,TP)采用Na2CO3熔融法测定、全钾(Total potassium,TK)采用NaOH水解法进行测定[18]。
1.2.3 土壤微生物测定 于每块样地的3个处理内分别随机选取9个样点采集表层土(0~10 cm),将每个样点采集的少量土样混匀后置于超低温冰箱,用于土壤细菌丰度和多样性测定。土壤总DNA采用DNA提取试剂盒提取和纯化:利用标记有barcode的引物序列(967F/1046R)扩增土壤细菌16S rRNA序列V3~V4区片段,以2%琼脂糖凝胶电泳检测产物片段长度,根据定量检测结果,将扩增产物混合为一个样本,构建克隆文库;利用Illumina MiSeq高通量平台测序,数据经Flash软件双端序列拼接、质控、去接头(https://ccb.jhu.edu/software/FLASH/index.shtml)之后获得优化序列,基于优化序列进行OTU聚类(http://www.drive5.com/uparse/),获得OTU丰度表,用于后续细菌多样性指数及细菌群落构成分析。
1.3 统计分析
使用SPSS 24.0进行单因素方差分析,比较不同种植模式间环境因子间差异。采用Canoco 4.5进行冗余分析(RDA),在RDA中选择Manual forward selection程序以具有499个排列的蒙特卡罗测试确定环境变量参数的显著性,用于判断环境因子对细菌群落的影响程度。使用R 4.0.3进行相关分析,探索不同土壤指标与土壤细菌优势菌门间的相关性,并以Origin 2021进行绘图。
2 结果与分析
2.1 不同种植模式对土壤理化性状指标的影响
单因素方差分析结果(表1)表明,槟榔间作香露兜后,其土壤pH平均值为5.53,而槟榔单作和香露兜单作分别为6.15和5.49。相对于槟榔单作,间作香露后土壤pH降低0.62,存在显著差异(P<0.05,下同),与香露兜单作不存在显著差异(P>0.05,下同);槟榔间作香露兜后土壤电导率增加至123.27 S/m,分别较槟榔单作(76.13 S/m)和香露兜单作(94.37 S/m)显著提高61.92%和30.61%;槟榔间作香露兜后土壤容重相较槟榔单作和香露兜单作分别提高24.00%和29.17%;槟榔单作、香露兜单作和槟榔间作香露兜处理的土壤含水量分别为62.66%、65.08%和53.58%,3种种植模式间的土壤含水量不存在显著差异。槟榔间作香露兜后土壤有机质含量显著低于槟榔单作27.70%,略高于香露兜单作处理;槟榔间作香露兜后土壤全氮含量较槟榔单作显著降低18.79%;土壤全磷相较槟榔和香露兜单作分别减少29.69%和18.92%;槟榔间作香露兜后土壤全钾与槟榔单作相比降低42.77%,与香露兜单作相比降低24.53%。由此可知,槟榔间作香露兜后土壤养分含量降低,土壤逐渐趋于酸性且土壤中盐离子浓度提高,大部分养分指标均相较槟榔单作显著下降,可能与槟榔和香露兜对土壤养分的吸收作用加强有关。

表1 不同种植模式对土壤理化性状及养分含量的影响
2.2 不同种植模式对土壤细菌多样性指数的影响
3种种植模式下土壤中细菌群落组成可分为42门143纲309目470科832属1743种6121个OTUs;香露兜单作模式下可分为40门128纲266目395科647属1262种3722个OTUs;槟榔间作香露兜模式下可分为37门113纲216目317科504属924种及2263个OTUs;槟榔单作下可分为可分为39门122纲267目403科692属1401种4292个OTUs(表2)。与槟榔单作与香露兜单作相比,槟榔间作香露兜模式下细菌群落组成各分类水平(种、属、科、目、纲、门)的数量均呈明显降低趋势。
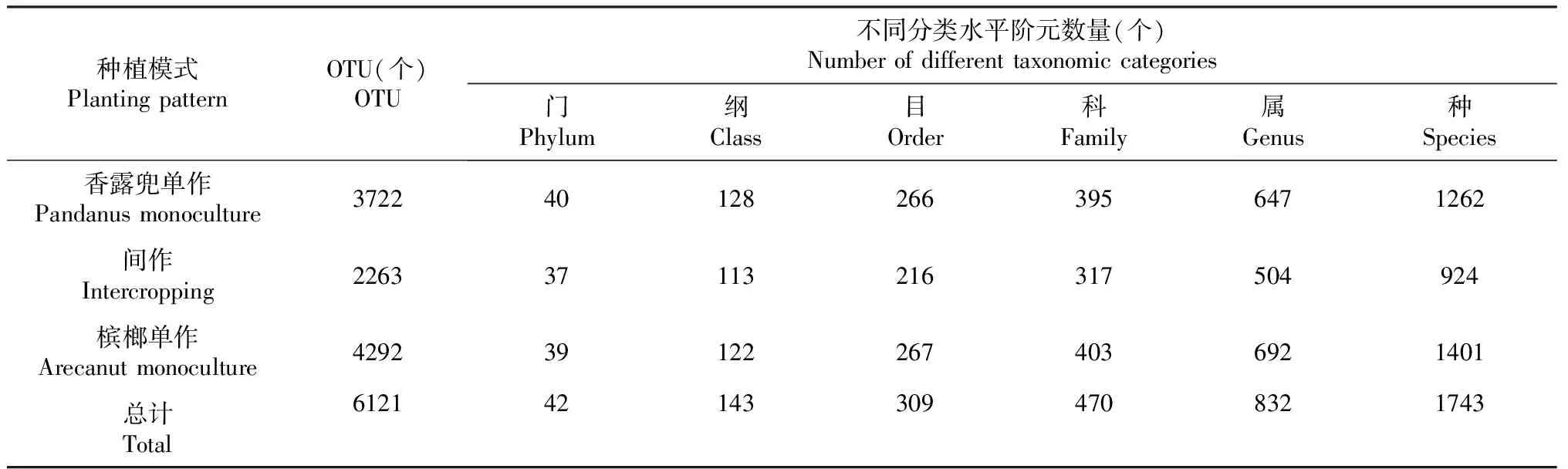
表2 不同种植模式下土壤细菌群落组成的比较
在土壤微生物群落评估中,ACE、Chao1和Shannon等多样性指数已广泛应用于表示土壤细菌群落物种总数、物种丰富度及多样性指数。通过OTU数量计算不同种植模式下细菌群落丰富度和多样性,结果发现,在3种种植模式中,槟榔间作香露兜的土壤细菌ACE指数较香露兜单作和槟榔单作2种单作模式均显著降低,分别由3326.43和3907.50降低至2009.33,降低39.60%和48.58%;槟榔间作香露兜后细菌Chao1指数较香露兜单作和槟榔单作也显著降低,由3327.42和3879.88降低至1931.52,分别降低41.95%和50.22%;槟榔间作香露兜后土壤细菌Shannon指数显著低于槟榔单作和香露兜单作,由6.08和6.28降低至5.20(表3)。上述结果表明,间作后细菌多样性指数显著低于槟榔单作及香露兜单作的细菌多样性指数。因此,间作模式不利于土壤细菌多样性的维持。
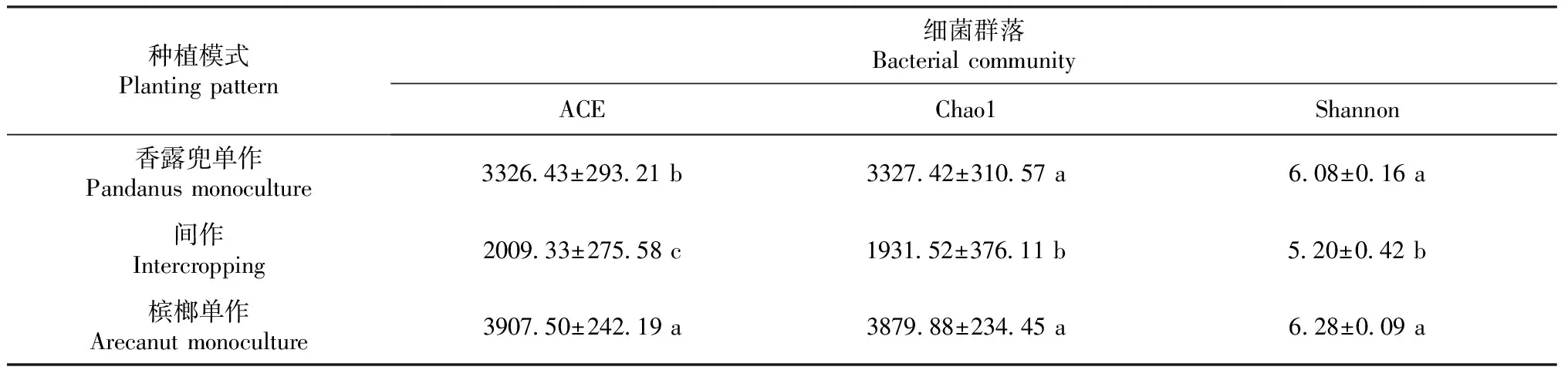
表3 不同种植模式下土壤细菌多样性指数的比较
2.3 不同种植模式对土壤细菌群落结构的影响
通过对所有土壤样品进行测序发现,细菌群落OTU数共有427 541个序列。每个样本的细菌序列数量为43 986~54 175(平均值为47 505)。细菌群落门类水平相对丰度大于1%的菌门有12个,分别为变形菌门(Proteobacteria)、放线菌门(Acidobacteriota)、绿弯菌门(Chloroflexi)、酸杆菌门(Actinobacteriota)、厚壁菌门(Firmicutes)、粘球菌门(Myxococcota)、Methylomirabilota、芽单胞菌门(Gemmatimonadota)、未知细菌、脱硫杆菌门(Desulfobacterota)、疣微菌门(Verrucomicrobiota)、浮霉菌门(Planctomycetota),对应的相对丰度分别为20.23%、20.09%、19.67%、15.61%、6.39%、3.27%、2.91%、1.96%、1.69%、1.30%、1.22%、1.15%,其他门类为4.51%(图1)。其中,变形菌门、放线菌门、绿弯菌门、酸杆菌门是所有细菌群落中的优势菌门,在3种种植模式下以上四类菌门的相对丰度之和大于66.10%,单一菌门丰度分别为20.23%、15.61%、19.67%和20.23%,均大于15.00%。槟榔间作香露兜后,变形菌门的细菌序列数量由香露兜单作时的11 527.33显著降低为7219.00;绿弯菌门的细菌序列数量由槟榔单作时的3893.67显著提高至19 088.33;而放线菌门及酸杆菌门的细菌序列数量均有所下降(表4)。槟榔单作与香露兜单作的细菌群落结构相似,而槟榔间作香露兜后变形菌门、放线菌门、酸杆菌门丰度均出现降低,绿弯菌门丰度则提高。槟榔间作香露兜后土壤养分含量的降低和微环境的变化,可能是导致富营养型细菌(如变形菌门)丰度减少,寡营养型细菌(如绿弯菌门)增加的主要原因。放线菌门的主要功能促使土壤中的动物和植物遗骸腐烂,并且产生农用抗菌素和维生素等,而酸杆菌门同样有降解土壤有机质的作用。因此,槟榔间作香露兜后放线菌门和酸杆菌门数量的减少可能与间作增加作物根系生物量、降低根系周转率有关。上述结果表明,在间作香露兜后土壤细菌群落结构变化对改善槟榔园土壤细菌群落结构具有积极意义。
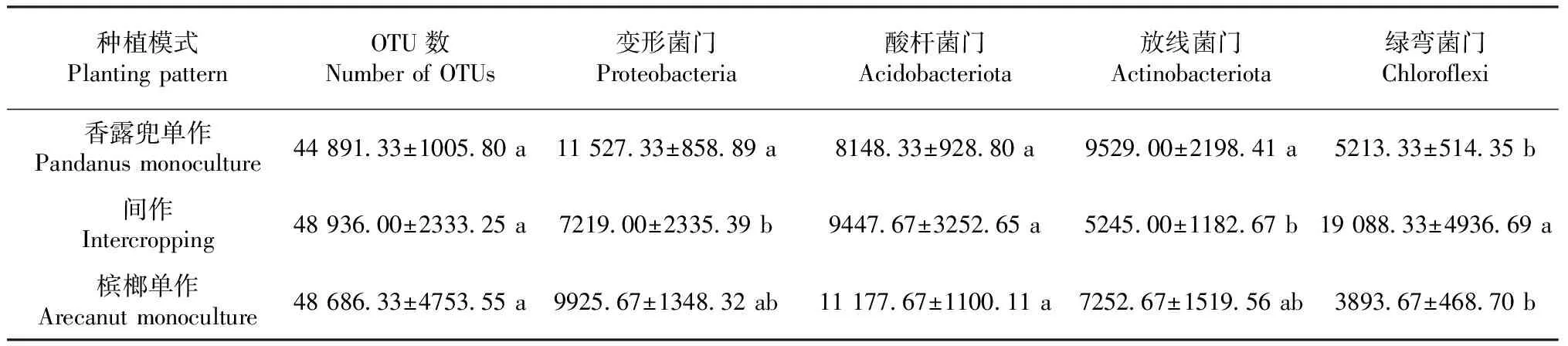
表4 不同种植模式下优势菌门的细菌序列数量
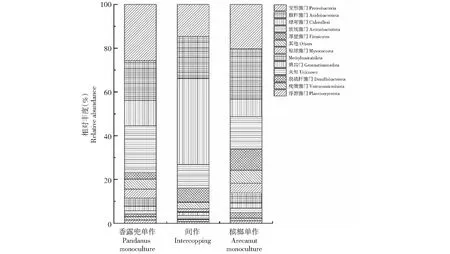
图1 不同种植模式下土壤细菌群落在门分类水平下的组成及相对丰度
2.4 环境因子对土壤细菌群落多样性及结构的影响
采用冗余分析(RDA)进一步分析各土壤环境因子与细菌多样性指数间的关系。图2-a为细菌多样性指数与土壤理化性质间的关系,蒙特卡罗置换检验结果(表5)表明,土壤电导率(F=28.50,P=0.002)和pH(F=3.60,P= 0.014)是细菌群落多样性指数变异的主要贡献者。电导率、pH、有机质、容重、全磷、全氮、全钾及土壤含水量共同解释了样本间细菌群落变异的75.58%。RDA分析的前2个排序轴分别解释了总方差的55.10%和20.48%。环境因子对细菌多样性指数的影响排序为电导率>pH>有机质>容重>全磷>全氮>全钾>土壤含水量。分析发现ACE指数、Chao1指数和Shannon指数与pH呈显著正相关,与土壤电导率呈显著负相关。图2-b为细菌菌门与土壤理化性质间的关系,土壤全磷(F=49.10,P=0.002)和土壤容重(F=7.50,P=0.034)是细菌菌门产生变异的主要贡献者。所有的环境变量共同解释了样本间细菌群落变异的91.43%,RDA分析的前2个排序轴分别解释总方差的83.04%和8.39%,很好地解释了环境因子对细菌主要菌门的影响。环境因子对细菌优势菌门的影响顺序为全磷>容重>电导率>全钾>全氮>有机质>pH>土壤含水量。
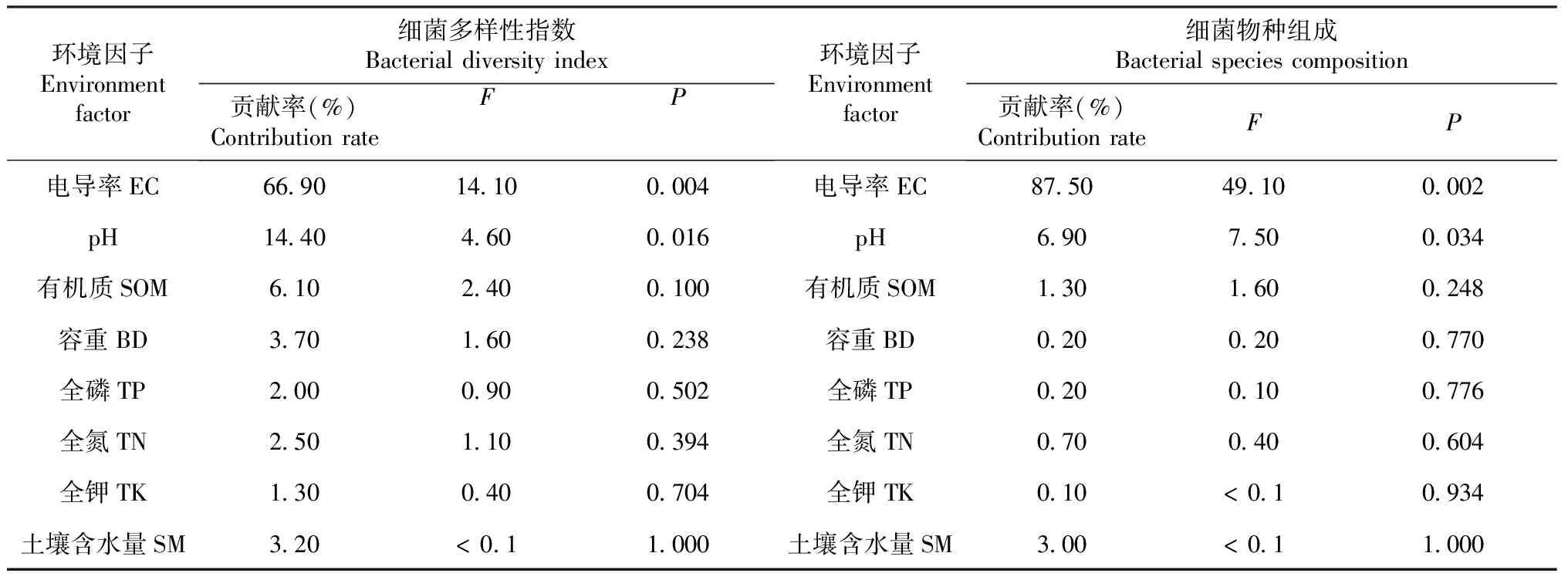
表5 环境因子对土壤细菌的贡献及其显著性分析
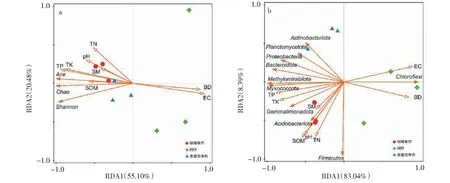
图2 土壤细菌多样性指数(a)、细菌群落(b)与土壤理化特性的冗余分析
相关分析结果(表6)表明,土壤理化性质显著影响细菌群落组成。在优势细菌门中,变形菌门相对丰度与有机质呈显著负相关;放线菌门相对丰度与土壤容重呈显著正相关;绿弯菌门相对丰度与电导率和有机质呈极显著正相关(P<0.01,下同),与全磷呈极显著负相关,与全钾呈显著负相关;厚壁菌门相对丰度与pH和容重呈显著正相关,与全氮呈极显著正相关;粘球菌门和脱硫菌门(Desulfobacterota)相对丰度与电导率呈极显著负相关;粘球菌门相对丰度与有机质呈显著负相关,与全磷呈显著正相关,与全钾呈极显著正相关;脱硫菌门相对丰度与pH和容重呈显著正相关,与全磷和全钾呈极显著正相关。在槟榔间作香露兜体系中主导土壤细菌优势菌门变化的主要因子分别为有机质、土壤容重和土壤磷含量。结合环境因子对土壤细菌群落多样性的影响因子,本研究明确土壤容重和总磷是调控细菌区系结构和优势菌群的主要环境因子,但土壤有机质含量的变化对土壤细菌区系的调控作用同样不容忽视。
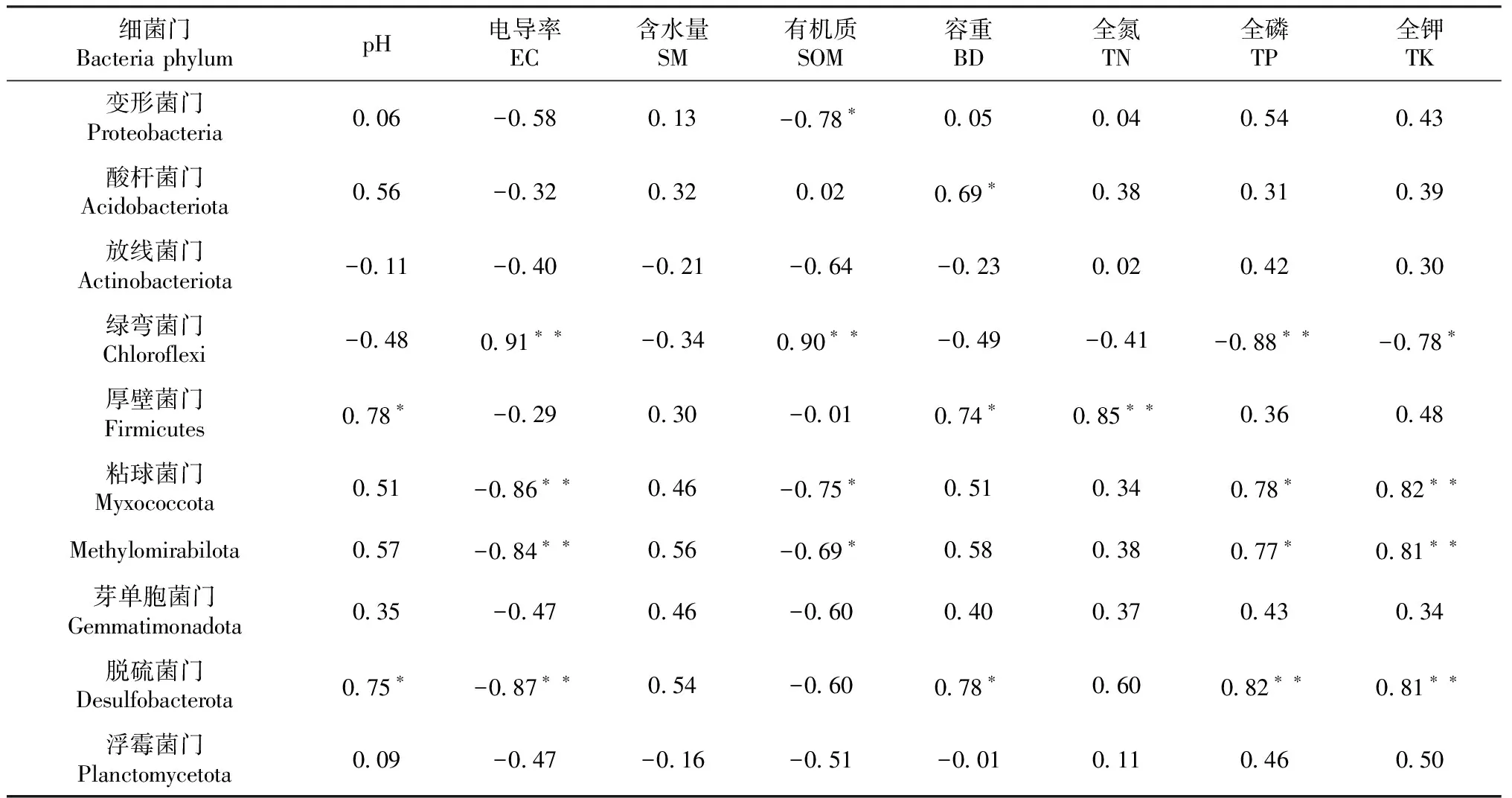
表6 门分类水平下土壤细菌的群落组成与土壤理化性质的相关系数
3 讨 论
3.1 槟榔间作香露兜对土壤理化性质的影响
pH是反映土壤性质的重要指标,也是影响作物生长和土壤健康程度的重要因素[19]。本研究中,槟榔间作香露兜模式较槟榔单作土壤pH显著降低,可能与间作后土壤中的根生物量增加,根系分解后产生的有机物输入增加导致分解过程中有机酸含量提高有关,与前人对毛竹/景田及甘蔗/花生间作体系中的研究结果[20-21]一致。已有研究表明,间作后根系数量及根系残体分解量增加会导致土壤有机质含量增加,但本研究中土壤中有机质含量降低可能是由于间作后2种作物对土壤养分吸收增加,但未及时对土壤肥力进行补充所致[22]。李波等[23]研究表明,间作后作物根系对不同土层产生影响,使间作后土壤容重高于单作。容重改变的原因可能与有机质分解导致团聚体结构破坏为小分子结构有关[24]。土壤电导率是反映土壤中电解质浓度的指标,同时表征土壤盐离子浓度的指标,在适宜的范围内,土壤电导率越高表明土壤中可供植物利用的速效养分越多[25]。间作后土壤中的水分含量不变而电导率增加,可能是土壤的储水能力减弱,致使盐离子的聚集作用增加[26],本研究中槟榔间作香露兜后土壤电导率上升也证实这一观点。土壤中全氮、全磷、全钾含量下降可能是由于间作提高了单位面积内作物对土壤养分的吸收量,2种作物在生长过程中需要不断从土壤中汲取相对于单作时更多养分,降低土壤中的养分储备[27]。
3.2 槟榔间作香露兜对土壤细菌多样性指数的影响
土壤细菌群落在土壤结构形成、有机物分解、养分转化和循环等方面发挥重要作用,与土壤性质关系紧密,常被视为用于评价土壤健康的生物学特性指标[28-29]。土壤微生物对外界环境变化极为敏感,其数量和种类受土壤环境和土壤耕作措施的影响,如pH、含水量、环境温度和土壤养分等因素均能造成变化[30]。细菌多样性指数是表征群落多样性的常用指数,能揭示土壤细菌种类和功能的差异[31]。竹荪间作橡胶[32]以及甘蔗间作玉米[33]后发现土壤微生物Shannon指数均显著增加,可能是间作模式下土壤微生物对碳源的利用率提高。其中,引起细菌群落多样性指数显著降低最主要的环境因子是土壤pH。在酸性土壤中,土壤微生物的生长活性随着pH降低而下降[34],根系分泌物的种类及含量尤其是有机酸类等物质改变导致的pH降低影响了土壤细菌的生长环境[35]。本研究中,ACE、Chao1和Shannon指数在槟榔间作香露兜后出现了不同程度的降低,说明间作改变了土壤中细菌的多样性和丰富度,究其原因可能是间作后作物的根系数量、结构及物种变化引起根系分泌物种类及含量改变,致使间作体系对养分利用方式改变,从而导致土壤细菌多样性的变化。
3.3 槟榔间作香露兜对土壤细菌群落结构的影响
槟榔间作香露兜后,土壤全磷和土壤容重的变化显著影响土壤细菌群落组成而使其产生差异,是细菌群落结构发生改变的主要原因。而相对丰度大于15.00%的四类土壤细菌优势菌门对环境因子的变化产生了不同程度的响应,其中变形菌门、放线菌门和酸杆菌门在间作后其相对丰度均出现显著降低,而绿弯菌门在间作后相对丰度显著升高。变形菌门在本研究采用的3种种植模式下均为相对丰度最高的菌门,与前人对土壤微生物丰度方面的研究[36]类似。全氮与变形菌门呈正相关,可能是大多数来自变形门的菌群具有固氮作用,间作后土壤中全氮含量下降导致变形菌门相对丰度下降[37]。此外,放线菌门在有机质降解过程中,会产生相关酶以加速有机质的有效降解与本研究中间作后有机质含量降低的结论保持一致[38]。酸杆菌门是一种寡营养细菌,参与有机物分解及微生态环境的平衡体系,可降解木质素和纤维素,提高土壤养分含量[39]。一般来说,酸杆菌门适合在pH较低的环境下生长,但本研究中土壤pH降低后,酸杆菌门相对丰度降低可能与土壤中的全量养分含量下降,导致酸杆菌门丰度下降的效应掩盖了土壤pH变化对酸杆菌门相对丰度的影响[36]。绿弯菌门在好氧环境下生存繁殖,有利于土壤中有毒有害物质的降解[40],在间作后相对丰度显著提高,说明间作后土壤中的有毒有害物质积累减弱,对土壤健康有益[41]。
4 结 论
槟榔林下间作香露兜不影响细菌OTU总数,但通过降低pH及提高电导率而显著降低土壤细菌群落多样性指数;间作模式通过提高土壤容重降低全磷、全钾及有机质含量,而降低变形菌门、放线菌门和酸杆菌门的丰度,却提高了绿弯菌门的丰度。可见,尽管槟榔间作香露兜体系显著降低土壤养分含量,但能改善槟榔林原位土壤细菌区系的丰度及多样性,对维持槟榔林土壤健康及促进槟榔与香露兜相关产业发展具有积极意义。

