内镜下黏膜剥离术治疗直径≥20 mm结直肠侧向发育肿瘤并发出血及穿孔的危险因素分析
郑林福 李达周 陈俊果 王蓉 陈龙平 王雯
结直肠侧向发育肿瘤(LST)是指直径≥10 mm、沿着肠管侧向扩展而非垂直生长的一类扁平隆起性病变,与大肠癌的发生密切相关[1]。随着内镜诊治技术的发展,大部分结直肠LST可以在内镜下切除,内镜切除方式包括内镜黏膜切除术(EMR)和内镜黏膜下剥离术(ESD)。EMR适用于病灶直径<20 mm结直肠LST,对于直径≥20 mm的结直肠LST,ESD可实现病灶完整切除,且复发率低,但ESD术后出血和穿孔等并发症的发生率较高[2-3]。目前关于ESD治疗直径≥20 mm结直肠LST并发出血、穿孔的相关危险因素研究较少,因此本研究对我院近4年病变直径≥20 mm的结直肠LST行ESD治疗后发生出血、穿孔并发症的患者进行分析,探讨ESD治疗病变直径≥20 mm的结直肠LST患者并发出血、穿孔的危险因素,为LST的临床诊治提供一定的参考。
对象与方法
1.对象:纳入2016年1月~2019年12月在解放军联勤保障部队第九〇〇医院内镜中心行ESD治疗且病灶直径≥20 mm的结直肠LST患者172例,其中男84例,女88例,年龄27~87岁,平均年龄(59.59±11.05)岁。纳入标准:(1)术前均完善血、尿便常规及凝血功能等检查;(2)使用抗凝药物患者停药1周后再行内镜手术。排除行EMR治疗及术后病变直径<20 mm的结直肠LST患者。本研究已经过解放军联勤保障部队第九〇〇医院伦理委员会审核批准,所有患者及家属均签署内镜治疗知情同意书。
2.方法
(1)一般资料收集:包括性别、年龄、是否合并基础疾病(高血压病、冠心病、糖尿病)。
(2)ESD治疗方法:使用Dual刀行病灶周边标记,粘膜下注射抬举后,再用其将病灶周边切开,最后进行剥离。内镜治疗操作均由具有5年以上丰富内镜治疗经验医生进行。记录结直肠LST病变直径、病变位置(右半结肠、左半结肠、直肠)、LST形态、手术时间、病灶纤维化情况(病灶粘连、黏膜下注射抬举欠佳或困难[4])及术后病理组织分型。LST形态按照日本工藤教授提出的LST分型方法,分为颗粒型和非颗粒型,颗粒型根据表面形态再次分成颗粒均一型(LST-G-H)和结节混合型(LST-G-NM),非颗粒型分为平坦隆起型(LST-NG-FE)和假凹陷型(LST-NG-PD)[5]。根据世界卫生组织结直肠癌组织学分类系统,将结直肠癌病理组织分为腺瘤、低级别上皮内瘤变(LGN)、高级别上皮内瘤变(HGN)、黏膜内癌、黏膜下浅层癌(SM1)、黏膜下深层癌(SM2)。记录ESD治疗过程中出血及穿孔情况。出血定义为术后出现便血,需要输血或内镜止血治疗。穿孔定义为ESD过程中发现肠系膜脂肪或腹内间隙,或手术后腹部平片或CT检查结果显示腹腔内有游离气体[6]。根据术后是否并发出血或穿孔,将172例患者分别分为出血组(9例)和非出血组(163例)、穿孔组(14例)和非穿孔组(158例)。
结 果
1.患者临床资料情况:172例患者中,合并基础疾病57例,未合并基础疾病115例;病变位于右半结肠58例,左半结肠35例,直肠79例;LST-G-H 24例,LST-G-NM 108例,LST-NG-FE 30例,LST-NG-PD 10例;ESD操作时间<120 min 145例,≥120 min 27例;ESD中发现病灶有纤维化17例,无纤维化155例;术后病理组织分型结果:腺瘤19例,LGN 68例,HGN 40例,黏膜内癌25例,SM1 9例,SM2 11例。
2.出血组和非出血组患者临床资料比较:172例患者中,术后发生出血者9例(出血组),占5.23%,未出血者163例(非出血组)。8例出血患者的出血量约20~100 ml,1例出血量为200 ml,均行内镜下止血成功。出血组中病变直径≥40 mm、病变位置位于左半结肠和直肠、手术时间≥120 min的患者比例明显高于非出血组(P<0.05),两组患者其余临床资料比较差异均无统计学意义(P>0.05)。见表1。
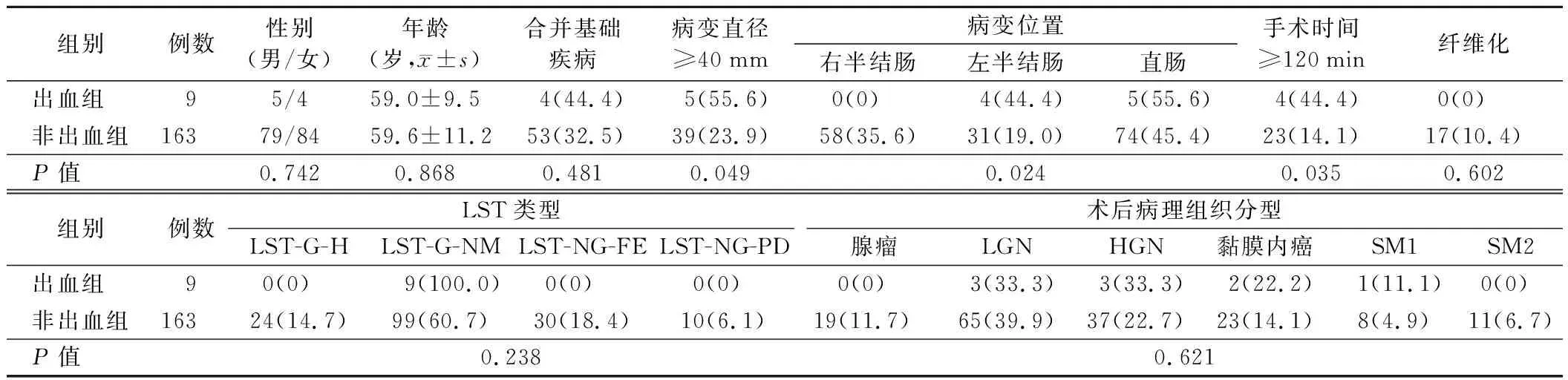
表1 出血组和非出血组患者临床资料比较[例,(%)]
3.穿孔组和非穿孔组患者临床资料比较:172例患者中,术后发生穿孔患者14例(穿孔组),占8.14%,均为术中穿孔,行止血夹夹闭创面、术后予抗感染治疗后好转,未穿孔患者158例(非穿孔组)。穿孔组有病灶纤维化患者的比例明显高于非穿孔组(P<0.05),两组其余临床资料比较差异均无统计学意义(P>0.05)。见表2。
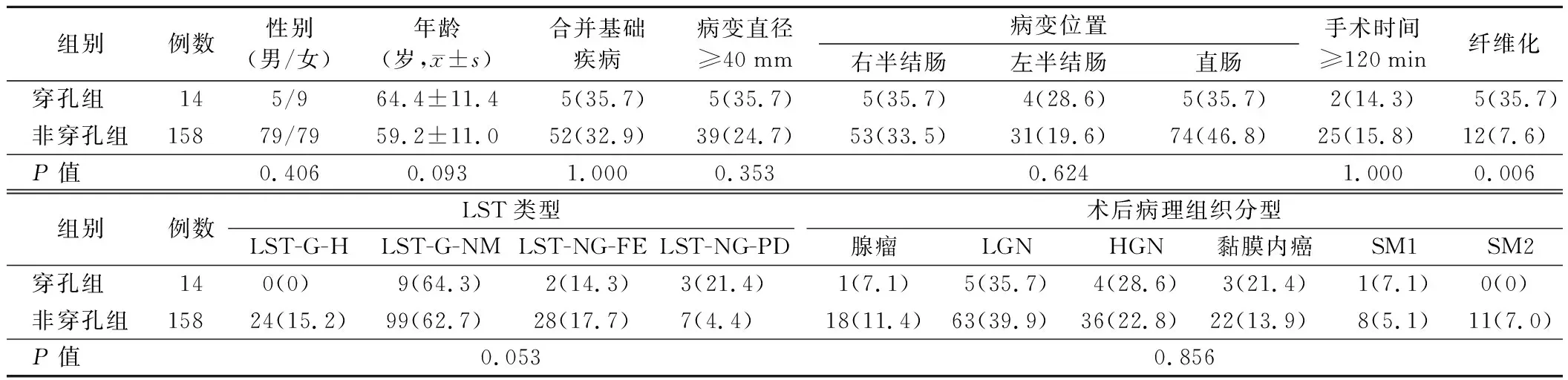
表2 穿孔组和非穿孔组患者临床资料比较[例,(%)]
4.ESD治疗直径≥20 mm结直肠LST患者发生出血和穿孔的影响因素分析:Logistic回归分析结果显示,手术时间≥120 min是ESD治疗LST患者并发出血的独立危险因素(OR=0.205,95%CI0.051~0.822,P=0.025),年龄(OR=0.945,95%CI0.897~0.996,P=0.035)及病灶纤维化(OR=0.105,95%CI0.027~0.405,P=0.001)是ESD治疗直径≥20 mm结直肠LST患者发生穿孔的独立危险因素。
讨 论
大多数直径<20 mm的结直肠LST采用EMR治疗,但是EMR受限于病灶组织的大小。有学者对ESD和EMR治疗直径>20 mm的结直肠病变进行比较发现,ESD的整体切除率更高(89.9%比34.9%),局部复发率低(0.7%比12.7%)[7],因此推荐对于直径≥20 mm的结直肠LST采用ESD治疗。但ESD对术者的操作水平要求高,术中、术后并发症多,有文献报道ESD术后出血的发生率为0~15.6%[8-9],穿孔的发生率为1.4%~20.4%[10]。本研究结果显示,对于直径≥20 mm的结直肠LST患者,其并发出血及穿孔的发生率分别为5.23%和8.14%,与廖斐等[11]研究结论基本相一致。
内镜切除肠道病变发生术后出血的危险因素包括病变大小、病变形态、位置、是否合并高血压病、冠心病等基础疾病及凝血状态等[8,12-14],但不同研究结论得出的危险因素不一致,且目前关于结直肠LST直径≥20 mm行ESD治疗发生出血的影响因素报道较少。本研究结果显示,ESD术后出血与患者的年龄、合并基础疾病无关,可能与我们在ESD治疗前让患者停用抗凝药物1周有关;而ESD术后出血可能的相关因素包括LST位置位于左半结肠和直肠、病变直径≥40 mm及手术操作时间≥120 min,其原因可能是本研究纳入的9例出血患者LST类型均为LST-G-NM,而LST-G-NM以直肠和左半结肠多发[15];此外,病变直径越大,相应的手术时间延长,出血的风险也随之增加。本研究多因素分析结果显示,手术时间≥120 min是ESD治疗LST并发出血的独立危险因素,即手术时间越长,出血的风险增高,与Ueki等[16]的报道相一致。
因结直肠壁薄、结构曲折冗长等特殊解剖结构,结直肠ESD的穿孔率更高,且肠道穿孔引起的腹膜炎可能比胃穿孔更严重[17]。本研究中,发生穿孔患者14例(8.14%),均成功行内镜下闭合治疗。单因素及多因素回归分析结果均显示,病变纤维化是ESD治疗结直肠LST并发穿孔的危险因素,与既往学者报道纤维化是结直肠ESD并发穿孔的重要危险因素观点吻合[18-19]。其原因为病变纤维化粘连时,黏膜下注射抬举不佳,造成剥离困难,再加上肠壁薄等特点,穿孔的风险也增加。同时本研究还发现,高龄为直径≥20 mm结直肠LST患者发生穿孔的独立危险因素,提示高龄患者在ESD治疗过程中出现穿孔的可能性更大,术前需要进行充分评估。
综上所述,手术时间≥120 min为ESD治疗直径≥20 mm结直肠LST并发出血的独立危险因素,高龄及病灶纤维化则是其并发穿孔的独立危险因素,对于这类危险因素的了解和掌握,有助于进行更充分的ESD术前评估。

