微小RNA-144对胆管细胞癌细胞增殖和侵袭能力的影响
赵倩 华黎 杨锐
胆管细胞癌(CCA)起源于胆管上皮细胞,是一种高度恶性肿瘤,占肝脏原发恶性肿瘤的10%~15%,且CCA发病率逐年上升[1]。我国CCA发病率较高,占全世界发病率一半以上[2]。CCA发病隐匿,进展迅速,手术切除率低且术后复发率高,5年生存率仅5.0%~15.0%[3]。尽管近年来CCA的治疗取得了进展,但目前尚无有效的靶向治疗药物,预后仍然较差。因此,探讨CCA的发病机制,寻找潜在的药物治疗靶点,改善CCA患者预后尤为重要。微小RNA(miRNA,miR)是一类长度约为19~25 nt的内源性非编码RNA,其主要通过与靶mRNA的3’-非翻译区(UTR)结合而抑制靶基因的转录后翻译或促进靶基因降解,参与细胞生长、增殖、分化和凋亡等重要生物学过程,其中部分miRNA参与多种恶性肿瘤的发生、发展、侵袭及转移等过程[4]。目前研究表明miR-144参与了多种肿瘤的发生和发展。Yin等[5]报道miR-144在乳腺癌中表达降低,其可通过调节靶基因CEP55的表达抑制乳腺癌细胞的增殖、侵袭及转移[5]。王开琼等[6]的研究结果表明,miR-144在胰腺癌细胞SW1990中呈低表达,高表达miR-144可通过PI3K通路抑制胰腺癌细胞增殖、迁移及侵袭。目前miR-144在CCA中的研究较少。本研究主要探讨miR-144对CCA细胞系HCCC-9810细胞和CCLP1细胞的增殖、迁移及侵袭的影响,并分析其对PI3K信号通路的影响,旨在为揭示CCA的发病机制提供理论依据。
材料与方法
1.材料:CCK8试剂盒(Dojindo)、Matrigel(BD公司)、胶回收试剂盒(Takara)、LipofectamineTM2000转染试剂(Invitroge)、慢病毒介导(pCDH)-CMV-EF1-copGFP(SBI公司)、BCA蛋白定量检测试剂盒(上海生工)、Fast Start Universal SYBR Green Master(Rox)(Roche公司)、EcoRI和BamHI限制性内切酶(Thermo Scientific公司)、胎牛血清(FBS)(Invitrogen)、DMEM高糖培养液(Hyclone公司)。CCA细胞系HCCC-9810和CCLP1细胞及人胚胎肾细胞(HEK293T)购自中国细胞典藏委员会细胞库。
2.方法
(1)细胞的培养和质粒的构建:HEK293T细胞以含10%的FBS、100 U/ml青霉素和100 μg/ml链霉素的DMEM高糖培养液,在37 ℃、5% CO2条件下培养。从HEK293T细胞基因组中采用聚合酶链反应(PCR)扩增编码miR-144前体(pre-miR-144)的基因序列,克隆入pCDH-CMV-EF1-copGFP载体的BamHⅠ/EcoRⅠ位点。pre-miR-144的PCR反应引物为5’﹣3’,上游引物为AAAGAATTCGAGCAGAGAGCTTCTTGGGC,下游引物为AAAGGATCCTCCAGCCCTGACCTGTCCT,PCR反应条件:98 ℃ 30 s;98 ℃ 10 s;55 ℃ 60 s;72 ℃ 1 min,共32个循环,循环结束后72 ℃延伸5 min。经双酶切后,行电泳、胶回收,将目的片段pre-miR-144和pCDH-CMV-EF1-copGFP片段进行连接,质粒转化,并对质粒进行筛选和鉴定。
(2)慢病毒的包装、CCA稳转株的建立及验证:利用LipofectamineTM2000转染试剂将主质粒(pCDH-CMV-EF1-copGFP或PCDH-miR-144)与辅助质粒(Rec、TAT、Gag、Vsvg)共转染HEK293T细胞。收集浓缩包装好的病毒和空病毒载体,分装后于-80 ℃保存备用。培养CCA细胞系HCCC-9810细胞和CCLP1细胞,细胞融合度达到50%时,分别加入适量病毒(miR-144 HCCC-9810组和miR-144 CCLP1组)及空病毒载体(Vector HCCC-9810组和Vector CCLP1组),感染后的细胞扩增72 h后观察绿色荧光蛋白(GFP)的表达,通过流式细胞仪检测病毒对细胞的感染率。感染的细胞扩增后,通过流式分选仪分选稳转株。采用茎环引物法检测稳转株细胞中miRNA的表达水平。
(3)CCK-8法检测细胞的增殖情况:收集对数生长期的HCCC-9810细胞和CCLP1细胞,分别用培养液稀释后调整其浓度,96孔板每孔加入同等数量的细胞,培养至相应时间点,每孔加CCK8 10 μl,于细胞培养箱内继续培养0.5~4.0 h,450 nm波长处测量吸光度OD值,以测得的miR-144组OD值减Vector组OD值即为该细胞的相对数。
(4)划痕实验:6孔板每孔接种约5×105个细胞,每组设3个复孔,细胞培养过夜后,以枪头垂直于标记线划痕,磷酸盐缓冲液(PBS)洗脱脱落的细胞,加入无血清培养液,显微镜下拍照测量,然后放置于培养箱中继续培养,连续观察细胞的迁移情况,选择不同的时间点(0 h、36 h)拍照,采用Image J软件计算划痕愈合的面积表示细胞迁移面积。
(5)Transwell侵袭实验:基质胶和无血清培养液按1∶5稀释,每孔加入50 μl稀释后的基质胶,均匀铺满内室底部,培养箱中放置1~2 h,每孔加入等量细胞悬液,下室加入500 μl含10% FBS的完全培养液,培养箱中培养24~48 h,达到培养时间后,用棉签擦去上室基质胶和细胞,室温下4%多聚甲醛固定15 min,清洗后加入0.1%结晶紫染色20 min,PBS漂洗3次,倒置显微镜下观察,随机选取多个视野进行统计并拍照。
(6)蛋白质免疫印迹法(Western Blot)检测:提取细胞总蛋白,使用BCA试剂盒进行蛋白定量,SDS-PAGE法电泳与转膜,孵育相应的一抗、二抗,洗膜后使用辣根过氧化物酶HRP-ECL发光法曝光进行分析与扫描,检测MMP-2、p-AKT、AKT蛋白表达水平。
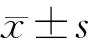
结 果
1.慢病毒稳转株的构建情况:慢病毒载体构建成功后感染HCCC-9810和CCLP1细胞,在光学显微镜下观察显示转染成功(图1、2),转染率>90%。miR-144 HCCC-9810组和miR-144 CCLP1组miR-144的表达水平分别高于Vector HCCC-9810组和Vector CCLP1组(0.162±0.006比2.754±0.103,0.367±0.025比5.322±0.193,P均<0.01)。
图1 慢病毒感染的HCCC-9810细胞(A:感染空病毒载体的光镜图;B:感染慢病毒miR-144载体的光镜图;C:感染空病毒载体的荧光图;D:感染慢病毒miR-144载体的荧光图;×200)

图2 慢病毒感染的CCLP1细胞(A:感染空病毒载体的光镜图;B:感染慢病毒miR-144载体的光镜图;C:感染空病毒载体的荧光图;D:感染慢病毒miR-144载体的荧光图;×200)
2.miR-144对CCA细胞增殖影响:miR-144 HCCC-9810组培养48 h及72 h后细胞相对数均低于同期Vector HCCC-9810组(0.537±0.081比0.750±0.100, 0.857±0.140比1.333±0.153,P均<0.05)。见图3A。miR-144 CCLP1组培养48 h及72 h后细胞相对数均低于同期Vector CCLP1组(0.63±0.118比0.85±0.062,1.23±0.167比1.85±0.229,P均<0.05)。见图3B。
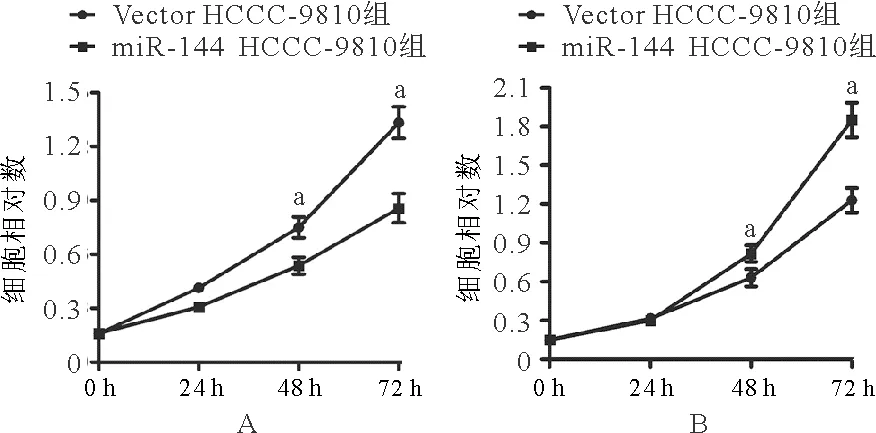
图3 miR-144对CCA细胞增殖的影响(A:HCCC-9810细胞;B:CCLP1细胞;aP<0.05)
3.miR-144对CCA细胞迁移能力的影响:36 h后可观察到Vector HCCC-9810组、miR-144 HCCC-9810组及Vector CCLP1组、miR-144 CCLP1组分别较同组0 h时划痕愈合面积减少,说明实验成功。36 h后miR-144 HCCC-9810组和miR-144 CCLP1组细胞的迁移面积分别较Vector HCCC-9810组和Vector CCLP1组减少(67.76±9.36比27.14±8.17,91.27±9.63比44.72±6.38,P均<0.01)。见图4、5。

图4 HCCC细胞划痕实验光镜结果(A、C:Vector HCCC-9810组;B、D:miR-144 HCCC-9810组;A、B:培养0 h;C、D:培养36 h;×200)
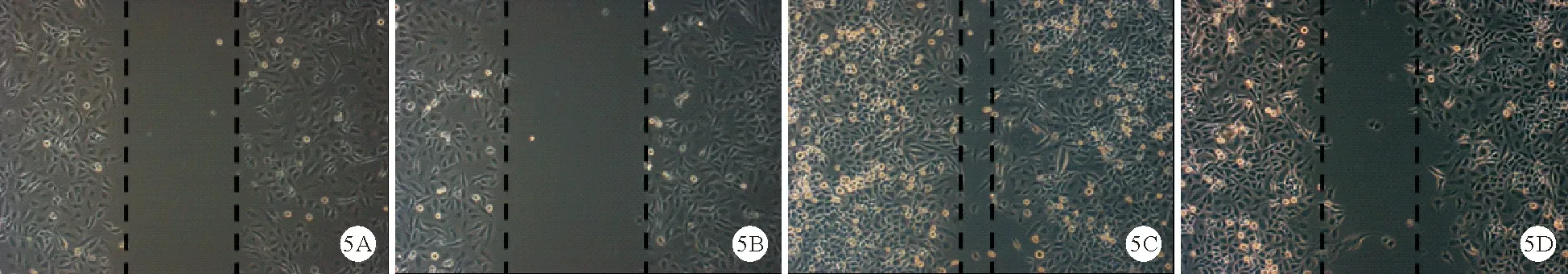
图5 CCLP1细胞划痕实验光镜结果(A、C:Vector CCLP1组;B、D:miR-144 CCLP1组;A、B:培养0 h;C、D:培养36 h;×200)
4.miR-144对CCA细胞侵袭能力的影响:36 h后对4组细胞光镜下拍照,结果显示miR-144 HCCC-9810组和miR-144 CCLP1组细胞比例明显低于Vector HCCC-9810组和Vector CCLP1组[(136±6)%比(73±3)%,(172±7)%比(81±4)%,P均<0.05]。见图6。
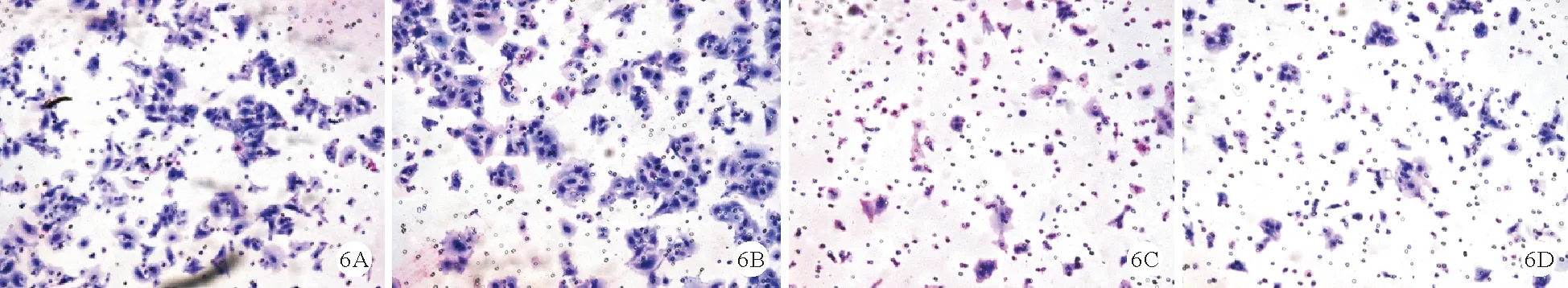
图6 4组细胞侵袭实验光镜结果(A:Vector HCCC-9810组;B:Vector CCLP1组;C:miR-144 HCCC-9810组;D:miR-144 CCLP1组;结晶紫染色,×200)
5.miR-144对CCA细胞增殖和转移相关指标的影响:Western Blot检测结果显示,miR-144 HCCC-9810组和miR-144 CCLP1组细胞中MMP-2表达水平均明显低于Vector HCCC-9810组和Vector CCLP1组(1.87±0.16比0.93±0.09,1.68±0.14比0.81±0.06,P均<0.05),p-AKT表达水平均明显低于Vector HCCC-9810组和Vector CCLP1组(1.98±0.19比0.98±0.08,1.03±0.10比0.23±0.03,P均<0.05),AKT表达水平与Vector HCCC-9810组和Vector CCLP1组比较差异均无统计学意义(1.32±0.12比1.34±0.14,1.48±0.15比1.59±0.14,P均>0.05)。见图7。

图7 Western Blot 验证miR-144对CCA细胞增殖和转移相关指标的影响
讨 论
肿瘤的转移包括转移和种植两个步骤。转移包括局部的侵袭、侵入血管进入体循环、循环系统中存活和外侵。种植的过程包括肿瘤细胞对外环境的适应,最终形成肉眼可见的肿瘤。近年来研究发现miRNAs几乎参与所有与肿瘤转移相关的关键基因的调节,结直肠癌患者血清中miRNAs的表达水平与其复发转移、预后等临床特征密切相关[7]。miRNAs可促进肿瘤的转移也可抑制肿瘤的转移。近年来miRNAs与CCA发生、发展之间关系的报道逐渐增多,一些miRNAs在CCA的发生发展过程中起着癌基因或者抑癌基因的作用[8]。miR-144的前体以miR-144/miR-451簇的形式存在,以miR-144单体发挥作用。相关研究结果表明,miR-144与喉癌、甲状腺癌、胰腺癌、恶性间皮瘤的发病相关。Gaedcke等[9]对57例直肠癌患者的肿瘤组织与癌旁正常黏膜组织的miRNAs做芯片检测,发现miR-144在直肠癌肿瘤组织中显著下调。Kalimutho等[10]通过在结直肠癌患者的肿瘤及其排泄物中筛查出648个miRNAs,发现miR-144在结直肠癌患者肿瘤组织和排泄物中均显著增加,且在其排泄物中稳定存在,为结直肠癌的诊断、预后预测、复发监测提供了一种新的思路。Sureban等[11]在结肠癌细胞HCT116中转染NP-siDCAMKL-1干扰片段,发现HCT-116的生长受到抑制,进一步研究发现这种抑制机制包括miR-144依赖的Notch-1表达的下调。
磷酸肌醇-3-激酶(PI3Ks)是一类连接胞内外生长信号的激酶家族,是PI3K/Akt/mTOR信号通路成员,PI3K信号通路具有调节细胞生长增殖、促进细胞周期进展及参与血管形成等多种功能,是细胞内重要的信号转导通路之一[12]。PI3K是一种磷脂酰肌醇蛋白激酶,与AKT蛋白的Ser308位点发生磷酸化,导致AKT蛋白的激活从而介导下游信号通路的激活,主要参与调控细胞周期、增殖和凋亡的过程[13]。PI3K-AKT信号通路的异常活化在人类肿瘤的很多发生及发展过程中发挥着重要的作用,如细胞增殖、生长、分化和凋亡等,其异常活化和人类肿瘤的发生发展密切相关。林琼燕等[14]通过抑制PI3K/AKT/mTOR信号通路使子宫内膜癌Ishiikawa细胞发生自噬,发挥抗肿瘤作用。Akt及其下游分子mTOR能够通过多种机制参与恶性肿瘤进展,并且调控基质金属蛋白酶(MMP)家族蛋白的表达[15-17]。多项研究结果表明通过靶定p-AKT可达到抑制肿瘤生长的目的。
MMP是一类内源性蛋白酶家族,参与人体众多的病理生理过程,其表达水平升高与机体炎症反应及肿瘤浸润转移密切相关[18]。MMP-2是MMD家族成员之一,在组织重构、炎症调控和肿瘤转移等多种病理生理过程中发挥重要作用[19-21]。MMP-2广泛表达于多种肿瘤细胞中,可通过降解细胞外基质成分而促进肿瘤血管新生,在肿瘤细胞浸润、迁移到其他组织中起着关键作用[22-23]。Coticchia等[24]对97例卵巢癌患者的尿液检测发现,糖类抗原(CA)125正常的卵巢癌患者MMP-2表达水平均存在明显差异,表明MMP-2在卵巢癌的进展和复发过程中起着重要作用。另外,在肺癌[25]、头颈部肿瘤[26]、黑色素瘤[27]中均发现MMP-2与肿瘤的相关性。
在本研究中,我们选择miR-144作为研究对象,结果表明在CCA细胞系HCCC-9810和CCLP1细胞中通过慢病毒载体过表达miR-144后,可对CCA细胞的多种生物学行为产生影响。首先,我们通过CCK8检测miR-144对CCA细胞的增殖能力的影响,表明过表达miR-144明显抑制CCA细胞的增殖;其次,通过细胞划痕实验和Transwell侵袭实验检测miR-144对CCA细胞迁移和侵袭能力的影响,结果显示miR-144过表达的CCA细胞系细胞迁移和侵袭能力均显著下降;最后发现在过表达miR-144的CCA细胞系中,p-AKT、MMP-2与细胞增殖和迁移密切相关的指标明显下调。这一结果提示miR-144通过下调p-AKT、MMP-2的表达,从而抑制CCA细胞的增殖和迁移能力,其对CCA体内的作用机制有待进一步的研究。

