《糖尿病相关眼病防治多学科中国专家共识》(2021年版)解读
高昕媛 徐倩 匡洪宇
糖尿病性视网膜病变(DR)及其他眼部并发症严重威胁着糖尿病患者的生存质量,为进一步规范和提高我国医务工作者对其的认识与管理,中华医学会糖尿病学分会组织并邀请糖尿病视网膜病变学组专家及国内眼科学专家结合最新研究成果,经充分讨论形成2021年版《糖尿病相关眼病防治多学科中国专家共识》(简称本共识),对DR、糖尿病性白内障(DC)、糖尿病性角膜病变(DK)、糖尿病性视神经病变(DON)的诊断、治疗、处理等各方面进行全面阐述,为便于临床医师阅读和理解,现就本共识的要点解读如下。
一、糖尿病性视网膜病变
1.DR的流行病学状况
了解我国的DR流行病学状况和发病趋势对该病防治,尤其是降低患者致盲率具有重要价值。本共识在2018年版《糖尿病视网膜病变防治专家共识》基础上更新了流行病学数据,Meta分析显示DR患病率达34.6%,其中增生型DR为6.96%,糖尿病性黄斑水肿(DME)为6.81%,威胁视力的DR为10.2%[1]。我国邯郸的一项研究提示糖尿病人群中DME与有临床意义的黄斑水肿(CSME)患病率分别为5.2%(3.1%~7.9%)和3.5%(1.9%~6.0%)[2]。以地理位置来看,我国农村DR患病率高于城市(29.1%比18.1%,P<0.001),北方DR患病率高于南方(26.5%比15.7%,P<0.001);东部DR患病率为18.0%,低于北方[2-4]。另外,我国台湾地区DR患病率为35%[5],我国香港地区DR患病率为18.2%[6]。新加坡华人中糖尿病人群DR患病率为20.1%[7],美国华人中糖尿病人群DR患病率为25.7%[8]。目前我国DR的患病率仍较高,临床筛查和管理面临巨大挑战。
2.DR的危害及发病机制
除损害视力外,DR还显著增加心血管疾病、全因死亡风险及抑郁症的发生[9-11]。DR的发生、发展是一个错综复杂的过程,涉及诸多分子、生物化学机制,且各种机制间相互作用,共同影响着视网膜血管及细胞的内环境稳态。目前关于DR的发病机制主要涉及血管和神经两大方面。本共识着重指出了高血糖或明显血糖波动、高血压、高血脂、糖尿病病程长、糖尿病肾病(DKD)、妊娠、肥胖、易感基因、胰岛素抵抗、吸烟、亚临床甲状腺功能减低、睡眠呼吸暂停综合征、非酒精性脂肪性肝病、血清泌乳素、脂联素及同型半胱氨酸水平[12-21]等均为DR进展的危险因素,明确对其进行综合干预的重要性。
3.DR的筛查与转诊
DR早期诊断、早期治疗可显著降低失明的风险,部分DR或DME患者可无症状,因此,临床医师必须重视且积极开展DR筛查并加强管理。本共识对DR的早期筛查与转诊作出总结和更新,对于DR多学科协同诊治具有指导意义。
本共识推荐糖尿病患者首次全面眼部检查应在眼科进行,眼部检查项目主要包括视力、眼压、房角、虹膜、晶体和眼底等,观察微血管瘤、视网膜内出血、硬性渗出、棉绒斑、视网膜内微血管异常、静脉串珠、新生血管、玻璃体积血、视网膜前出血、纤维增生等。青春期前或青春期诊断1型糖尿病(T1DM)患者在青春期后(12岁后)开始眼底筛查[22],青春期后诊断T1DM患者建议在病程5年内,必须进行第1次DR筛查[23]。2型糖尿病(T2DM)患者则建议在确诊后尽快进行首次全面的眼科检查[22]。已确诊糖尿病患者,妊娠期间视网膜病变有发生、发展的风险,应于计划妊娠和妊娠早期进行全面眼科检查。尤其需要指出的是,妊娠期确诊糖尿病的患者发生DR的风险不会增高,因此妊娠期无需进行眼底检查[23]。DR和DKD密切相关,T2DM患者诊断DKD时需参考是否伴发DR[24-25],因此,T2DM伴发微量白蛋白尿或肾小球滤过率下降者需检查有无DR。本共识新增评估工具及应用推荐等内容,虽然目前国内的人工智能(AI)筛查系统研究取得了重大进展,但仍存在数据标准化、临床评价统一化等问题。糖尿病是一种全身性疾病,对血清和眼生物流体生物标记物的探索将有助于预测DR的发生、发展[26-27]。总体上,本共识明确了DR的筛查时机与频率,将眼底镜、免散瞳眼底摄片作为最简单直接的筛查手段,将AI作为筛查的辅助工具,并且提出了生物标记物这个筛查方向。
为实现DR的早期发现与早期干预,应注重分级诊疗流程与双向转诊,如存在以下初筛结果,需及时至眼科就诊[23]:(1)无DR、轻度非增殖型糖尿病视网膜病变(NPDR)、无DME应于1年内至眼科诊查;(2)中度NPDR、非累及黄斑中心凹的DME应于3~6个月内至眼科诊查;(3)重度NPDR、PDR、累及黄斑中心凹的DME需立即至眼科诊治。如发现以下情况需当天急诊转至眼科就诊[28]:突然的视力丧失、视网膜脱离、视网膜前或玻璃体出血、虹膜红变导致出现虹膜新生血管性青光眼(NVG)。本共识着重指出了早期识别进展期视网膜病变患者转诊至眼科获得有效、及时治疗的重要性,是预防失明的重要环节。
4.DR的临床表现、诊断及分期
DR患者的治疗与管理根据DR病变的严重程度和DME的存在及类型进行描述。本共识推荐美国眼科学会2019年发布的《糖尿病性视网膜病变国际临床分级标准》[29]。见表1、表2。
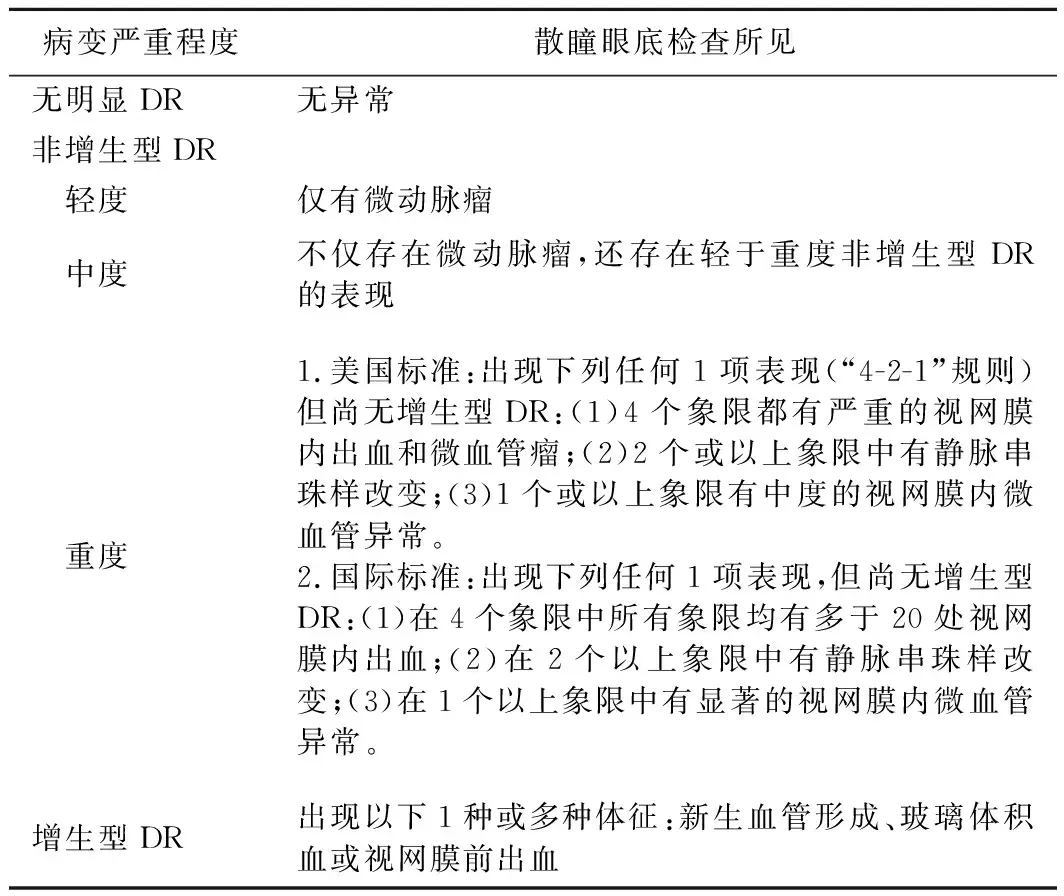
表1 DR的国际临床分级标准(2019年版)

表2 DME的国际分级标准(2019年版)
5.DR的预防和治疗
本共识认为,对DR人群进行预防和治疗应包括健康教育、代谢紊乱的控制、抗血小板治疗、针对DR的内科治疗及眼科治疗等5个方面。目前各类降糖药物均可通过血糖控制来达到预防DR的效果。有研究显示肾素-血管紧张素系统阻断剂可减少DR的发生风险,改善轻中度DR[30-33]。另外有研究发现对于基线有DR的患者,非诺贝特减少DR进展高达57%[34]。具有抗氧化应激、抗炎作用的药物对DR治疗有潜在获益[35];在DR中晚期,羟苯磺酸钙联合激光或抗血管内皮生长因子(VEGF)治疗可改善血流动力学、降低黄斑厚度及视网膜新生血管荧光素渗漏面积,进一步保护残存视功能[36-37]。在中医中药方面,芪明颗粒及复方丹参滴丸均已获批可用非增殖期2型糖尿病视网膜病变治疗[38-39]。此外,越来越多的研究开始关注神经保护在DR治疗中的重要作用,神经保护正成为DR防治的重要新策略。对于女性糖尿病患者,由于妊娠会加速DR的发生和发展,激光光凝术可用于治疗妊娠期重度NPDR和PDR[40]。
二、糖尿病其他眼部并发症
1.糖尿病性白内障
DC是糖尿病患者视力下降的重要原因之一,已成为糖尿病并发症中仅次于视网膜病变的第二大眼病。高血糖通过改变晶状体的渗透压、诱发晶状体氧化应激、引起晶状体蛋白糖基化等多种途径,加速白内障的发生和发展;血糖波动通过一过性改变屈光状态,加重晶状体负担[41]。DC患者中最常见的类型是老年性白内障,治疗中建议进行全程规范化和个性化血糖管理,定期进行眼科随诊。
本共识指出糖尿病患者全身条件较差,眼底情况复杂,早期如能严格管理血糖,晶状体混浊是可逆的,当混浊的晶状体严重影响视力和生活质量时可手术治疗。虽然目前白内障摘除手术技术日臻成熟,但是DC患者术中及术后并发症的发生率仍高于普通患者。
2.糖尿病性角膜病变
DK的临床表现包括角膜知觉减退、干眼、持续角膜上皮缺损、浅层点状角膜炎、角膜溃疡迁延不愈等,更甚者可致永久性视力丧失的角膜穿孔[42]。DK患者因角膜知觉减退或缺失而存在症状-体征分离现象,易贻误最佳防治时机。严格血糖管理是DK基础治疗的关键。本共识也强调了临床应注重内分泌科与眼科的协同,将持续性或反复性角膜上皮缺损以及持续性角膜溃疡的DK患者转诊至眼科获得及时、有效的治疗,是避免角膜穿孔和眼内炎等严重并发症发生、从而预防失明的重要环节。根据角膜病变类型和损伤程度还需要使用人工泪液、自体血清、抗生素和角膜绷带镜等局部治疗。当药物难以控制病情时,为抑制角膜基质融解和保持眼球完整性,可采用眼裂缝合术、羊膜移植术、板层或穿透性角膜移植术等手术治疗[43]。长期以来,角膜病容易受到忽视,内科医师也需加强对相关知识的掌握。
3.糖尿病性视神经病变
DON是一组严重威胁视功能的视神经疾病,主要包括非动脉炎性前段缺血性视神经病变、糖尿病性视乳头病变、糖尿病性视盘新生血管及糖尿病性视神经萎缩[44]。DON可单独出现,也可与DR合并出现,DR患者中DON的发生率约为38.4%,NPDR中DON的发生率为6.2%,而在PDR中DON的发生率为66.5%。年龄、糖尿病病程、糖化血红蛋白(HbA1c)和收缩压均为DON的危险因素,且随着糖尿病病程的延长或HbA1c水平的增加均将导致DON发生的风险增加[45]。目前防治重点在于控制各项危险因素及避免另一眼出现病变。本共识指出DON基础治疗方面需维持血糖、血压、血脂平稳,且早期从神经机制角度给予药物治疗,挽救剩余视神经功能、延缓视神经萎缩。DON临床表现多样,不同分型预后存在差异性。糖尿病性视盘新生血管眼底表现为视盘某一象限(多位于颞上象限)或整个视盘或周围1个视盘直径范围内点状、斑状、线状、网状、车轮状或海扇状的新生血管,并可彼此融合成簇,延伸至邻近视网膜或伸入玻璃体内。在内科治疗中一旦发现糖尿病性视盘新生血管应立刻转诊至眼科,治疗以玻璃体切除手术、抗VEGF治疗及全视网膜激光凝固术为主。
综上,本共识汇集内分泌及眼科专家的专业意见,进一步明确了DR、DC、DK、DON的诊断与处理,系统地论述了筛查、评估和治疗中的问题,也提出有关发病机制方面的进展,指明未来进一步研究的方向,有利于DR及其他眼部并发症的规范化综合管理。

