基于脑部特异子结构分析的阿尔兹海默症分类
印 彪,何小海,卿粼波,陈洪刚,刘 艳
(1四川大学 电子信息学院,成都 610065;2成都市第三人民医院 神经内科,成都 610031)
0 引 言
阿尔兹海默症(Alzheimer′s disease,AD)是全世界的公共卫生难题,也是受到广泛关注的神经退行性疾病之一。AD是一种无法治愈的疾病,因为还未推出诊断和治疗方法来减缓其进展或停止其发作。AD是由与记忆有关的大脑区域神经细胞的损伤和破坏引起的,最常见的症状是记忆丧失和认知能力下降。AD影像学辅助诊断的常见做法是使用MRI影像,可以通过磁场和无线电波捕捉大脑的结构。
机器学习和深度学习方法已被提出用于痴呆疾病的自动识别,特别是深度学习在AD和MCI的计算机辅助诊断中表现突出。在最新的研究中,卷积神经网络(Convolutional Neural Networks,CNN)已被证明在脑MRI图像的认知疾病自动诊断方面表现出色。与切片上的二维卷积相比,在整个MRI上的三维卷积可以捕获潜在的三维结构信息,这可能是识别的关键。
根据已有的工作,AD分类方法大致可以分为3类:基于体素、基于感兴趣区域(ROI)的、以及基于区域块的。其中,在基于体素的方法中,简单地通过统计或选择体素来提取特征。Ju等人提出利用深度学习结合脑网络和临床相关文本信息对阿尔茨海默病进行早期诊断。然而,基于体素的特征通常具有更高的维数和噪声,这可能与疾病无关。因此,需要通过平滑、降采样和特征选择等技术来降低基于体素的特征的维数,以提高分类器的效率。在基于ROI的方法中,将大脑MRI图像分割成不同的组织ROI,然后使用基于ROI的特征向量或这些ROI之间的关系向量来描述MRI图像对AD患者进行分类。Ahmed等人开发了一种利用海马视觉特征进行AD识别的自动分类框架。郑伟等人通过MRI/PET融合保留了图像中的细节信息,为医学上融合奠定了基础。
在早期,基于AD患者比CN患者更容易出现脑萎缩这一事实,人们做了大量的工作来手工或半手工测量先验感兴趣区域(ROI),大多数基于ROI的分析集中在海马和内嗅皮层区域。通过比较不同被试的ROI,可以发现有价值的信息,为诊断提供辅助信息。Liu等人提出了一种基于ROI的轮廓波子带能量特征来表示MRI图像的频域特征,用于AD分类。将预处理后的MRI图像通过构建的脑掩膜分割成90个ROI,在空间域对90个ROI进行特征提取,而对每个ROI进行轮廓波变换,得到其能量子带。利用支持向量机(Support Vector Machine,SVM)分类器对来自ADNI和OASIS数据库的880名受试者进行分类。
目前大部分研究是基于MRI图像使用3D卷积进行分类,之前已经有文章提出基于脑部MRI子结构图像进行分类,并没有探究整个脑部子结构的特异性。本文是用机器学习的方法基于提取体积特征子结构,然后将特征子结构的信息加入到深度学习网络中并加入注意力模块提取MRI影像中的有效信息,本文做的主要贡献如下:
(1)基于机器学习,提取在阿尔兹海默症诊断过程中起决定性因素的特征子结构。
(2)将特征子结构的体积信息与深度学习分类网络的高维信息融合,同时增加注意力模块,过滤MRI冗余信息。
1 数据
1.1 数据集介绍
本文使用的数据来自阿尔茨海默病神经影像学倡议(ADNI)数据库。本研究的数据集ADNI-SEG是以受试者为基本单位,在ADNI数据集上均匀选取765名受试者及其MRI脑部影像2 294个;其中AD的受试者为407人,CN的受试者为358人;对于脑部MRI,AD占有1 223例,CN占有1 071例。研究根据受试者年龄、简易精神状态检查表(minimental state examination,MMSE)、临床痴呆评定量表(Clinical Dementia Rating,CDR)、临床痴呆综合汇总评定量表(CDR Sum Boxes,CDR-SB)的均值和方差,将受试者按照7:3的比例,均匀划分成训练集和测试集,其数据分布见表1。
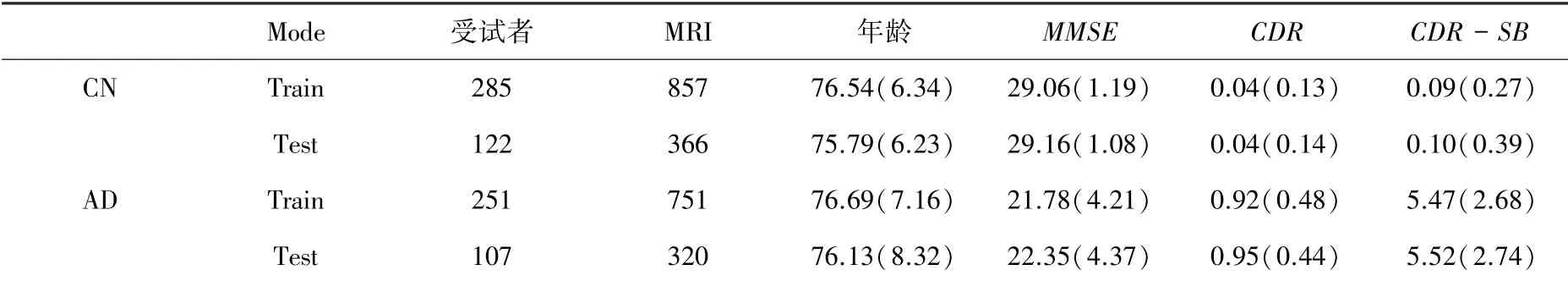
表1 ADNI-SEG数据分布情况Tab.1 ADNI-SEG data distribution
1.2 数据预处理
1.2.1 方法介绍
本文提取脑部子结构采用的是Huo等人的基于空间块地图的三维全脑分割网络,该方法将脑部MRI分成27个独立的块,然后通过3D完全卷积网络对高分辨率的MRI块进行全脑分割,每个网络学习固定空间中的分割信息,最后将分割后的子块融合,还原整个脑部MRI,完成全脑子结构分割。该方法可以将脑部分割成132个子结构,与多图谱分割的方法相比具有较好的分割性能,同时将计算时间从原来的30 h缩短到了15 min。
1.2.2 数据预处理
本文预处理采用的环境配置为Ubuntu16.04、11 GB NVIDIA 1080Ti显卡。预处理代码所基于的深度学习环境为CUDA8.0、Python2.7、Pythorch0.2。
这里给出的预处理步骤如下:首先,对MRI图像进行MNI空间仿射配准,将配准后的MRI影像进行N4偏置场校正、强度归一化。然后,将预处理后的图像送入分割网络中,进行脑部子结构的分割与融合,得到分割后脑部子结构的掩模MRI。最后,将分割后的掩模文件反配准到原始空间,得到原始掩模。
2 方法
2.1 脑部子结构特异性分析
在本小节的实验中,选用了支持向量机(Support Vector Machines,SVM)、决策树(Decision Tree,DT)、随机森林(Random Forest,RF)、自适应增强法(AdaBoost)四种机器学习的方法,应用于ADNI-SEG数据集的体积信息,对阿尔兹海默症做二分类。对此拟展开剖析分述如下。
(1)支持向量机(SVM)。是定义在特征空间上的间隔最大的线性分类器,通过最大化间隔得到全局最优解,支持向量机在高维空间中构造一个超平面或超平面集合,可用于分类、回归任务。
(2)决策树(DT)算法。是一种预测建模技术,用于数据挖掘、统计和机器学习应用中的分类。可通过计算数据集所有属性的信息增益值来对数据集进行分类。树中的叶节点表示一个类标签,而这些叶节点的分支表示导致这些类标签的输入变量的组合。
(3)随机森林(RF)。是一种集成学习方法,通过在训练时构建大量决策树来操作。对于分类任务,随机森林的输出是大多数树所选择的类。对于回归任务,返回单个树的平均值或平均预测。
(4)自适应增强(AdaBoost)。这是一种统计分类元算法。可以与许多其他类型的学习算法结合使用来提高性能。其他学习算法(“弱学习算法”)的输出被合并成加权和,代表增强分类器的最终输出,同时AdaBoost是自适应的。
2.2 注意力融合网络
2.2.1 模型整体
本文的整体框架如图1所示。网络的主体是基于3D ResNet进行的改进。过程中主要对3D ResNet的残差模块进行了修改,引入了残差注意力模块,减少了图像的冗余信息,具体的注意力模块将在2.2.2节中做详尽的阐述。在FC层引入脑部子结构的体积信息作为分类的特征向量,进一步提高了网络分类的准确性。
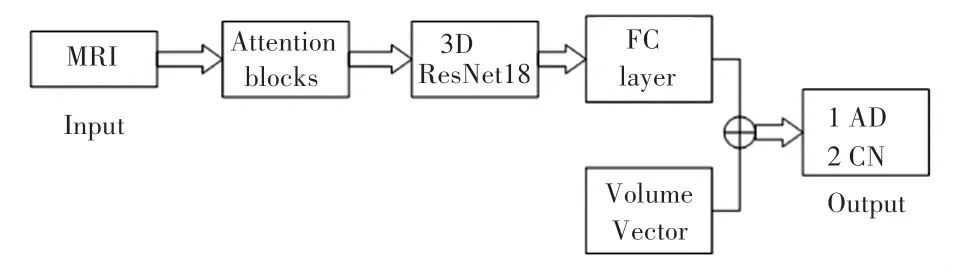
图1 整体结构图Fig.1 Overall structure diagram
由图1可知,三维的脑部MRI作为输入,经过本文研发设计的网络,并且加入脑部子结构体积信息,输出是阿尔兹海默症分类的预测标签:AD、或是CN。模型中所有的卷积层之后都会进行批量归一化(Batch Normalization,BN)和激活函数两个模块处理,以保证训练模型为非线性。
2.2.2 注意力模块
注意力残差模块是本文设计网络中重点加以改进的模块,主要在残差网络的基础上引入了支路注意力模块,注意力残差模块如图2所示。在图2中,产生的注意力图用于加权通过卷积提取特征图来遮盖冗余的区域。注意力残差模块分为3个部分,即:注意力模块、卷积模块和原始模块。首先三维的特征输入用表示,将送入注意力子网络,输出为(M);同时将送入卷积网络模块,用于提取和输出特征(M),最后使用残差网络的原理将2个分支的结果与原始的特征向量进行聚合。通过注意力残差网络后提取三维图像特征,抑制与阿尔兹海默症无关的信息。此处需用到的数学公式为:
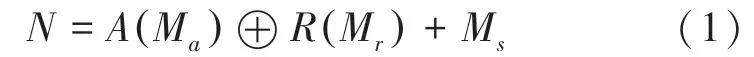
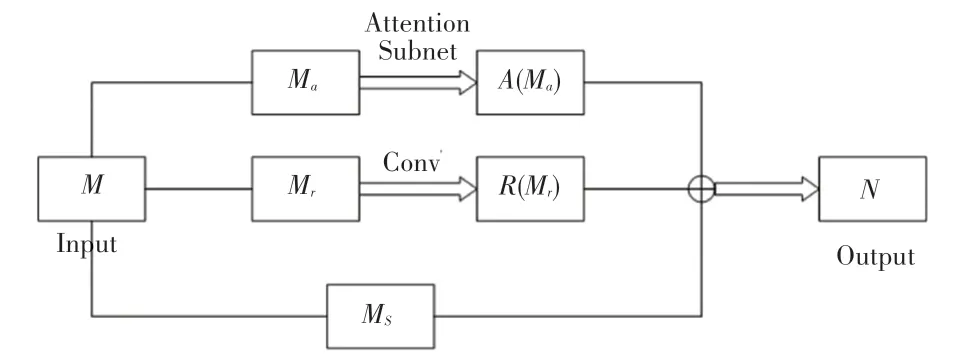
图2 注意力模块Fig.2 Attention module
2.2.3 注意力子网络
注意力子网络集成在注意力残差模块中,生成三维特征的注意力特征图,去除MRI影像中的冗余信息,提高分类任务的准确性。注意力子网络的网络结构如图3所示。原始的MRI图像通过三维卷积神经网络的卷积层,通过卷积层提取的特征图再经由最大值池化下采样,保留特征图的高维信息,然后将通过相反的下采样过程,恢复到原始图像相同的尺寸大小。此后会进一步地提取特征,将得到的特征输入函数,将特征图中的每一个元素缩放到(0,1)范围内,得到注意力加权掩模。最后用掩模对原始的特征图进行加权,得到加权后的注意力特征图。
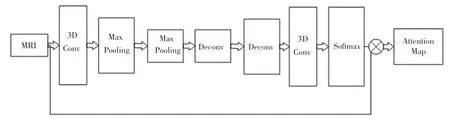
图3 注意力子网络Fig.3 Attention subnet
在下一阶段,将特征图添加到剩余块的输出中,以细化其输出中的冗余特性。值得注意的是,注意力特征图不仅可以用作前推理过程中的特征选择器,还能用作后向传播过程中的梯度更新过滤器。因此,注意子网可以防止错误的梯度来更新参数。预测的注意力图可以通过残块与特征地图输出融合,从而有效地将网络激活重点放在突出区域上。
3 实验和结果
3.1 脑部子结构特异性分析
3.1.1 实验部分
在本小节的实验中,选取了支持SVM、DT、RF、AdaBoost四种机器学习的方法,应用于ADNI-SEG数据集的体积信息,对阿尔兹海默症做二分类。
3.1.2 结果分析
在本小节中所有的分类模型都在训练数据集上经过10次交叉验证进行训练,对训练模型进行交叉验证,避免模型的过拟合。接着用训练好的模型在测试机上进行验证。在测试集上的准确率见表2。

表2 基于体积信息的二分类机器学习准确率Tab.2 Accuracy of two-class machine learning based on volume information %
由表2可知,在针对体积信息的二分类上,SVM准确率达到了75.21%,DT准确率达到76.02%,RF的准确率达到了77.34%,AdaBoost的准确率达到了77.29%,实验结果表明脑部子结构体积的变化对于阿尔兹海默症的分类有一定的作用,因此通过决策树输出其靠近顶部节点的子结构信息,最具有区别性的3个子结构为海马体、杏仁体和鼻内嗅皮层。在后面的深度学习分类网络中,则会将机器学习提取出的显著子结构的体积信息作为向量,融合到特征层中。
3.2 特异性子结构融合分类
3.2.1 实验配置
本文实验采用的环境配置为Ubuntu16.04、11 GB NVIDIA 1080Ti显卡。实验代码基于的深度学习环境为CUDA11.0 Pythorch1.9.0。优化器选用Adam更新模型参数,初始的学习率为0.01,选取学习率衰减周期为50,迭代次数为200。
3.2.2 实验结果分析
实验主要使用的数据集为自行划分的ADNI数据库(ADNI-SEG),主要从算法在选用数据集上的分类准确率对神经网络的优劣进行评判;对比当前经典网络卷积神经网络算法,分析注意力残差模块网络的表现。
在ADNI-SEG上对开源的算法和主流方法进行复现和算法准确度的评估,采用SVM、ResNet18-3D、ResNet34-3D为基础对比网络,分类网络输出层采用2层全连接层的形式,最终得到预测结果。基于ADNI-set数据集上的MRI影像数据,不同分类网络在分类任务上的识别准确率见表3。
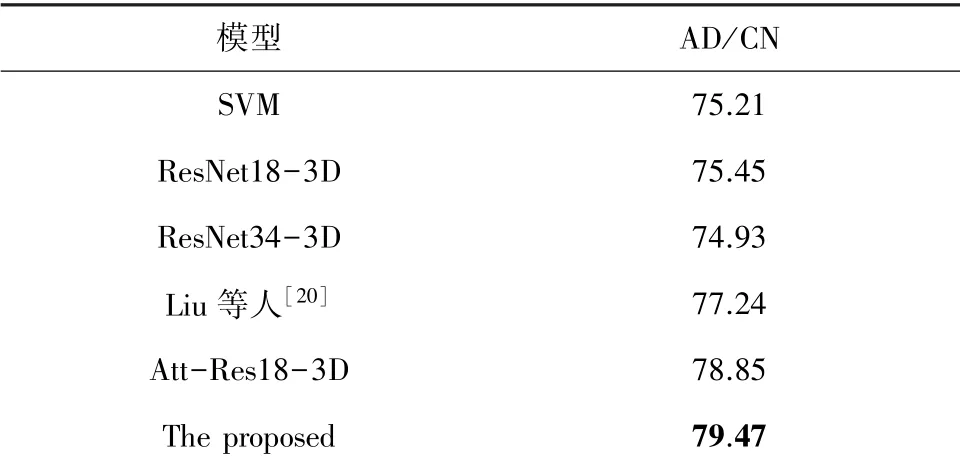
表3 基于ADNI-SEG数据集的算法准确率Tab.3 Algorithm accuracy rate based on ADNI-SEG %
由表3中的分类识别率可以看出,在AD/CN二分类任务上,基于卷积神经网络的深度学习方法识别准确率高于传统的SVM机器学习方法。ResNet18-3D和ResNet34-3D进行对比可以看出ResNet18-3D在分类上的准确率更高,由此说明对于阿尔兹海默症分类任务中,浅层的残差卷积神经网络表现更好,因此网络层数并不是越深越好,对于简单的分类任务,较浅的神经网络提取特征更加有利于分类。Att-Res18-3D和ResNet18-3D两个网络进行对比可知,Att-Res18-3D在分类准确率上表现更好,注意力残差模块的引入,相比于ResNet18-3D能够更好地过滤原始MRI影像中的冗余信息,抑制无关区域的像素值,从而提高了分类的准确性。Liu等人的方法用ADNI-SEG数据集训练得出的准确率为77.24%,准确率低于本文提出的方法。本文的方法和Att-Res18-3D网络进行对比,在准确率指标上有一定的提升,这说明了脑部子结构的体积大小分布对于阿尔兹海默症的分类起到一定的促进作用。
4 结束语
本文运用机器学习的方法,对数据集ADNISEG子结构体积进行了分类任务,从中得出了对于阿尔兹海默症分类的体积特异性子结构、对阿尔兹海默症诊断起决定性作用的子结构为海马体、杏仁体和鼻内嗅区,说明了在阿尔兹海默症患病的过程中,脑部子结构体积会存在相应的变化。深度学习将机器学习提取出来的特征子结构体积信息加入网络中进行特征的融合,进一步提高了分类的准确率,同时加入了注意力模块,去除了MRI影像中的冗余信息,提高了二分类的准确率。

