逆转录重组酶介导的新型冠状病毒可视化快速检测方法的建立
蔡 欣,周婷婷,朱 进,孙学伟,刘晓光,杨 展,汪茂荣
0 引 言
新型冠状病毒肺炎(Corona virus disease 2019,COVID-19)疫情持续暴发,对全球公共卫生构成了严重威胁[1]。严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)是一种包膜阳性单链基因组RNA病毒(+ssRNA)[2-4],与SARS冠状病毒、MERS冠状病毒同属巢病毒目,冠状病毒科,正冠状病毒亚科,β属冠状病毒[3-5],SARS-CoV-2传染性极强,传播迅速,主要通过呼吸道飞沫和接触传播[6-8]。COVID-19患者的常见临床症状为发热、咳嗽、剧烈头痛、肌痛和乏力,重症病例还会出现急性呼吸窘迫综合征、多器官衰竭等[9-10]。由SARS-CoV-2引起的COVID-19正在全球大流行,对国际卫生和全球经济构成严重威胁[11]。因此,急需建立SARS-CoV-2的快速检测方法,并应用于SARS-CoV-2检测工作,对疫情防控具有重要意义。重组酶介导的等温核酸扩增技术(recombinase-aided amplification,RAA)是在恒温条件下,大肠埃希菌中提取和纯化的重组酶与引物形成复合体,该复合体与DNA链紧密结合,在单链结合蛋白协同下DNA完成解链,在DNA聚合酶的作用下不断反应形成新的DNA互补链,不断重复这一过程,反应产物呈指数级高效增长[12],最终实现核酸的扩增[12-13]。本研究基于RAA技术建立了SARS-CoV-2的荧光RT-RAA法和可视化的RT-RAA-LFD法。
1 材料与方法
1.1 实验材料MiniBEST质粒纯化试剂盒,TaKaRa公司;RT-RAA核酸扩增试剂盒(荧光法)、RT-RAA核酸扩增试剂盒(试纸条法),一次性胶体金侧向流免疫层析试纸条,江苏奇天基因生物科技有限公司;荧光定量PCR仪,Bio-Rad公司;B-6100 RAA 恒温振荡离心仪、F-1620恒温核酸扩增检测仪,江苏奇天基因生物科技有限公司;-20 ℃冰箱,中国Haier公司;Eppendorf移液器,德国Eppendorf公司。
1.2方法
1.2.1 引物探针合成选择从全球流感数据共享倡议(GISAID)(https://www.gisaid.org/)下载的核衣壳蛋白(N)基因、刺突蛋白(S)基因及开放阅读区(ORF1ab)基因作为靶区。根据江苏奇天基因生物科技有限公司RAA设计原则分别设计上下游引物和探针,在每个基因的保守区域内运用Primer Premier 5在该扩增片段上分别设计3条上游引物、3条下游引物和1条探针。利用NCBI 网站(https://www.ncbi.nlm.nih.gov/)的Primer-BLAST验证引物和探针的特异性。所有引物和探针均由上海生工生物技术有限公司合成,并采用高效液相色谱法(HPLC)进行纯化。
1.2.2重组质粒构建从NCBI 网站上(https://www.ncbi.nlm.nih.gov/)下载人类冠状病毒-OC43 (Human Coronavirus-OC43, HCoV-OC43)、人类冠状病毒-229E,(human coronavirus-229E, HCoV-229E)、人类冠状病毒- HKU1 (human coronavirus- HKU1, HCoV-HKU1、人类冠状病毒-NL63 (Human Coronavirus-NL63, HCoV-NL63)、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)、重症急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus, SARS- CoV)的基因序列,运用DNAMAN软件挑选出一段保守基因片段,委托上海生工生物技术有限公司合成质粒,载体为PUC57质粒。采用与RT-RAA方法相同的引物扩增SARS-CoV-2的3个基因片段,也用同样的方法合成质粒。使用MiniBEST质粒纯化试剂盒提取质粒后测定质粒浓度,于-20 ℃冰箱保存。各基因的预期拷贝数根据之前的研究计算[14]。
1.2.3RT-RAA方法的建立荧光RT-RAA最佳引物对的筛选 以1.2.2中构建的含有SARS-CoV-2 N、S、ORF1ab基因组DNA序列的质粒作为模板,将设计的3条上游引物、3条下游引物进行3×3组合,结合探针,按照说明书与荧光RT-RAA核酸扩增试剂盒中其他试剂混合为50 μL的扩增体系,以去离子水为阴性对照。将反应体系置于B-6100 RAA 恒温振荡离心仪中震荡混匀2 min后,转移至F-1620恒温核酸扩增检测仪,39 ℃恒温条件下反应12 min,每20 秒采集 1次荧光值。挑选出起峰时间最早、峰值最高的上下游引物组合作为最佳引物。
荧光RT-RAA引物浓度和探针浓度优化 在50 μL扩增体系中分别加入1.5、1.8、2.1、2.4和2.7 μL原始浓度为10 μmol/L的上下游引物进行扩增,以浓度为105拷贝数/μL质粒为模板进行荧光RT-RAA核酸扩增,筛选出最佳引物浓度。在扩增体系中分别加入0.2、0.4、0.6、0.8和1.0 μL原始浓度为10 μmol/L的探针进行扩增,以浓度为105拷贝数/μL质粒为模板进行RT-RAA扩增,筛选出最佳探针浓度。
1.2.4RT-RAA-LFD法的建立在荧光RT-RAA法优化的条件下,将荧光法挑选好的引物和探针序列设计成试纸条法的引物和探针。将设计好的引物探针按照荧光RT-RAA法优化好的50 μL体系配置好反应管,将反应管置于B-6100 RAA 恒温振荡离心仪中震荡混匀2 min后,恒温39 ℃条件下反应12 min。反应结束后的扩增产物通过胶体金侧向流免疫层析试纸条检测。从反应管中用移液器取出5 μL扩增产物,与95 μL PBS缓冲液在1.5 mL EP管中混匀,将试纸条的偶联垫末端垂直插入EP管中,使其接触混合液,2 min 后取出试纸条观察并拍照记录结果(阳性样品出现红色检测线和蓝色质控线而阴性样品不出现红色检测线仅出现蓝色质控线)。
1.2.5灵敏性实验以SARS-CoV-2 3种基因的质粒为模板进行灵敏性评价。将构建的含有SARS-CoV-2 3种基因序列的质粒按浓度梯度10倍倍比稀释制备成100~1010拷贝数/μL阳性标准品备用。利用优化好的两种RT-RAA反应扩增体系依次对上述定量样品进行检测,确定方法的检出限。同时将SARS-CoV-2重组质粒荧光定量试剂盒(RT-PCR)在荧光定量PCR仪上按说明书进行检测,检测时间约为120 min,比较两种方法的敏感性。
1.2.6特异性实验采用与呼吸道感染相关或者临床症状相近的病毒样本进行特异性的评价。以6种在人群中较为常见的冠状病毒(HCoV-OC43、HCoV-229E、HCoV-HKU1、HCoV-NL63、MERS-CoV、SARS)及SARS-CoV-2质粒模板同时进行检测,评价SARS-CoV-2荧光RT-RAA法和RT-RAA-LFD法的特异性。
1.2.7重复性试验重复性实验设置一个阴性对照,3个重复对照,阴性对照使用1 μL ddH2O为模板,重复对照使用1 μL 105拷贝数/μL浓度的SARS-CoV-2质粒DNA为模板。样品加入后,各反应管充分混合,根据SARS-CoV-2荧光RT-RAA法和RT-RAA-LFD法的实验要求进行实验。
2 结 果
2.1 SARS-CoV-2 RT-RAA 扩增体系的建立
2.1.1 引物、探针筛选以浓度为105copies/μL 3种质粒分别为模板,阴性对照用ddH2O为模板,进行荧光RT-RAA扩增,筛选出最佳引物探针组合。N基因最佳引物探针为:N-F(上游引物) CAGTTCAAGAAATTCAACTCCAGGCAGCAGTAG,N-R(下游引物)CAGTTTGGCCTTGTTGTTGTTGGCCTTTAC,N-probe(探针)CAGACATTTTGCTCTCAAGCTGGTTCAATC/i6FAMdT//idSp//iBHQ1dT/CAAGCAGCAGCAAAG (C3-spacer)。S基因最佳引物探针为:S-F CTTCAACCTAGGACTTTTCTATTAAAATATAATG,S-R GTTGGTTGGACTCTAAAGTTAGAAGTTTGATAG,S-probe CCATTACAGATGCTGTAGACTGTGCACTTGACCC/i6FAMdT/C/idSp/C/iBHQ1dT/CAGAAACAAAGTGTACG(C3-spacer)。ORF1ab基因最佳引物探针为:ORF1ab-F TACGCCAAGCTTTGTTAAAAACAGTACAATTCTG,ORF1ab-R GGCATTAACAATGAATAATAAGAATCTACAACAGG,ORF1ab-probe TTGTTGGTGTACTGACATTAGATAATCAAGATC/i6FAMdT/C/idSp/A/iBHQ1dT/GGTAACTGGTATGATTTCG(C3-spacer)。扩增在2~5 min 内即开始起峰,在12 min内达到峰值。
2.1.2引物和探针浓度的优化以浓度105copies/μL 3种SARS-CoV-2质粒分别为模板,ddH2O为阴性对照,将浓度为10 μmol/L的3种引物加样量设置5个梯度进行荧光RT-RAA,引物体积为2.1 μL,扩增曲线正常,效果最佳。同样,探针体积为0.6 μL时,扩增效果最佳。该方法的最佳体系见表1。

表 1 RT-RAA最佳反应体系
2.2RT-RAA-LFD法的建立利用荧光法筛选好的引物和探针更改荧光标记的位置,设计出RT-RAA-LFD法的引物和探针。N基因最佳引物探针为:N-F(上游引物) CAGTTCAAGAAATTCAACTCCAGGCAGCAGTAG,N-R-L(试纸条法下游引物)(Biotin)CAGTTTGGCCTTGTTGTTGTTGGCCTTTAC,N-probe-L(试纸条法探针)(FAM)CAGACATTTTGCTCTCAAGCTGGTTCAATCT/idSp/TCAAGCAGCAGCAAAG (C3-spacer)。S基因最佳引物探针为:S-F CTTCAACCTAGGACTTTTCTATTAAAATATAATG,S-R-L (Biotin)GTTGGTTGGACTCTAAAGTTAGAAGTTTGATAG,S-probe-L (FAM)CCATTACAGATGCTGTAGACTGTGCACTTGACCCTC/idSp/CTCAGAAACAAAGTGTACG (C3-spacer)。ORF1ab基因最佳引物探针为:ORF1ab-F TACGCCAAGCTTTGTTAAAAACAGTACAATTCTG,ORF1ab-R-L (Biotin)GGCATTAACAATGAATAATAAGAATCTACAACAGG,ORF1ab-probe-L (FAM)TTGTTGGTGTACTGACATTAGATAATCAAGATCTC/idSp/ATGGTAACTGGTATGATTTCG(C3-spacer)。
2.3灵敏性实验SARS-CoV-23种基因的荧光RT-RAA 法灵敏性实验结果表明12 min左右SARS-CoV-2 N基因,S基因101-1010拷贝数的样本均有扩增曲线出现,100拷贝数样本和阴性对照无扩增曲线,SARS-CoV-2 ORF1ab基因100-1010拷贝数的样本均有扩增曲线出现,仅阴性对照无扩增曲线,见图1。由此可见SARS-CoV-2 ORF1ab基因在3种基因中的灵敏性最好,可达100拷贝数。RT-RAA-LFD法的灵敏性检测结果见图2。可得出SARS-CoV-2 N基因、S基因、ORF1ab基因最低检出限均为103拷贝数。SARS-CoV-2 RT-PCR法的灵敏性为102拷贝数。3种方法经过比较,在本研究中SARS-CoV-2 N基因、S基因的荧光RT-RAA 法灵敏性比RT-PCR法高10倍左右,SARS-CoV-2 ORF1ab基因的荧光RT-RAA 法灵敏性比RT-PCR法高100倍左右,试纸条法的灵敏性略低于RT-PCR法。说明荧光RT-RAA法具有较高灵敏性,RT-RAA-LFD法在具有可视化优势的情况下兼顾了灵敏性。
2.4特异性试验SARS-CoV-2荧光RT-RAA法特异性试验检测结果见图3。显示只有SARS-CoV-2样本出现扩增曲线,为阳性扩增,其他样本如HCoV-OC43、HCoV-229E、HCoV-HKU1、HCoV-NL63、MERS-CoV、SARS样本及阴性对照均没有扩增,为阴性。RT-RAA-LFD法检测结果见图4。显示只有SARS-CoV-2质粒DNA出现红色检测线和蓝色质控线,为阳性,其他样本(HCoV-OC43、HCoV-229E、HCoV-HKU1、HCoV-NL63、MERS-CoV、SARS)及阴性对照仅出现蓝色质控线,为阴性结果。表明本实验建立的SARS-CoV-2荧光RT-RAA法和RT-RAA-LFD法具有较高的特异性。
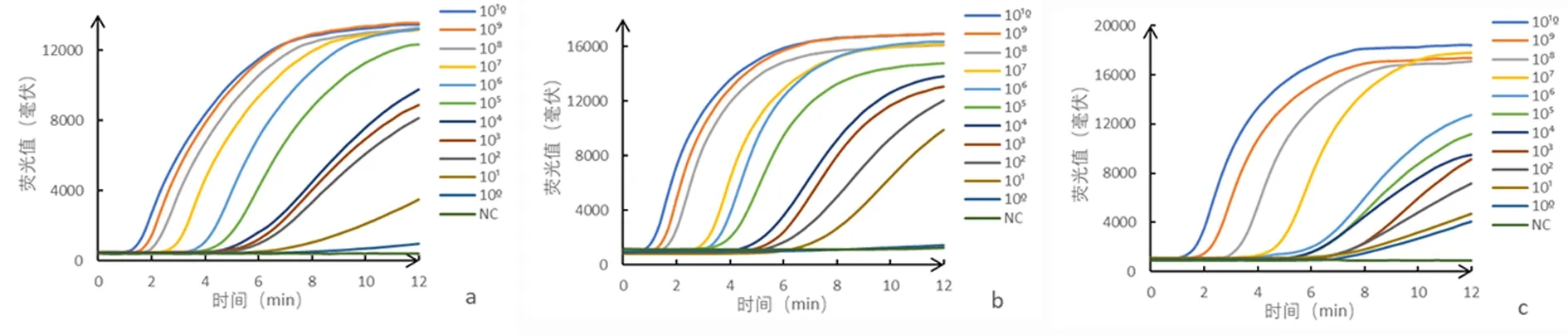
a:SARS-CoV-2 N; b:SARS-CoV-2S; c:ORF1ab

a:SARS-CoV-2 N; b:SARS-CoV-2S; c:ORF1ab
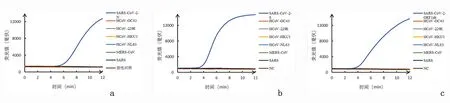
a:SARS-CoV-2 N; b:SARS-CoV-2S; c:ORF1ab

a:SARS-CoV-2 N; b:SARS-CoV-2S; c:ORF1ab
2.5重复性试验按照表1的最佳体系配制好1个阴性对照、3个重复对照按照荧光RT-RAA法和RT-RAA-LFD法的实验要求进行重复性实验。荧光RT-RAA法实验结果见图5。结果显示3个重复组扩增反应起峰时间基本相同,曲线形态较为接近,表明荧光RT-RAA法具有良好的重复性。RT-RAA-LFD法的结果见图6。3个实验组均出现强阳性,阴性对照显示结果为阴性,表明RT-RAA-LFD法重复性也非常好。
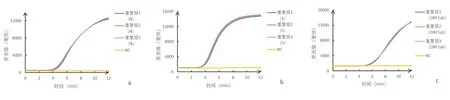
a:SARS-CoV-2 N; b:SARS-CoV-2S; c:ORF1ab

a:SARS-CoV-2 N; b:SARS-CoV-2S; c:ORF1ab
3 讨 论
COVID-19疫情的暴发已在全球造成严重的公共卫生危机[15],最初,SARS-CoV-2是通过传统的聚合酶链反应试验和测序确定的。随后,SARS-CoV-2 RT-PCR法迅速建立,并在国内外广泛应用[16-20]。但对于现场快速检测和基层条件匮乏地区来说,缺乏足够的专业操作人员和特殊的仪器设备。本实验所开发的荧光RT-RAA法和RT-RAA-LFD法均在39 ℃恒温条件下12 min内完成,与其他方法相比,大大节省了检测时间。此外,荧光RT-RAA检测系统和RT-RAA-LFD检测系统均不需要复杂的实验室设置、熟练的人员和昂贵的设备,可以使用便携式设备。这对及时准确诊断 SARS-CoV-2感染非常有帮助,特别是实验室环境之外的海关、机场和基层医院等情况。这种方法有可能减少获得可靠结果所需的时间,有助于早期识别 SARS-CoV-2感染患者,也有助于有效使用疫情防控物资,更好地制定有效的检疫措施,并帮助临床试验的治疗。
本研究基于RAA技术设计了RT-RAA荧光法和RT-RAA-LFD法的特异引物和探针,优化反应体系,两种RT-RAA 检测法具有快速、灵敏、操作简便的特点,荧光RT-RAA法仅需要一台小型便携的荧光扩增仪即可完成检测,可适用于现场快速检测,尤其在海关、机场及基层偏远地区。在条件不允许的的情况下我们也可以使用RT-RAA-LFD法,由于可视化方法要借助试纸条,所以灵敏性不如荧光检测,但该方法无需特殊仪器即可完成检测,对条件受限地区SARS-CoV-2的检测有重要意义,具有较好的发展前景。世界卫生组织网站上也提供了一些引物和探针供参考。目前尚无文献系统地比较了以往报道的引物和探针之间的优先性[21],目前已证实ORF1ab、N和S基因引物比其他引物具有更高的敏感性、特异性和阳性预测值[21-22]。本研究建立的两种方法具有良好的灵敏性和特异性,与前述研究结论相同。
同时,本研究也具有一定的不足,首先,本实验使用的为合成的质粒做模板,并没有使用临床样本做模板,在后续的实验中我们需要继续收集临床样本,验证实验的灵敏性、特异性和重复性;其次,针对RT-RAA-LFD法,由于需要打开试验管进行操作,具有污染的可能性,目前我们采用试剂配制和反应在不同房间,并在试验后用核酸清除剂处理,最大限度减少核酸污染情况。

