髓过氧化物酶在临床心血管疾病中的意义和研究展望
李 欢冯 磊方绕红李海龙白 梅
(1、云南省滇南中心医院(红河州第一人民医院),云南 蒙自 661100;2、昆明医科大学第六附属医院,云南 玉溪 653100)
近年,中国心血管疾病危险因素流行趋势明显,心血管疾病患病率处于持续上升阶段。据测算心血管疾病现患病人数近3.30亿,每年约350万人死于心血管疾病,心血管疾病已经成为我国居民健康的首要威胁[1]。髓过氧化物酶(myeloperoxidase,MPO)是一种含血红素的过氧化物酶,存在于髓系细胞的嗜苯胺蓝颗粒中,是髓细胞的特异性标志,是血红素细胞过氧化物酶超家族成员之一[2]。研究表明MPO与心血管疾病(CVD)之间存在关联,包括冠心病、充血性心力衰竭、动脉高压、肺动脉高压、外周动脉疾病、心肌缺血、再灌注相关损伤、中风、心律失常和静脉血栓形成[3]。在心血管疾病的发生发展中,从内皮功能障碍的早期发展到斑块的形成和破裂,MPO氧化应激和炎症反应贯穿了整个过程,MPO催化的反应对潜在的动脉粥样硬化前期有生物活性,MPO催化产生许多反应氧化物及激活物,这些产物能促使脂质过氧化及对靶蛋白产生大量的翻译后修饰作用,包括氯化、硝基化及氧化交联,在动脉粥样硬化及其并发症中发挥重要的作用,与内皮功能障碍、脂质代谢、NO消耗、斑块破裂、MMP的激活、血栓形成都存在广泛的联系[4]。因此,MPO是这些常见疾病中炎症和氧化应激生物标志物的最佳诊断工具之一,MPO可作为一个独立且意义重大的心血管疾病监测指标。
1 MPO的结构和生物学作用
1.1 MPO的结构
MPO是含亚铁的血红素蛋白酶,约占外周多形核白细胞(PMN)内总蛋白质含量的5%,血液中95%的MPO来源于PMN。成熟的MPO是由两个亚基聚合而成的二聚体蛋白质,相对分子质量为150000,每个亚基又由一条重链(α链,相对分子质量为60000)和一条轻链(β链,相对分子质量为15000)构成,2个亚基在α链处由1个二硫键连接[5]。
1.2 MPO的生物学作用
1.2.1 卤化循环 MPO通过产生的氧化剂促进微生物消除,次卤酸(如次氯酸、次溴酸)是吞噬细胞杀菌活性的主要氧化剂[6]。MPO的天然三价铁血红素与H2O2反应,通过双电子氧化反应生成反应性中间体化合物Ⅰ(·+Por-Fe4+=OH),该化合物具有高氧化态,可催化卤化物和假卤化物离子(Cl-、Br-、SCN-)转化为次卤酸(HOCl、HOBr)和次硫氰酸(HOSCN),并通过双电子还原将化合物Ⅰ还原为天然状态[7]。这个反应过程构成了卤化循环(天然酶—化合物Ⅰ—天然酶),Cl-是血浆中卤化循环最丰富的底物,因此HOCl是卤化循环中形成的主要物质,HOCl具有高反应性,参与许多生物靶标的氧化和氯化。HOBr产生量约占卤化循环过程中消耗的H2O2的25%。
1.2.2 过氧化物酶循环 化合物Ⅰ通过单电子反应生成化合物II(·+Por-Fe4+-OH)和自由基,然后在第二个单电子还原反应中将化合物II还原回其天然状态。同时,化合物Ⅲ(Por-Fe3+-O2·-)通过Fe3+与O2·-反应生成,或通过单电子还原成亚铁并随后与O2反应生成化合物Ⅲ。由于过氧化物酶循环而形成的一种自由基物质是二氧化氮(NO2),它是NO2-氧化的产物。NO2是一种高度不稳定的分子,可促进蛋白质硝化和脂质过氧化[8]。MPO衍生的氧化剂(如HOCL和NO2-)修饰可以改变蛋白质的活性,从而整体细胞功能。MPO的催化循环过程见图1[5]。
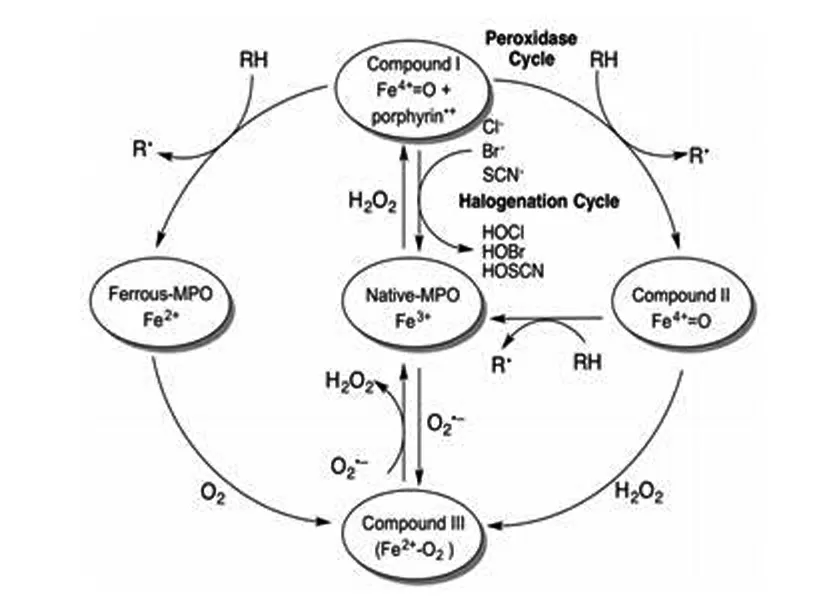
图1 MPO的催化循环过程
2 MPO在心血管疾病中的作用和机制
2.1 促进内皮功能障碍
MPO催化消耗一氧化氮(NO)并抑制其生物活性,导致内皮功能障碍。MPO主要通过MPO形成的活性物质消耗和中断内源性NO合成两种途径破坏NO代谢。MPO及其产物通过多种方式破坏NO形成或生物利用度[5]:(1)HOCL氯化精氨酸(内皮型NO酶的底物),限制精氨酸的生物利用度并形成可以直接抑制内皮型NO酶的氯化精氨酸;(2)HOCL直接氧化eNOS(内皮型NO酶),导致合成酶的单体化和解偶联;(3)MPO/H2O2/N2O-系统修饰脂蛋白导致eNOS从内皮细胞的质膜上解离并降低eNOS的表达。
2.2 氧化修饰低密度蛋白质(LDL)
LDL的氧化修饰参与了动脉粥样硬化的形成,是动脉粥样硬化的重要因素之一。MPO衍生的HOCL可以通过靶向载脂蛋白B-100上的赖氨酸残基来氧化LDL,它是LDL的最主要成分,它使LDL更容易被巨噬细胞上的清道夫受体识别,导致在动脉粥样硬化斑块的脂质核心内形成巨噬细胞泡沫细胞动脉粥样硬化斑块[9]。MPO产生的活性氮物质也能够修饰低密度脂蛋白以形成NO2LDL,这是巨噬细胞可以摄取的另外一种致动脉粥样硬化的LDL。此外,由MPO衍生的氰酸盐对LDL上赖氨酸残基的氨基甲酰化也有助于泡沫细胞的形成和动脉粥样硬化。
2.3 选择修饰高密度蛋白(HDL)
MPO还能够修饰高密度脂蛋白(HDL),这是唯一一种通过将外周胆固醇转运回肝脏来提供动脉粥样硬化保护作用的脂蛋白。这也被称为巨噬细胞的胆固醇逆向转运,通过ATP结合盒转运体A1(ABCA1)、G1(ABCG1)和载脂蛋白A1(载脂蛋白A-1)之间的相互作用[10]。MPO与螺旋8结合并在酪氨酸残基处氧化APO-A1,导致巨噬细胞中ABCA1依赖性胆固醇流出受损。MPO还可以氧化对氧磷酶1(一种与APO-A1结合的HDL相关抗氧化蛋白),导致HDL的动脉粥样硬化保护特性降低[11]。此外,MPO产生的HOCl通过巨噬细胞上的清道夫受体与天然HDL竞争脂质摄取,最终导致HDL功能失调。
2.4 促进内皮细胞凋亡和血栓的形成
在斑块不稳定或破裂情况下,MPO和MPO衍生氧化剂在促进动脉粥样硬化斑块不稳定性中的潜在作用。单核细胞/巨噬细胞释放的MPO中性粒细胞可以激活MMPs并抑制TIMPs,导致ECM的减少,尤其是在纤维帽中。此外,MPO可能通过诱导内皮细胞释放组织因子和引发血小板来促进血栓形成环境聚合。最后,MPO可以增加内皮细胞(EC)的通透性和凋亡,从而增加血管的渗漏内皮细胞。
2.5 基 质MMP的激活
纤维帽的厚度是动脉粥样硬化斑块相对稳定性的关键决定因素。MPO可能通过激活MMP并使其抑制剂失活导致斑块不稳定,从而导致纤维帽基质的降解。人中性粒细胞的激活可导致MPO和活性MMP-9的同时释放,表明MPO可能会在脱粒时激活MMP。事实上,低浓度的HOCl在体外通过氧化MMP半胱氨酸开关域的硫醇部分直接激活MMP-7,此外,MPO产生的氧化剂可以使金属蛋白酶-1的组织抑制剂失活,否则会抵消MMP的作用,从而整体削弱ECM。
2.6 MPO与动脉粥样硬化斑块的减弱
动脉粥样硬化斑块的脆弱性取决于覆盖由泡沫细胞产生的脂质核心的纤维帽的完整性[12]。MPO可以通过MPO衍生的HOCl通过抑制Bcl-2和促进内皮细胞内细胞色素C的表达参与内皮细胞的凋亡、MPO和HOCl激活基质金属蛋白酶(MMP)、与一些细胞外基质结构蛋白结合并由次氯酸氧化降低血管平滑肌细胞粘附三种主要机制减少纤维帽的厚度[9]。另外,MPO与动脉粥样硬化斑块减弱有关。首先,HOCl已被证明可以抑制一种酶的同种型,该酶可以抵消基质金属蛋白酶的组织抑制剂金属蛋白酶-1,通过氧化N端的半胱氨酸残基,导致无对抗MMPs,进一步削弱纤维帽,并促进随后的斑块破裂。其次,氧化的低密度脂蛋白和氧化应激也能够通过引起内质网应激来削弱动脉粥样硬化斑块,随后诱导坏死核心内的巨噬细胞凋亡,导致更脆弱的斑块。
2.7 MPO与冠状动脉痉挛
MPO直接催化消耗NO,导致冠状动脉痉挛,引起心肌缺血、心绞痛甚至心肌梗死的发生。MPO将NO氧化为氮氧化物,加快氧化损伤和LDL的氧化转变速率,最终导致动脉粥样硬化。
2.8 促进心肌功能紊乱和心肌梗死后异常心室重塑
纤维帽破裂、管腔阻塞之后的病理过程中,炎症仍起着主要的作用,白细胞迁移至坏死部位周围,闭塞动脉再灌注,促进炎症和氧分压增加,MPO促进心室逆向重塑。
3 MPO在心血管疾病中的临床意义
3.1 MPO是ACS患者心血管不良事件(MACE)独立预测因子
Baldus等[13]研究了1090例ACS患者血清MPO水平与随访6个月内发生死亡事件的关系。结果显示MPO水平与肌钙蛋白cTnT、可溶性CD40配体、C反应蛋白水平、ST段变化无关,但是MPO水平升高,患者的MACE的发生率明显升高(OR=2.25)。Brennan等[14]评估了604名胸痛患者MPO浓度水平与MACE发生风险关系,在对患者入院时和入院后16h内(0、4、8、16h)进行MPO和cTnI浓度水平检测,在30d和6个月的随访中发现,当cTnI检测值处于正常参考范围内,6个月内发生MACE的患者有44.4%被漏诊。但当MPO处于正常参考范围内,发生MACE的漏诊率只有9.3%。另外,Kaya等[15]研究发现73名ST抬高型心肌梗死(STEMI)患者的血浆MPO水平明显高于46名年龄和性别相匹配的健康对照组(82±34 v s 20±12ng/mL;P=0.001),复合性心血管不良事件(MACE)在高MPO水平患者中发生概率(33%)是低MPO水平患者中发生概率(11%)的3倍。而且,在多变量分析中,血浆MPO水平是MACE的独立预测因子(OR=3.843,95%CI:1.625-6.563,P=0.003)。综上所述,MPO是ACS患者心血管不良事件(MACE)独立预测因子。
3.2 MPO可提高急性冠脉综合征(ACS)的早期诊断率
Sawichi等[16]开展的ACS患者对照研究结果显示,非ACS受试者的MPO和cTnI值均显著低于ACS患者。特别是以97.5%为分界点,不稳定型心绞痛患者和非ACS受试者的MPO明显优于cTnI,入院时肌钙蛋白阴性的ACS患者在6小时后变为肌钙蛋白阳性,并显示出明显更高的MPO浓度。说明MPO极有力于ACS的早期诊断,尤其是提高肌钙蛋白阴性的ACS患者诊断率。
3.3 MPO预测健康人群未来心血管疾病风险
Meuwese等[17]在EPIC(欧洲癌症和营养前瞻性调查)-诺福克前瞻性人群研究中评估了MPO水平与健康个体未来冠心病风险的关系。结果显示MPO病例组受试者血清C反应蛋白(CRP)水平显著高于对照组受试者,并且与C反应蛋白(CRP)和白细胞计数相关。在MPO浓度的连续四分位数中,未来CAD的风险增加,最高四分位数与最低四分位数的比值比1.49(95%C I:1.20-1.84,P<0.001)。在调整了风险因素后,前四分位数的O R仍为1.36(95%CI:1.07-1.73)。在低密度脂蛋白(LDL)<130mg/dL、高密度脂蛋白(HDL)>50mg/dL或C反应蛋白(CRP)<2.0mg/dL的受试者中,MPO水平升高(>728pmol/L)同样能够预测到冠心病患者的风险增加(O R值分别为1.52(95%C I:1.2-1.91)、1.59(95%C I:1.24-2.05)和1.42(95%CI:1.14-1.77))。这说明血清MPO水平与健康的个体中CAD未来发展的风险相关,MPO可以预测健康人群未来心血管疾病风险。
3.4 MPO可作为心力衰竭的独立风险指标
MPO与心力衰竭(HF)的死亡率、疾病进展和严重程度相关。Tang等[18]检测了105例正常对照者和102例慢性收缩性心衰患者(HF)的MPO和血浆B型利钠肽水平,结果显示,与正常对照组相比,MPO水平与HF的患病率密切相关。并且,MPO作为一个独立的风险评估指标可以很好地评价急性心力衰竭的1年死亡率,尤其是在BNP不能很好地反映机体真实状态的情况下。
3.5 MPO预测心血管疾病死亡率
Heslop等[19]对885例CAD患者进行了13年随访发现,与最低三分位MPO水平患者相比,最高三分位MPO水平预测心血管死亡率的风险为2.4倍(95%CI:1.47-2.98)。另外,评估了MPO和C-反应蛋白(CRP)对心血管疾病的风险,MPO或CRP升高的患者心血管死亡风险高出5.3倍(95%CI:1.86-14.9),MPO和CRP均升高的患者比单独升高的患者相比风险高出4.3倍(95%C I:2.26-8.31),在调整心血管危险因素和疾病负担后,这些结果仍然显著。表明MPO可以预测冠心病患者的心血管疾病死亡风险。
3.6 MPO-463G/A基因多态性与冠状动脉疾病
人类MPO基因由12个外显子和11个内含子组成,位于染色体的17q23-q24。人类可以存在G/G、A/A、A/G三种基因型。一项荟萃分析结果表明[20]:MPO基因-463G/A多态性与CAD风险相关,特别是GG基因型的患者无论是心血管疾病的发生风险还是不良事件的发生均明显高于AA或GA型的患者。多因素分析显示,GG基因型是CAD患者发生心血管意外的强预测因子,AA基因型可降低终末期肾脏疾病患者发生CAD的危险,MPO基因-463G/A变异可降低对CAD的易感性。尤其是在中国人口中。MPO基因-463G/A多态性的A等位基因可能保护人们免受CAD风险。
3 总结与展望
综上所述,MPO心血管疾病之间存在密切联系,MPO作为一种新的炎症标志物,在心血管疾病的诊断和评估中具有重要意义。目前国内外大量关于MPO的研究还处于实验室阶段,MPO可用数据相对较少,并且涉及MPO的研究都使用了不同的方法,还需要更多的研究来建立标准和规范。MPO的检测方法主要包括连续监测法、酶联免疫吸附法(ELISA)和流式细胞仪测定法。连续监测法虽然具有快速、灵敏、成本低特点,但易受其他过氧化物酶和一些血红素蛋白的干扰;ELISA灵敏度、特异度均较高,几乎不受体液和激活剂、抑制剂的影响,也不受过氧化物酶和血红素蛋白的干扰,但是该方法需要制备高效价抗体,成本较高,并且测定时间长,仅限于科学研究;流式细胞仪测定法特异性强、灵敏度高,但技术复杂,需要使用特殊仪器。因此,受检测方法的限制,MPO检测方法还无法实现临床应用,即MPO目前还无法作为一个急诊项目。但随着分子生物学领域的不断发展,对MPO的作用机制研究将不断深入,其在冠心病的诊断、预后等方面的作用也将日益突出。

