无创呼吸机联合纳洛酮治疗老年COPD 并发呼吸衰竭的临床观察
张惠兰
(江西省九江市第一人民医院全科医学科 九江 332000)
多项研究证实,慢性阻塞性肺疾病(COPD)特点为气道持续性受限,且不完全可逆,在疾病过程中伴随着气道高反应性,对患者的生命健康构成巨大威胁[1~3]。目前研究显示,COPD 患者呼气功能受严重影响,导致血液中二氧化碳分压长期处于高水平且氧分压处于低水平,易产生高碳酸血症,导致肺泡持续性通气障碍,进而引发呼吸衰竭[4]。数据显示COPD 急性加重期患者发生呼吸衰竭风险大大增加,易出现中枢神经系统、循环系统的损伤,随着呼吸衰竭的进展,晚期患者可出现电解质紊乱及呼吸性酸中毒[5]。目前对于COPD 合并呼吸衰竭的治疗以改善呼吸质量、恢复患者水与电解质平衡为主。既往主要采用气管插管或气管切开改善COPD 合并呼吸衰竭患者的通气状态。无创呼吸技术因具有操作简便、无创且安全性高等特点,在呼吸支持方面应用广泛。随着相关研究的不断深入,目前发现在COPD 合并呼吸衰竭患者中,无创通气需要一定强度的自主呼吸才可触发[6]。部分呼吸衰竭引发水电解质紊乱患者,呼吸中枢出现一定程度抑制。相关研究显示,纳洛酮具有增加呼吸中枢敏感性,拮抗呼吸抑制的作用,同时具有一定神经保护作用。本研究探讨无创呼吸机联合纳洛酮治疗老年COPD 并发呼吸衰竭的临床疗效。现报道如下:
1 资料与方法
1.1 一般资料 选取我院2019 年12 月至2020 年12 月收治的老年COPD 并发呼吸衰竭患者79 例,根据患者就诊顺序进行编号。编号为单数的40 例为观察组,编号为双数的39 例为对照组。对照组男25例,女14 例;年龄65~81 岁,平均(68.3±2.8)岁;COPD 病程1~7 年,平均(3.72±0.51)年;吸烟指数(421.54±84.36);平均体质量指数(BMI)(21.14±2.54)kg/m2。观察组男27 例,女13 例;年龄66~82岁,平均(68.5±2.6)岁;病程1~7 年,平均(3.56±0.43)年;吸烟指数(435.25±95.64),BMI(21.09±1.98)kg/m2。两组一般资料比较,差异无统计学意义(P>0.05)。
1.2 纳入与排除标准 纳入标准:参考《慢性阻塞性肺疾病诊治指南(2021 年修订版)》[7]中相关标准明确诊断为COPD;参考世界卫生组织制定的有关标准,明确诊断为呼吸衰竭;满足无创呼吸机使用指征;患者及其家属对研究内容知情,签署知情同意书。排除标准:合并肺癌、哮喘等其他可导致呼吸道受限的慢性疾病者;入组前1 个月服用过镇静类药物、糖皮质激素、抗生素者;合并精神病史者,或经评估无法配合本研究者。
1.3 治疗方法 所有患者给予抗感染、解痉平喘、吸痰、扩张支气管及呼吸兴奋药治疗,纠正水、电解质及酸碱平衡。在此基础上,对照组患者给予BiPAP无创正压通气治疗(A30 型,飞利浦生产),设置为S/T 模式。根据患者病情设置呼吸机各项参数,呼气压4~6 cm H2O,吸气压10~20 cm H2O,氧气流量5~7 L/min,氧浓度35%~45%,3~5 h/次,3 次/d。根据患者病情调整通气次数、时间至完全脱机。观察组在对照组基础上加用纳洛酮(国药准字H20053316)治疗。2 mg 纳洛酮与100 ml 生理盐水混合,静脉滴注,1 次/d,用药3 d 后降低药物用量至1 mg,连续治疗7 d。
1.4 观察指标 (1)比较两组治疗前后血气指标,包括动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)、血氧饱和度(SpO2),在进入ICU 时及撤机前抽取患者外周动脉血5 ml,采用血气分析仪(丹麦雷度公司生产,型号:ABL80)检测上述指标,由专人进行检测。(2)比较两组治疗前后脑特异性蛋白(S100β)及神经元特异性烯醇化酶(NSE)表达水平。在治疗前1 d 及治疗完成后次日抽取外周静脉血液5 ml,静止离心后取上清液,采用ELISA 法检测NSE、S100β 蛋白水平。试剂盒购自上海乔羽生物科技有限公司公司,所有操作按照说明书进行。(3)比较两组治疗前后致炎因子水平。治疗前1 d 及治疗完成后次日抽取外周静脉血液5 ml,静止离心后取上清液,采用ELISA 法检测肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、C 反应蛋白(CRP)水平。试剂盒购自上海乔羽生物科技有限公司,所有操作按照说明书进行。
1.5 统计学方法 采用SPSS19.0 软件处理数据。计数资料以%表示,行χ2检验;计量资料以(±s)表示,行t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组血气指标比较 治疗前,两组血气指标比较无明显差异(P>0.05);治疗后观察组PaO2、SpO2均高于对照组,PaCO2低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组血气指标比较(±s)
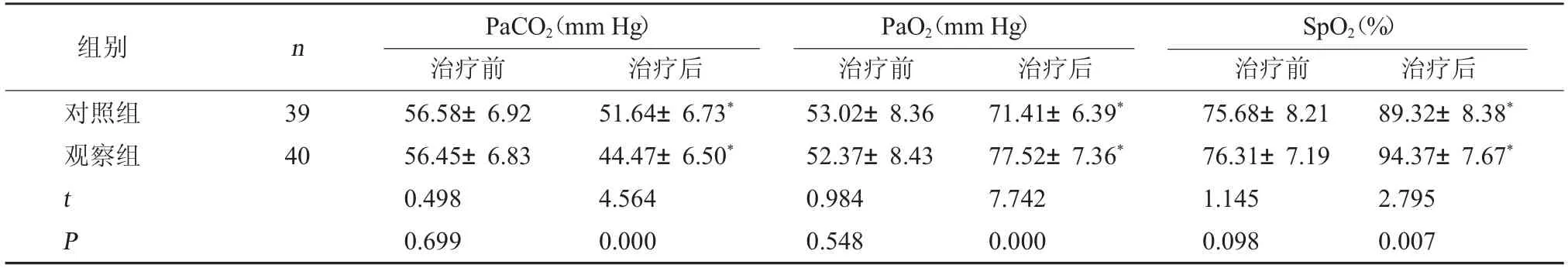
表1 两组血气指标比较(±s)
注:与本组治疗前比较,*P<0.05。
SpO2(%)治疗前 治疗后对照组观察组组别 n PaCO2(mm Hg)治疗前 治疗后PaO2(mm Hg)治疗前 治疗后39 40 t P 56.58±6.92 56.45±6.83 0.498 0.699 51.64±6.73*44.47±6.50*4.564 0.000 53.02±8.36 52.37±8.43 0.984 0.548 71.41±6.39*77.52±7.36*7.742 0.000 75.68±8.21 76.31±7.19 1.145 0.098 89.32±8.38*94.37±7.67*2.795 0.007
2.2 两组NSE、S100β 水平比较 治疗前,两组NSE、S100β 水平比较无明显差异(P>0.05);治疗后观察组S100β、NSE 水平均低于对照组,差异具有统计学意义(P<0.05)。见表2。
表2 两组NSE、S100β 水平比较(±s)
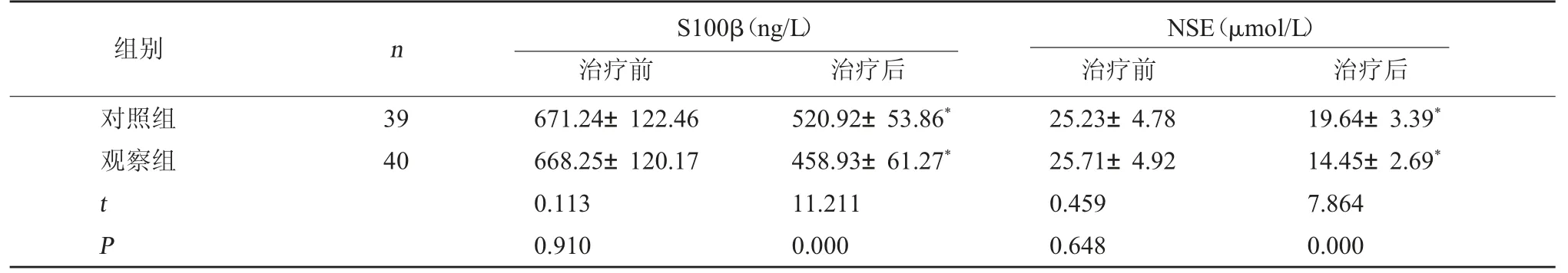
表2 两组NSE、S100β 水平比较(±s)
注:与本组治疗前比较,*P<0.05。
NSE(μmol/L)治疗前 治疗后对照组观察组组别 n S100β(ng/L)治疗前 治疗后39 40 t P 671.24±122.46 668.25±120.17 0.113 0.910 520.92±53.86*458.93±61.27*11.211 0.000 25.23±4.78 25.71±4.92 0.459 0.648 19.64±3.39*14.45±2.69*7.864 0.000
2.3 两组致炎因子水平比较 治疗前,致炎因子水平比较无明显差异(P>0.05);治疗后观察组IL-6、CRP 及TNF-α 水平均低于对照组,差异具有统计学意义(P<0.05)。见表3。
表3 两组致炎因子水平比较(±s)

表3 两组致炎因子水平比较(±s)
注:与本组治疗前比较,*P<0.05。
TNF-α(ng/L)治疗前 治疗后对照组观察组组别 n IL-6(ng/L)治疗前 治疗后CRP(mg/L)治疗前 治疗后39 40 t P 13.61±1.17 13.65±1.20 0.115 0.913 5.97±1.26*2.69±1.13*16.102 0.000 12.66±0.23 12.63±0.21 0.355 0.458 5.07±3.85*3.67±0.28*6.388 0.000 56.74±4.16 57.13±4.45 0.127 0.975 41.24±3.93*31.72±4.16*28.053 0.000
3 讨论
目前空气污染程度日益加重,COPD 的发病人数呈逐年上升趋势。COPD 患者临床表现为不完全可逆的气流受限,导致肺泡过度充气,加重患者呼气及吸气负担,引起呼吸相关肌群长期处于疲劳状态。相关研究证实,COPD 常伴随气道高反应性,纤毛功能下降,导致呼吸道病原体清除能力下降,易引发呼吸道感染[8]。目前研究显示,COPD 患者易出现营养不良、二氧化碳潴留、反复肺部感染等情况,对患者生命健康构成威胁[9]。呼吸衰竭是COPD 常见合并症状,随着病情进展,呼吸相关肌群高度疲劳,肺泡过度充气压迫肺组织毛细血管,导致血氧饱和度下降及高二氧化碳血症,患者可出现呼吸衰竭及其相关症状。数据显示,COPD 合并呼吸衰竭患者死亡率达15%[10]。呼吸机支持治疗是COPD 合并呼吸衰竭患者重要的治疗手段,可显著改善患者血氧饱和度[11]。但随之出现的呼吸机相关肺炎、呼吸道堵塞、自主呼吸能力下降等对患者的治疗效果产生较大影响。此外部分患者由于气管插管对气道的压迫,引起气道损伤。无创正压通气的出现一定程度上降低了呼吸支持患者呼吸机相关肺炎的发生率,且具有操作安全、患者接受度高等特点,仅通过面罩正压通气,使患者保留较好的呼吸道防御功能,对吞咽功能影响较小。
有研究报道,无创正压通气过程中呼气时,呼吸机提供较低的呼吸末压力,对抗患者体内的内源性正压,一定程度上防止肺泡萎缩及气道阻塞,此外在吸气时根据患者具体情况提供不同的辅助正压,使患者克服气道阻力,降低呼吸肌耗氧量[12]。部分研究显示,在COPD 合并呼吸衰竭患者中,部分症状严重者存在意识障碍,且呼吸衰竭可导致患者较为严重缺氧,其脑组织内合成及释放大量的β 内啡肽,与中枢神经中的δ 及μ 受体结合,产生明显的中枢抑制作用[13]。部分研究证实,脑组织在缺氧状态下可释放大量的氧自由基,对神经元细胞产生损伤,加重患者病情[14]。NSE 在神经系统中具有较高的含量,在人脑皮层烯醇化酶约占40%~65%,患者的大量神经元细胞遭受损伤,导致NSE 被释放至细胞外且经受损的血脑屏障进入血循环,从而使血清中NSE 含量升高,故NSE 可作为反映脑颅损伤程度的指标[15]。S100β 蛋白由活化的神经胶质细胞分泌,参与机体学习记忆等多种生理活动,也可作为评估神经功能损害的标志物之一,其浓度与机体注意力、反应力、记忆力等精神行为的损害程度密切相关。机体创伤程度与炎性细胞因子水平变化有着密切关系,当机体受到应激时,外周血IL-6 水平可急剧上升,进一步诱导肝脏合成CRP 增加[16]。TNF-α 则用于评价机体中细胞因子分泌状况[17],是机体创伤的较为敏感的标志物。COPD 患者气道处慢性非特异性炎症状态,可导致上述因子水平表达异常,是引起肺组织损伤的重要原因。本研究中采用无创呼吸机联合纳洛酮治疗COPD 合并呼吸衰竭,结果显示治疗后观察组PaO2、SpO2均高于对照组,PaCO2低于对照组,观察组S100β、NSE 水平低于对照组(P<0.05)。分析原因为,纳洛酮是目前常用的阿片类受体拮抗剂,其进入人体后可迅速透过血脑屏障,结合神经中枢中的阿片类受体[18],抑制机体中β 内啡肽的生理作用,达到兴奋患者呼吸中枢的目的,进而促进患者自主呼吸。此外还有研究显示[19],纳洛酮可显著改善患者脑组织的血流灌注,同时增加心率,发挥降低血清中致炎因子及氧自由基表达水平的作用。治疗后观察组IL-6、CRP、TNF-α 水平均低于对照组,差异具有统计学意义(P<0.05)。提示无创呼吸机联合纳洛酮能降低老年COPD 合并呼吸衰竭患者致炎因子表达水平,与目前文献[20]报道结果一致。
综上所述,无创呼吸机联合纳洛酮能改善老年COPD 合并呼吸衰竭患者的血气指标,降低S100β、NSE 表达水平,改善患者机体炎症反应程度。

