以ZIF-8为模板的Cu-Zn@C制备与吸附性能
朱玉琦,陈凯伟,张佳莉,陈九玉,杨 毅
(1. 南京理工大学 环境与生物工程学院,江苏 南京 210094; 2. 常州大学 石油工程学院,江苏 常州 213164)
随着人类活动的扩大和核工业的蓬勃发展,核污染问题受到广泛的持续关注。其中放射性碘作为我国核工业早期对环境造成污染的一个关键原因和核素,对人类的身体健康有较大的威胁,所以受到学者的较多关注。同时放射性碘在生物实验、疾病治疗,特别是甲状腺癌的治疗中也会产生大量放射性碘污染废物,在某种程度上加剧了放射性碘对地球环境的污染程度,因此有效处置和储存放射性碘对公共安全至关重要[1]。
一般来说,碘主要存在于放射性废水中,如碘离子。目前,能够用于碘离子去除的方法主要有共沉淀法、吸附法、催化氧化法和离子交换法等。相比较而言,吸附法由于具有工艺简单、能耗低、清洁等优点,因此被认为是处理水体中放射性碘离子强有力的方法。目前各种吸附材料已经广泛用于碘离子的去除,比如碳基材料、双层氢氧化物、离子交换树脂等。由于这些材料缺少碘离子的结合位点,因此使得碘离子不能被高效且有选择性地去除。
铜基功能材料具有价格低、毒性小等特点,有望成为未来大规模应用的候选材料。此外Cu+与I-可以形成热力学稳定的CuI,使得铜对碘离子的吸附具有一定的优势,然而Cu2O单独存在时,容易被氧化成CuO,从而减弱了对I-的强化学吸引力。单质铜是可以产生活性自由基的金属,在酸性条件下会生成Cu+,理论上对I-有较强的吸附能力[2]。
金属-有机骨架材料(metal-organic frameworks, MOFs),具有超大的比表面积、较高且可调的孔隙率、普通化学方法可修饰等突出优点[3-4],其结构模式有特殊的孔道结构特征,超越了传统多孔材料组成的孔隙,在众多领域有很广阔的应用前景[5]。金属-有机骨架材料可以应用于放射性核素的吸附,具体的性能可以根据今后具体需要来研究[6],并且在氮气气氛下,通过高温碳化会使多孔碳材料在金属原位点直接负载上单质金属。合成方法简单,孔隙均匀分布,金属负载率较传统方法高。
鉴于此,本文中通过高温碳化Cu-Zn ZIFs(类沸石咪唑骨架材料)得到Cu-Zn@C复合材料,利用SEM、XRD等测试手段对合成的材料进行了表征,研究Cu-Zn@C复合材料对碘离子的去除性能。
1 实验
1.1 主要试剂和仪器设备
试剂材料:硝酸铜(Cu(NO3)2·3H2O)、硝酸锌(Zn(NO3)2·6H2O)、无水碳酸钠(Na2CO3)、氢氧化钠(NaOH)(均为分析纯,成都市科隆化学品有限公司);十六烷基三甲基溴化铵(CTAB,分析纯,南京化学试剂股份有限公司);2-甲基咪唑、氯化钠(NaCl)、碘化纳(NaI)(均为分析纯,阿拉丁试剂有限公司)。
仪器设备:Bruker-AXS D8 Advance型X射线衍射仪(XRD,德国Bruker公司);FEI Quanta 250F型场发射环境扫描电子显微镜(SEM,美国FEI公司)。
1.2 材料制备
1)ZIF-8的制备。方法参考文献[7],以2-甲基咪唑为配体,以Zn为金属中心,利用溶剂法合成ZIF-8。将质量为5.9 g的 Zn(NO3)2·6H2O加入到体积为200 mL的去离子水中,搅拌至完全溶解,此为溶液A。将质量为229.6 mg的CTAB加入到体积为64 mL的去离子水中,适当加热搅拌至完全溶解,此为溶液B。将质量为90.8 g的2-甲基咪唑加入到体积为1 400 mL的去离子水中,搅拌至完全溶解。保持搅拌状态,将溶液A和溶液B缓慢加入,并在室温下持续搅拌2.5 h,得到白色溶液,然后经11 000 r/min离心分离,乙醇洗涤3次,在真空干燥箱中温度为70 ℃条件下干燥7 h,研磨所得白色粉末为ZIF-8。
2)Cu@ZIF-8的制备。以2-甲基咪唑为配体,利用Cu占据部分Zn的金属中心点位,Cu与Zn的物质的量比为1∶9,运用一步法合成了Cu@ZIF-8。将质量为6.5 g的Zn(NO3)2·6H2O与0.533 g 的Cu(NO3)2·3H2O加入到体积为200 mL的去离子水中,搅拌至溶解得到蓝色溶液A;将质量为229.6 mg的CTAB加入到体积为64 mL的去离子水中,适当加热,搅拌溶解,得到溶液B;再将质量为90.8 g的二甲基咪唑加入到体积为1 400 mL的去离子水中,搅拌至完全溶解。保持搅拌状态,将溶液A和溶液B缓慢加入,并在室温下持续搅拌2.5 h,将得到的蓝色溶液经11 000 r/min离心分离,并用乙醇洗涤3次,在真空干燥箱中温度为70 ℃条件下干燥7 h,最后研磨得到蓝色粉末,即为Cu@ZIF-8。
3)Zn@C和Cu-Zn@C材料制备。根据对ZIF-8热重分析发现,当温度超过600 ℃其质量损失已基本完成,为确保样品完全碳化,将热处理温度确定为650 ℃。在N2气氛下,分别取上述制得的ZIF-8和Cu@ZIF-8,于温度为650 ℃条件下煅烧2 h,制得样品Zn@C和Cu-Zn@C。
1.3 材料表征
采用X射线衍射仪对样品的物相组成进行测试,扫描角度2θ=10°~70°。通过对样品的XRD测试得出样品的物相信息,确定是否制备成功以及是否成功负载金属。采用扫描电子显微镜对样品进行微观结构研究。
1.4 吸附测试
吸附测试中,均使用非放射性的I127来代替放射性I131,因为它们具有相同的电子构型和势能面,通常表现出相同的化学性质。吸附测试研究了样品对水体中碘离子的吸附动力学、等温吸附性、不同pH条件以及干扰离子的影响下的吸附效果,在温度为25 ℃条件下进行,其中碘的质量浓度为1 g/L,重复3次。
利用紫外分光光度计,测定样品在波长为227 nm处的吸光度,可以根据标准曲线求得溶液中碘离子的质量浓度[8]。样品对碘离子的吸附平衡容量计算公式为
qe=(ρ0-ρe)V/m,
(1)
式中:qe为吸附平衡容量,mg/g;ρ0为碘离子初始质量浓度,mg/L;ρe为碘离子平衡质量浓度,mg/L;V为碘离子溶液体积,L;m为吸附剂质量,g。
2 结果与讨论
2.1 形貌与结构表征
图1所示为ZIF-8及Cu@ZIF-8碳化前后的SEM图像。从图1(a)、(c)可以看出,ZIF-8和Cu@ZIF-8均为正立方体形貌,铜的掺杂对ZIF-8结构没有明显影响,并且颗粒尺寸集中在110~130 nm范围内。

(a)ZIF-8(b)Zn@C(c)Cu@ZIF-8(d)Cu-Zn@C图1 ZIF-8及其掺杂铜与碳化前后样品的SEM图像Fig.1 SEMimagesofZIF-8anditsderivedsamples
通过SEM-EDS对Zn@C和Cu-Zn@C所含元素进行了测试。Zn@C和Cu-Zn@C主要含有C、N、O等元素。计算得出了样品中各元素的质量分数,结果列于表1。对于Zn@C,样品中含有大量的C、N元素和少量的O、Zn元素。Cu引入后,除含有上述元素外,还出现了Cu元素。
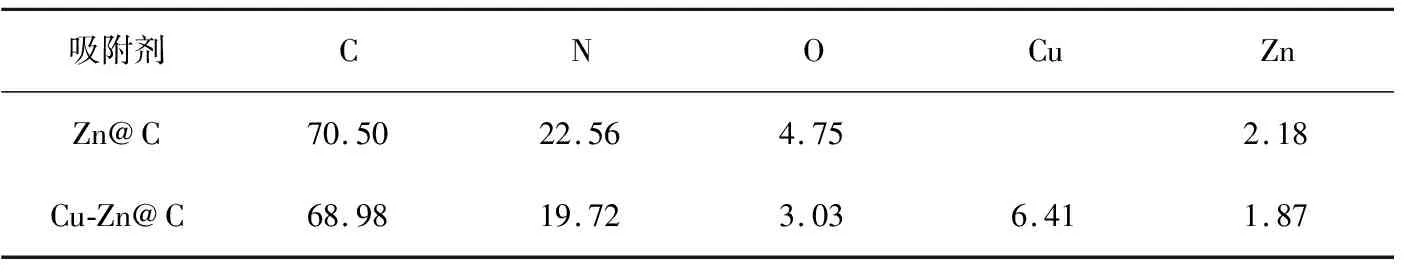
表1 Zn@C及Cu-Zn@C中元素质量分数
煅烧处理后得到的Zn@C和Cu-Zn@C基本形貌仍旧为正立方体,如图1(b)、(d),颗粒尺寸集中在90~110 nm之间。在温度为650 ℃的条件下碳化后,样品碳化成为多孔碳。有研究认为,煅烧的温度越高,颗粒的团聚越明显[9],碳化后的细颗粒聚结形成的多孔碳比表面积会显著增加,并且碳化后会出现大量的介孔[10]。不同之处在于,Cu-Zn@C由于Cu的存在和碳的气化导致表面出现了大量的微孔,高温状态下原有的ZIF-8结构发生一定的坍塌,重新聚合形成大孔。
图2所示为热处理碳化后样品孔径分布和等温吸附-脱附曲线,其中图2(a)为热处理碳化后样品Zn@C和Cu-Zn@C的孔径分布图。根据Barrett-Joyner-Halenda(BJH)分析计算,ZIF-8及Cu@ZIF-8的孔径主要分布在0~4 nm,且集中分布在2~3 nm,证实ZIF-8及Cu@ZIF-8孔结构以微孔为主。图2(b)所示为ZIF-8及Cu@ZIF-8碳化后的N2等温吸附-脱附曲线图。从图中可以看到,均呈现出IV型等温线并带有H4滞后环,表明碳化后的材料以介孔为主[10-12]。
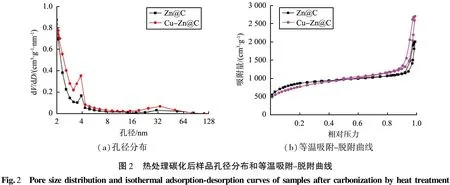
(a)孔径分布(b)等温吸附-脱附曲线图2 热处理碳化后样品孔径分布和等温吸附-脱附曲线Fig.2 Poresizedistributionandisothermaladsorption-desorptioncurvesofsamplesaftercarbonizationbyheattreatment
根据N2吸-脱附曲线,计算了ZIF-8及Cu@ZIF-8碳化前后的Brunauer-Emmett-Teller(BET)比表面积及孔体积,结果如表2所示。从表中可以看出,ZIF-8的BET比表面积为1 748.9 m2/g,比孔容为0.665 cm3/g。当Cu引入后,BET比表面积和比孔容减小。高温碳化后,Zn@C和Cu-Zn@C的BET比表面积较碳化前有明显增加,分别为2 789.0、3 074.1 m2/g。碳化过程中样品中部分组分气化,因此样品BET比表面积增大。
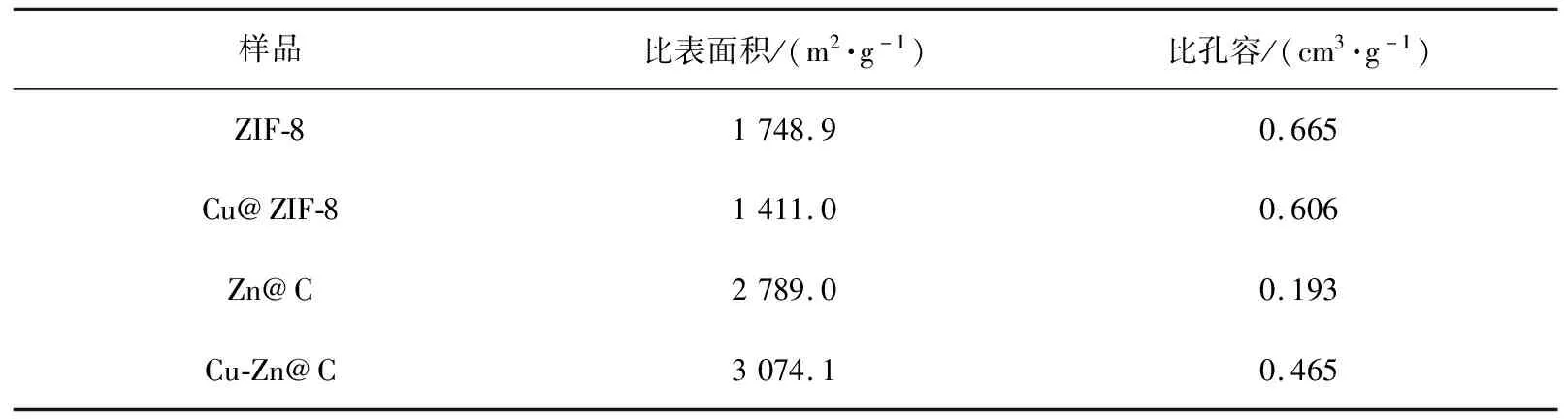
表2 ZIF-8及Cu@ZIF-8碳化前、后样品的BET比表面积及比孔容
对ZIF-8、Cu@ZIF-8碳化后的Zn@C、Cu-Zn@C样品进行了XRD测试,以探究其物相结构,结果见图3。由图3(a)可以看出,碳化后得到了新的特征峰(对比ZIF-8的衍射谱图),2θ处于43.43°、50.50°、73.12°位置的衍射峰为Cu特征峰(JCPDS-PDF#04-0836),表明Cu@ZIF-8材料碳化后Cu-Zn@C中的铜以单质形式存在。为了分析Cu-Zn@C对碘离子的吸附情况,对吸附碘离子后的Zn@C和Cu-Zn@C进行了XRD测试,结果如图3(b)。与图3(a)相对照发现,其特征峰显示铜仍以单质形式存在。
(2)
(3)
推测Cu在吸附过程中起着催化剂的作用[12],从而使Cu-Zn@C比Zn@C对碘离子的吸收性能更好,本文中后面关于吸附容量的对比研究结果也证实了此推测。
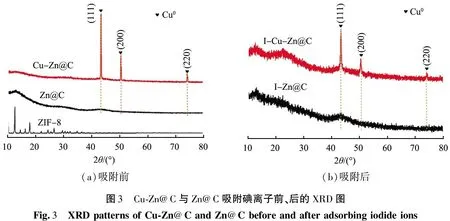
(a)吸附前(b)吸附后图3 Cu-Zn@C与Zn@C吸附碘离子前、后的XRD图Fig.3 XRDpatternsofCu-Zn@CandZn@Cbeforeandafteradsorbingiodideions
2.2 吸附性能
为了对比Zn@C和Cu-Zn@C的吸附容量,配制体积为20 mL的碘离子初始质量浓度分别为0、30、60、90、120、150、180、210 mg/L的溶液,然后将质量为20.0 mg的吸附剂加至上述溶液中,超声5 min后置于恒温摇床(温度为25 ℃)并以180 r/min的振荡速度振荡6 h。振荡结束后取一定量浑浊液经孔径为0.22 μm的滤膜过滤后,采用紫外可见分光光度计在波长为227 nm处测量滤液中碘离子的质量浓度。
图4所示为Zn@C和Cu-Zn@C材料对碘离子的等温吸附线。由图可知,随着溶液中碘离子平衡质量浓度的增加,Zn@C的吸附容量先快速增加,平衡质量浓度达到50 mg/L后吸附容量增加速度明显放缓,其最大的吸附容量为82.0 mg/g。对于Cu-Zn@C复合材料,吸附容量先快速增加,平衡质量浓度20 mg/L后增加的速度明显变缓,最大吸附容量为 95.1 mg/g。对比可知,Cu-Zn@C的吸附达到最大要比Zn@C快,吸附速率更快,最大吸附容量也比Zn@C的大。
为了进一步探究Cu-Zn@C对碘离子的吸附特性,利用图4中Cu-Zn@C对碘离子的等温吸附线数据,分别选用Langmuir和Freundlich模型进行拟合,结果如图5所示。2种模型的表达式分别见式(4)和式(5):
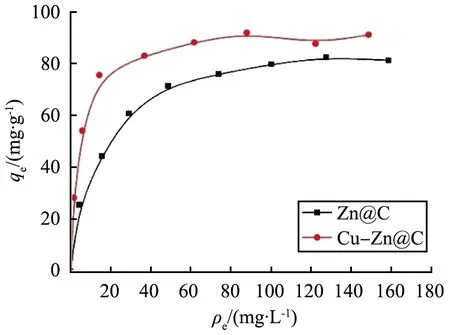
图4 Zn@C和Cu-Zn@C材料对碘离子的等温吸附线
(4)
(5)
式中:qm为理论上最大吸附容量(单层吸附),mg/g;b为Langmuir吸附常数,L/mg;Kf和n为Freundlich的特征吸附常数。
如图5(a)所示,Langmuir等温线和在测试的质量浓度范围内,其线性相关系数为0.999,线性相关性非常好,表明Cu-Zn@C对碘离子的吸附符合Langmuir吸附模型[13-14],并且理论最大吸附容量qm为90.9 mg/g,实际吸附容量符合理论值。该模型利用一个无因次量RL来描述材料的吸附强度[15],其表达式为
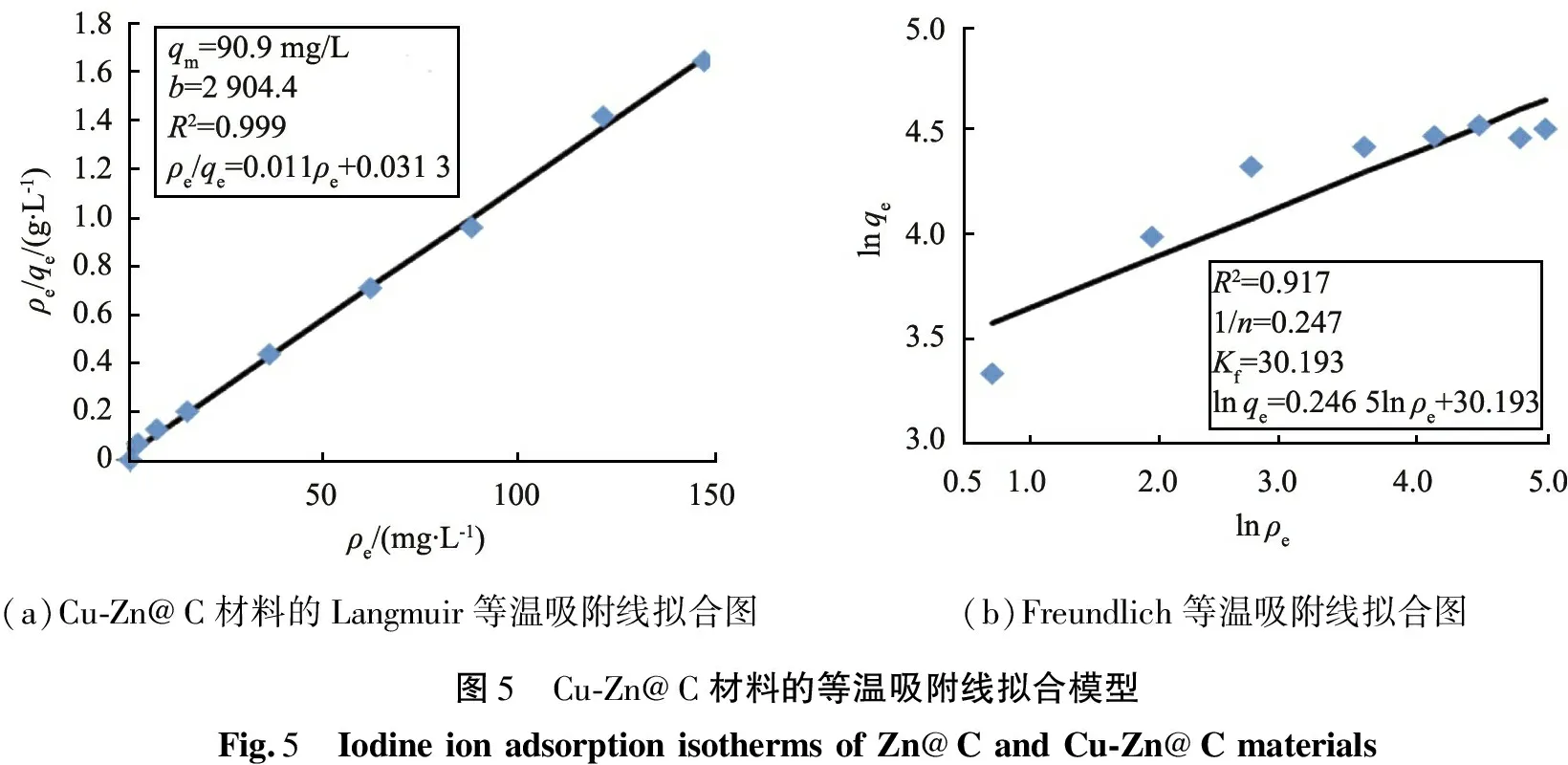
(a)Cu-Zn@C材料的Langmuir等温吸附线拟合图(b)Freundlich等温吸附线拟合图图5 Cu-Zn@C材料的等温吸附线拟合模型Fig.5 IodineionadsorptionisothermsofZn@CandCu-Zn@Cmaterials
(6)
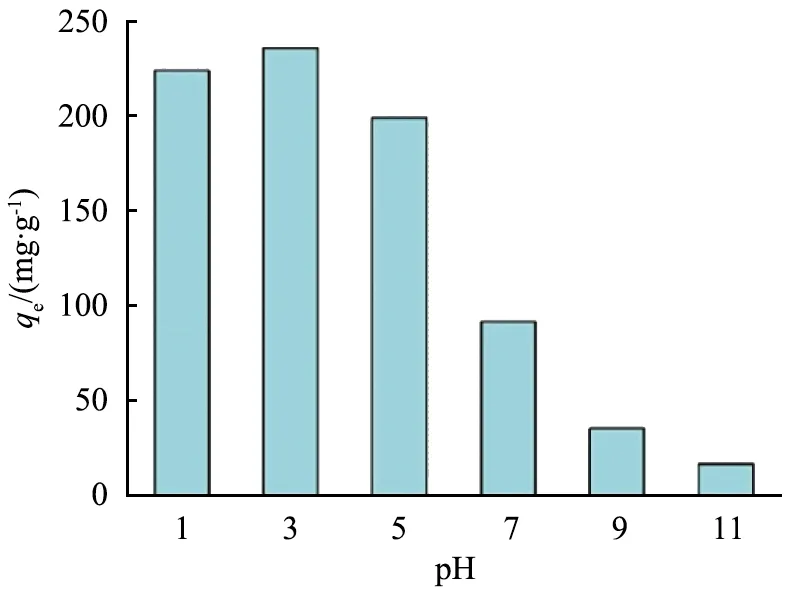
式中:ρ0为碘离子的起始质量浓度,mg/L。吸附反应正向发生的容易程度可由RL的值的大小表示:当RL<0时,几乎不发生吸附反应;当RL=0时,吸附过程不可逆;当0 为了进一步了解Cu-Zn@C的吸附动力学特性,配制体积为200 mL的含碘离子质量浓度为210 mg/L的溶液,向上述溶液中加入质量为0.2 g的吸附剂。室温下持续搅拌的过程中,每隔一定时间取样2 mL,采用孔径为0.22 μm的滤膜过滤后测定滤液中碘离子质量浓度。以横坐标为吸附时间,纵坐标为吸附容量,绘制吸附动力学曲线图,结果如图6所示。由图可知,Cu-Zn@C复合材料对碘离子的吸附在90 min时达到平衡,其平衡吸附容量达到90 mg/g。 图6 Cu-Zn@C材料对碘离子的吸附动力学曲线 为了了解Cu-Zn@C对碘离子的吸附特性,利用图7中吸附动力学曲线数据,采用假二阶方程模型进行拟合[16] (7) 式中:t为时间,s;qt为时间t时的吸附容量,mg/g;K2为假二阶方程的速率常数。 拟合得到的假二阶方程模型为[17] (8) 线性相关系数R2为0.996,表明具有良好的拟合效果;对应的理论吸附容量qe为94.4 mg/g,与试验的平衡吸附容量90 mg/g十分接近。由于假二阶方程模型通常用来描述化学吸附为主要方式的吸附过程[12],由此可知在Cu-Zn@C吸附的初始阶段吸附反应的活化能变化较大,随着吸附达到容量平衡,材料表面的活化能降低,表明此时化学吸附占主导地位。 由于酸碱性对Cu的催化效果有显著的影响[18],本文中研究了在不同pH值条件下Cu-Zn@C对碘离子吸附容量。首先,在温度为298 K条件下配制5份体积为20 mL、碘化钠质量浓度为210 mg/L的溶液,利用盐酸和氢氧化钠调节pH为1、3、5、7、9、11;然后,分别加入质量为20.0 mg的Cu-Zn@C吸附处理6 h;最后,通过分光光度法计算出在不同pH条件下的碘离子吸附容量,结果如图7所示。 图7 pH对Cu-Zn@C吸附碘离子的影响 由图可知,pH变化对Cu-Zn@C的吸附容量影响明显,当溶液为中性时吸附效率为90 mg/g。在碱性条件下,吸附效率随pH升高而减小,表明溶液碱性增强时会显著抑制吸附效率。酸性条件会显著增加吸附效率,且pH越小吸附效果越好。分析认为酸性溶液中的单质Cu容易在原位产生Cu+[19],直接生成难溶性电解质CuI;并且产生的Cu+会在溶液中迅速氧化成Cu2+[9],氧化性的Cu2+和还原性的I-之间发生氧化还原反应生成了难溶的CuI沉淀,使酸性溶液条件下的吸附容量显著增加。由于·OH和H2O的电子对的氧化电动势随pH的增大而降低[20],因此在碱性条件下Cu对I-的催化吸附作用产生负面效果。为了达到理想的吸附效果,吸附时需要控制溶液体系为酸性条件。酸性增强容易引起Cu-Zn@C样品中金属元素的流失,导致样品结构坍塌等不利影响,因此,pH为1时的吸附容量反而略低于pH为3时。 图8 干扰离子对Cu-Zn@C 吸附碘离子的影响 1)采用Cu@ZIF-8作为中间体材料,对其在N2气氛下温度为650 ℃时煅烧制得了对碘离子有吸附性能的Cu-Zn@C 的吸附材料。 2)样品吸附I127前后的XRD图对比表明铜以单质Cu形式存在。 3)Cu-Zn@C对碘离子有较大的吸附容量,吸附90 min后,平衡吸附容量为90 mg/g。 4)样品在溶液pH为3~7的范围都表现出良好的吸附效果,pH越小吸附效果也越好。 5)溶液中的干扰性阴离子质量浓度为碘离子的10倍时,会对碘离子吸附效果有一定的抑制作用,但影响不大,表明该材料可以吸附复杂水体中的碘离子。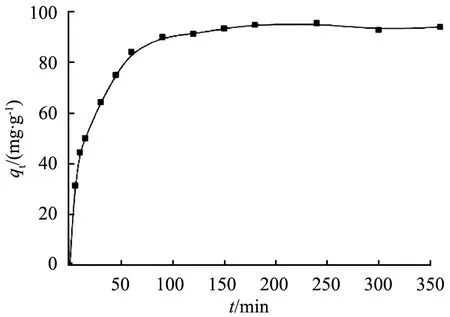
2.3 干扰离子及pH值对吸附性能的影响
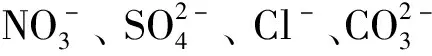

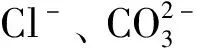
3 结论

