香叶木素对前列腺癌PC-3细胞生物学行为的影响
陈灿伟 范子文 黄帅 黄彦 瓦庆德 令狐熙涛 廖壮文
1广州医科大学附属第二医院骨科(广州 510000);2遵义医科大学第二附属医院骨科(贵州 遵义 563000)
前列腺癌(prostate cancer,PCa)是男性最常见的恶性肿瘤之一,前列腺癌骨转移是晚期前列腺癌患者死亡的主要原因[1-2]。研究[3-5]发现90%的前列腺癌死亡患者均有发生不同程度的骨转移,前列腺癌发生骨转移后导致剧烈疼痛、骨折等严重影响患者的生存质量。晚期前列腺癌骨转移的主要治疗策略包括放疗、化疗和手术等方法,然而患者治疗后平均中位生存时间仅3~5年,因此急需寻找新的治疗药物来改善患者的预后[6]。天然萃取的小分子化合物具有良好的生物活性和较低的毒性与副作用,是抗肿瘤药物的重要来源之一,研究发现从多种天然药物中提取的黄酮类生物化合物香叶木素具有抗炎、抗氧化、抗瘤等活性功能[7-8]。多项研究表明香叶木素可以通过诱导肺癌、肝癌及大肠癌等细胞的凋亡发挥抗肿瘤作用,但在前列腺癌骨转移中少有研究,其对前列腺癌细胞的影响有待阐明[9-11]。因此本研究以PC-3 为研究对象,探索香叶木素对非激素依赖性前列腺癌PC-3 细胞的影响,为其作为潜在的抗前列腺癌药物提供实验依据。
1 材料与方法
1.1 材料人前列腺癌PC-3 细胞株购于上海中科院细胞库。香叶木素(纯度≥98%)及DMSO 购于美国Sigma 公司;RPMI-1640 培养基、胎牛血清、细胞因子B27、EGF、bFGF 均购自美国Gbico 公司;CCK8 试剂盒购自美国AbMole 公司;单克隆抗体Caspase、Bax、Bcl2、β-acting 均购自美国CST 公司;BCA 蛋白检测试剂盒、ECL 发光液购于碧云天公司。
1.2 方法
1.2.1 药物溶解香叶木素用DMSO 溶解成储存液(储存浓度为1 mg/mL),0.22 μm 过滤器除菌。
1.2.2 细胞增殖率测定将对数生长期的PC-3 细胞制成单细胞悬液并以每孔100 μL(密度4×103个/孔)接种至96 孔板,培养过夜细胞贴壁后,药物组分别加入5、10、15、20、25 μg/mL 的香叶木素,对照组加入100 μL 培养基。继续培养24 h 后每孔加入100 μLCCK8 稀释液(每孔含10 μL 试剂原液),孵育2 h 用酶标仪测定490 nm 波长处的吸光度,所有实验设置5 个副孔并重复3 次。
1.2.3 细胞形态观察将PC-3细胞悬液以每孔1 mL(密度1×104个/孔)接种至12 孔板,然后加入5、10 μg/mL 香叶木素,培养24 h 在倒置显微镜下观察细胞形态变化。
1.2.4 细胞克隆实验将PC-3细胞(每孔1 000个)接种到6 孔板中,贴壁后加入5、10 μg/mL 香叶木素处理24 h。然后弃去培养基更换新鲜培养基,每3 天更换一次培养基并维持14 d。待2 周后用预冷的4%多聚甲醛固定20 min,PBS 清洗2 次后用0.1%结晶紫染色20 min,最后拍照计数。
1.2.5 细胞Transwell迁移实验将PC-3细胞(每孔1×105个)接种到6孔板中,贴壁后加入5、10 μg/mL香叶木素处理24 h。用无血清培养基将收集的细胞制成悬液后计数,并以5×104的密度接种至24 孔Transwell 上室中,下室加入含30%血清的培养基。培养24 h 后4%多聚甲醛固定20 min,PBS清洗2 次再用0.1%结晶紫染色15 min,拍照后随机选择5 个视野计数。
1.2.6 细胞黏附实验将PC-3细胞(每孔1×105个)接种到6 孔板中贴壁后加入5、10 μg/mL 香叶木素处理24 h,然后分别收集每组细胞计数,以6×103的密度接种到经FN 预处理24 h 的96 孔板中。培养3 h 后用PBS 洗涤细胞,然后用4%多聚甲醛固定20 min,0.1%结晶紫染色20 min 后显微镜下观察拍照,随机选择5 个视野计数。
1.2.7 细胞成球试验将PC-3细胞(每孔1×105个)接种到6 孔板中,贴壁后加入5、10 μg/mL 香叶木素处理24 h,然后收集细胞并计数,以1×103的密度接种至24 孔超低粘附培养板中,继续培养14 d 后拍照,并在显微镜下计数肿瘤球的数量(直径>50 μm)。
1.2.8 Western blot 分析将PC-3 细胞(每孔5×105个)接种到100 mm 培养皿中,贴壁后加入5、10 μg/ml 香叶木素处理24 h,然后弃去培养基,并用预冷的PBS 冲洗2 次。加入含有PMSF 和RIPA的PBS 缓冲液提取总蛋白,使用BCA 法测定蛋白浓度。将蛋白样品在12%的SDS-PAGE 中进行电泳2 h,然后用PVDF 膜电转1.5 h,并在5%脱脂牛奶中封闭60 min。将封闭后的PVDF 膜放在相应的一抗(1∶1 000)中孵育过夜,水平摇床低速震荡1 h 后TBST 洗膜液洗涤3 次,再放入相应的二抗(1∶2 000)中摇床低速震荡1 h。二抗孵育完成后TBST 洗膜液洗涤3 次并使用ECL 检测系统曝光条带,实验重复3 次。
1.3 统计学方法采用SPSS 16.0 和GraphPad 6.0统计分析,计量资料表示为均数±标准差,比较用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 香叶木素对PC-3 细胞活力的影响采用CCK8 法测定细胞增殖率,分别用5、10、15、20、25 μg/mL 的香叶木素处理PC-3 细胞24 h 后,细胞增殖率较对照组差异均有统计学意义(P<0.05)。香叶木素呈剂量效应抑制PC-3 细胞在体外增殖(图1)。

图1 香叶木素抑制PC-3 细胞的增殖Fig.1 Diosmetin inhibited PC-3 cell proliferation in vivo
2.2 香叶木素对PC-3细胞凋亡的影响根据CCK8结果,分别用5、10 μg/mL 的香叶木素处理PC-3 细胞24 h 后,镜下观察到PC-3 细胞形态从规则梭形变成圆形并出现细胞碎片(图2A)。此外通过WB检测凋亡相关基因Caspase 8、Bax 和抗凋亡基因Bcl-2 的表达,香叶木素能增加凋亡相关基因Caspase 8、Bax 的表达,而下调抗凋亡基因Bcl-2 表达(图2B)。

图2 香叶木素诱导PC-3 细胞发生凋亡(×100)Fig.2 Diosmetin induces apoptosis in PC-3 cells(×100)
2.3 香叶木素对PC-3 细胞集落形成的影响采用克隆形成实验测定香叶木素对PC-3 细胞集落形成能力的影响,分别用5、10 μg/mL 的香叶木素处理PC-3 细胞24 h 再培养14 d 后,香叶木素能抑制PC-3 细胞集落形成能力(P<0.05),见图3。

图3 香叶木素抑制PC-3 细胞的集落形成能力Fig.3 Diosmetin inhibited the colony forming ability of the PC-3 cells
2.4 香叶木素对PC-3 细胞迁移的影响采用Transwell 实验检测细胞的迁移变化,香叶木素处理PC-3 细胞后的细胞迁移能力显著低于对照组 (P<0.01),见图4。

图4 香叶木素抑制PC-3 细胞的迁移(×100)Fig.4 Diosmetin inhibited migration of PC-3 cells(×100)
2.5 香叶木素对PC-3 细胞黏附的影响采用FN黏附实验检测PC-3 细胞的黏附能力,用香叶木素处理PC-3 细胞24 h 后,处理组细胞黏附能力显著低于对照组(P<0.01)。
2.6 香叶木素对PC-3 细胞成球的影响采用悬浮培养检测细胞成球能力,用香叶木素处理PC-3细胞24 h 后再悬浮培养14 d 后,结果所示处理组PC-3 细胞成球能力显著低于对照组(P<0.01)。
3 讨论
细胞凋亡与增殖之间的失衡是肿瘤发生发展密切相关,肿瘤细胞能抵抗和逃避药物诱导的凋亡效应是恶性肿瘤耐药的主要机制之一,因此抑制肿瘤细胞的增殖与诱导其凋亡是治疗肿瘤的重要策略[12-14]。天然药用植物提取的小分子药物单体具有良好的生物活性、低毒副作用等优点,是一种重要的抗肿瘤药物来源之一,香叶木素作为一种具有多重抗瘤功能活性的黄酮类化合物,通常与诱导细胞凋亡有关。AL-ABD 等[15]发现香叶木素通过促进细胞周期停滞在G2/M 期显著抑制肝癌细胞增殖,并抑制Bcl-2、cyclinB1 的表达促进细胞凋亡。CHOI 等[16]发现香叶木素可抑制B16F10肿瘤细胞的增殖、迁移和诱导细胞凋亡,并能下调血管生成素2 和周细胞覆盖率有效抑制HUVEC细胞迁移和血管形成。本研究首先应用CCK-8 法检测了不同浓度的香叶木素对PC-3 细胞增殖能力的影响,结果发现香叶木素以浓度梯度显著抑制PC-3 细胞的增殖,结果提示香叶木素能抑制PC-3细胞的生长。
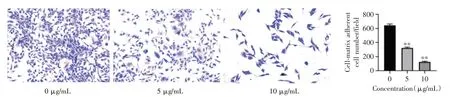
图5 香叶木素抑制PC-3 细胞黏附(×100)Fig.5 Diosmetin inhibited PC-3 cells adhesion(×100)
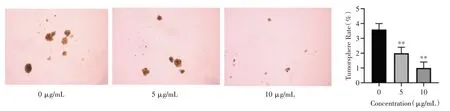
图6 香叶木素抑制PC-3 细胞球体形成(×50)Fig.6 Diosmetin inhibited PC-3 cells sphere formation(×50)
半胱天冬酶(caspase)是一类含有半胱氨酸水解酶的蛋白家族,由caspase-2、8、9 和10 等组成,在诱导细胞凋亡、转导和放大胞内凋亡信号过程中发挥关键作用,caspase-8 是外部凋亡信号通路的关键启动分子,激活caspase-8 酶活性能促进细胞发生凋亡[17-18]。此外在细胞内,Bcl 蛋白家族被认为是细胞凋亡过程中主要的内源性调节因子,B 淋巴细胞瘤-2 基因(Bcl-2)可抑制细胞凋亡,而Bcl-2 相关的X 基因(Bax)则促进细胞凋亡,Bcl2 与Bax 的比例与细胞凋亡发生有关[19-20]。在增殖结果的基础上,用不同浓度的香叶木素继续培养PC-3 细胞,然后通过显微镜观察细胞的形态变化,观察到香叶木素处理PC-3 细胞24 h 后,PC-3 细胞形态从规则的梭形变成透明圆形并出现碎片,贴壁数量明显减少。此外,还检测了香叶木素处理对PC-3 细胞中凋亡相关蛋白caspase-8、Bcl-2 和Bax 蛋白表达的影响,结果显示香叶木素以剂量依赖性方式提高促凋亡相关基因Caspase 8、Bax 的表达,同时下调抗凋亡基因Bcl-2 的表达,提示香叶木素通过调节caspase-8、Bcl-2 和Bax 的表达诱导PC-3 细胞发生凋亡。
肿瘤干细胞(cancer stem cells,CSCs)是一群具有干细胞特征的癌细胞亚群,参与肿瘤复发、转移和耐药等进展过程[21]。YUAN 等[22]发现DANCR可通过激活β-catenin 通路而促进肝癌细胞HCC 的干细胞特性,从而增加肿瘤的侵袭和转移。SANG等[23]研究表明在ID2 蛋白正向调节胶质母细胞瘤中HIF-α 的活性,当ID2 蛋白被Thr27 磷酸化后,HIF-α 表达不稳定从而使神经胶质母细胞瘤干性消失,肿瘤的生长被显著抑制。肿瘤的转移和侵袭是一个极其复杂的过程,除了CSCs 参与外,还包括肿瘤细胞向远处迁移并黏附于定植部位等特点[24]。体外实验还发现香叶木素呈剂量依赖性方式抑制PC-3 细胞的成球能力、集落形成能力等干细胞特性。此外,香叶木素以剂量依赖性方式抑制PC-3 细胞的黏附能力和迁移能力,这些结果表明香叶木素在体外可影响PC-3 细胞的干细胞特性及迁移能力。
综上所述,本研究发现香叶木素能抑制非激素依赖性前列腺癌PC-3 细胞的增殖并促进其凋亡,且还显著抑制PC-3 细胞的干细胞特性及远处转移能力,上述实验结果显示香叶木素在体外具有较好的抗前列腺癌活性。目前尚未探讨其发挥抑制前列腺癌生长与转移作用的潜在机制和体内抑瘤效果,因此在下一步研究中将会重点研究其抑制前列腺癌生长与转移作用的详细机制,并通过体内实验进一步验证其抗瘤活性,为香叶木素用于临床治疗前列腺癌及其骨转移瘤提供充分的实验依据。

