结核病亚单位疫苗的临床研究进展
杜京津 逄宇 李凌
1广东医科大学基础医学院(广东 东莞 523000);2首都医科大学附属北京胸科医院,北京市结核病胸部肿瘤研究所耐药结核病研究北京市重点实验室细菌免疫室(北京 101149);3南方医科大学基础医学院(广州 510515)
结核病(tuberculosis,TB)是由结核分枝杆菌(Mycobacterium tuberculosis,M.tb)引起的全球性传染病,据统计2020年全球约有990 万结核病新增病例以及150 万死亡病例[1]。疫苗接种是预防和控制结核病最直接、最有效的手段,虽然结核疫苗研发已有140年的历史[2],目前唯一许可的卡介苗(Bacillus Calmette-Guérin,BCG)对青少年和成年人预防活动性肺结核和潜伏性结核病感染(latent tuberculosis infection,LTBI)的保护作用却十分有限[3]。因此,迫切需要开发新型抗结核病疫苗,尤其是针对成人的、预防LTBI 转化TB 的疫苗。
截止到目前,全球正在开展临床试验的结核病疫苗共有14 个[4],根据其设计路线可分为减毒活疫苗、灭活分枝杆菌或提取物疫苗、病毒载体疫苗以及亚单位疫苗。然而这些类型的疫苗各有缺点:减毒活疫苗和灭活疫苗存在毒力恢复的风险,通常还需要依赖冷链运输[5];病毒载体疫苗诱导免疫反应的能力较弱,且可供选择的病毒载体有限。而亚单位疫苗由蛋白抗原和佐剂组成,安全性好且容易修饰[6-7],但因免疫原性弱,所以需要与佐剂联合使用[8]。目前,进入临床试验阶段的亚单位疫苗包括M72/AS01E、H56:IC31、ID93+GLA-SE、GamTBVac。本文将针对这四种亚单位疫苗的组成、临床进展及作用机制进行系统的阐述。
1 抗原
研究人员将M.tb不同类别抗原作为疫苗开发的靶抗原,包括早期分泌性抗原、毒力相关抗原、生长期和休眠期相关抗原(表1)。培养滤液蛋白(culture filtrate proteins,CFP)分子量低,能被T 细胞高效识别、诱导持久的免疫反应,如ESAT-6、CFP10[9-11]广泛应用于结核疫苗;PE/PPE 家族蛋白与M.tb的毒力相关,影响抗原呈递和宿主细胞凋亡[12],如PPE18、PPE42;Ag85A 和Ag85B 为乙酰/分枝酰转移酶,能刺激T 细胞增殖产生IFN-γ,也是一类免疫原性较强的抗原[13];M.tb感染人体在缺乏必需的营养素时,转变到无复制的“休眠”状态,在休眠操纵子(dormancy survival regulator,DosR)的调节下表达DosR 家族蛋白以维持潜伏感染,DosR 家族蛋白中免疫原性较好的如Rv2660、Rv1813[14-15]也是潜在的疫苗开发靶点。抗原是重组亚单位疫苗中的重要组分,所以有效保护性抗原的选择是疫苗开发成功的重要因素。
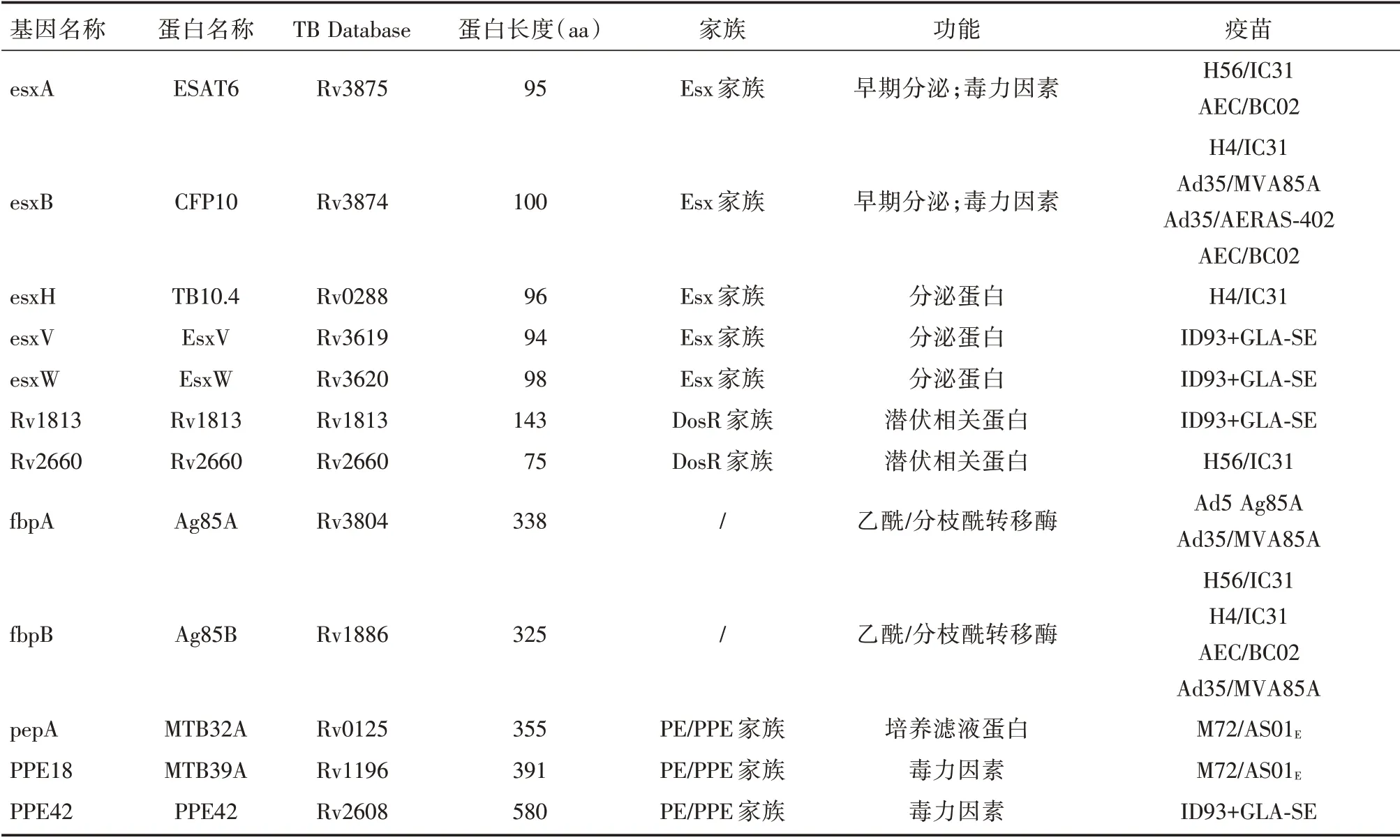
表1 结核疫苗常用抗原Tab.1 Antigens used in tuberculosis vaccines
2 佐剂
佐剂是一种非特异性的免疫增强剂,当与抗原联合使用时,可增强机体对抗原的免疫应答或改变免疫应答类型。四种临床阶段的亚单位疫苗分别采用了AS01E、IC31、GLA-SE、CpG ODN 作为佐剂(表2)。疫苗佐剂种类丰富,大体可分为免疫调节剂与递送系统,前者包括Toll 样受体(toll-like receptors,TLRs)、NOD 样受体(NOD-like receptors,NLRs)等天然免疫受体[16],后者包括脂质体和乳剂[17]等。病原相关分子模式(pathogen associated molecular pattern,PAMP)属于免疫调节剂类佐剂,其受体是包括TLRs、NLRs 在内的模式识别受体,如AS01E 中的活性成分单磷酰脂A(3-O-desacyl-4'-monophosphoryl lipid A,MPLA)、GLA-SE 中的活性成分GLA 均为TLR4 激动剂,IC31 中的活性成分ODN1a、胞嘧啶鸟嘌呤二核苷酸-寡脱氧核苷酸(CpG oligonucleotide,CpG ODN)中的活性成分CpG均为TLR9 激动剂。佐剂作为亚单位疫苗的重要组分,开发安全有效的新型疫苗佐剂、拓宽佐剂在疫苗中的应用范围至关重要。

表2 临床研究中结核亚单位疫苗采用的佐剂Tab.2 Adjuvants used in tuberculosis subunit vaccines in clinical studies
3 目前已经开发的亚单位疫苗
亚单位疫苗由抗原联合佐剂制成,克服了减毒活疫苗或灭活疫苗相关的安全问题,删除了全菌体疫苗许多冗余的无关抗原,且成分更可控、诱导免疫应答的效率更高。下文将对这四种亚单位疫苗进行系统介绍(表3)。
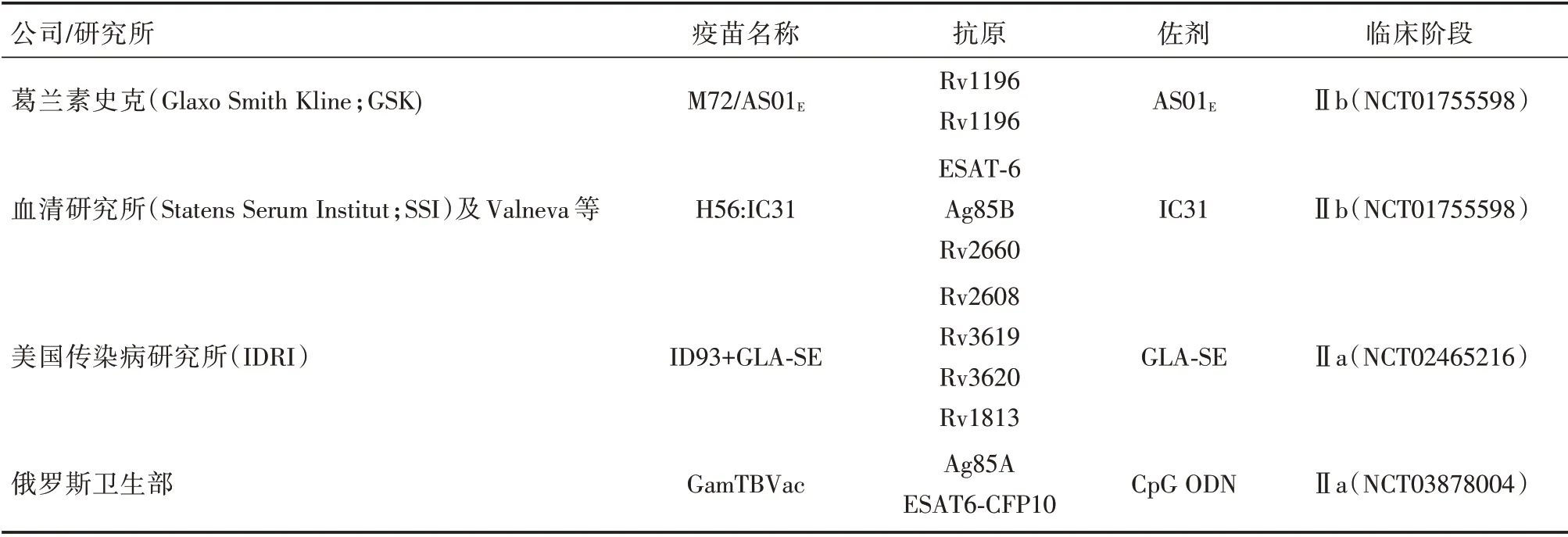
表3 临床研究中的结核亚单位疫苗Tab.3 Tuberculosis subunit vaccine in clinical studies
3.1 M72/AS01EM72/AS01E由英国GSK 公司开发,由高免疫原性的M.tb 蛋白MTB39A、MTB32A 和AS01E佐剂组成,已成功完成Ⅱb 期临床试验[18-19]。
M72/AS01EⅡb 期数据于2018年公布,该试验招募了3 283 名HIV 阴性的成人LTBI 患者,随访2.3年后结果显示,M72/AS01E组活动性肺结核病发病率减少了54.0%[19],首次证明了给LTBI 人群接种疫苗能有效预防其发展为活动性结核,但3年随访最终结果显示[18],M72/AS01E3年最终保护率下降到49.7%。M72/AS01E疫苗是安全有效的,疫苗注射相关不良反应轻微。
M72/AS01E的疗效是两种M.tb抗原(MTB39A、MTB32A)和AS01E协同作用的结果。其中MTB39A属PPE 蛋白家族成员,它是维持M.tb胞内生存的毒力因子之一;MTB32A为一种丝氨酸蛋白酶,同时也是CFP 组分之一。AS01E佐剂系统由配体MPLA、QS-21 和脂质体组成,MPLA 通过MyD88 和TRAM/TRIF 途径刺激TLR4 介导的细胞因子的产生;而QS-21 诱导IL-2、IFN-γ 和IgG2a 抗体的产生[20-21],M72/AS01E能诱导人外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)产生显著水平的M72特异性T 细胞因子,包括高水平的Th1 型细胞因子(IFN-γ、TNF-a 和IL-2)和低水平的IL-17[22],并且能激活NK 细胞产生抗原特异性IFN-γ,同时检测到CD8+T 细胞免疫应答反应。
3.2 H56:IC31H56:IC31 由SSI 及Valneva 等公司联合开发,其成分包含Ag85B、ESAT-6、Rv2660和IC31 佐剂,目前已完成了Ⅱa 期临床试验,正在进行预防结核病复发的Ⅱb 期测试。
H56:IC31 Ⅱa 期临床数据于2019年公布,该试验在南非招募了98 名HIV 阴性、有卡介苗接种史的健康成年人,并对参与者进行了292 天的安全性和免疫原性追踪,结果显示,在M.tb感染和未感染的成年人中,以最低剂量接种两或三次H56:IC31 疫苗可诱导持久的抗原特异性CD4+T 细胞反应,并具有良好的安全性和耐受性[23]。
H56:IC31 疫苗的保护效果与其诱导的CD4+T细胞应答的持久性和功能有关。H56是由ESAT-6、Ag85B、Rv2660 三个蛋白组成的融合抗原,它结合由KLKL5KLK与ODN1a非共价结合的佐剂IC31[14]。IC31 中的ODN1a 是TLR9 配体,能诱导抗原特异性的Th1 或Th17 型免疫应答;KLKL5KLK 为阳离子多肽。ESAT-6 在人类和结核病动物模型中具有高度的免疫原性,其在M.TB 感染过程中显示出持续的高表达[24];Ag85B 是参与分枝杆菌细胞壁合成的乙酰/分枝酰转移酶,主要在M.tb感染早期表达,在慢性感染过程中低表达;Rv2660 为M.TB 潜伏相关蛋白[25]。将休眠期抗原纳入疫苗成分,使其成为一种更完备的多阶段疫苗,这种策略为疫苗设计提供了新思路。
3.3 ID93+GLA-SEID93+GLA-SE 由IDRI 研发,这种治疗性疫苗由Rv1813、Rv2608、Rv3619、Rv3620四种抗原与GLA-SE 佐剂制备而成。
ID93+GLA-SE 已于2021年成功完成了Ⅱa 期临床试验,该试验在南非招募了HIV 阴性、有BCG接种史并被诊断为药物敏感型肺结核的成人患者。结果显示,ID93+GLA-SE 诱导了强大的多功能CD4+T 细胞反应,体液免疫反应主要诱导产生IgG1 和IgG3 亚类抗体,因此该疫苗可诱导针对疫苗抗原的特异性多功能CD4+T 细胞反应和持久的抗体反应[26]。在安全性方面,受试者出现了轻微的硬结和红斑等常规不良反应。
ID93+GLA-SE 的疗效是四种与毒力(Rv2608、Rv3619 和Rv3620)或潜伏期(Rv1813)相关的M.tb蛋白与GLA-SE 协同作用的结果[27]。ID93 结合了Rv1813 属于M.tb潜伏相关抗原,Rv1813 刺激潜伏感染者外周血后CD4+T 淋巴细胞释放IFN-γ 水平升高,由此推测其在潜伏感染者机体免疫反应中可能发挥一定保护作用;Rv2608 是一种外膜相关PPE 蛋白[28-29];Rv3619 和Rv3620 是M.tb所特有的,在牛分枝杆菌或卡介苗中不存在。这些抗原与GLA-SE 佐剂配制,GLA 为人工合成的六酰基脂质A 衍生物;SE 是一种水包油乳剂,用作GLA 的递送载体。ID93+GLA-SE 的治疗效果与增强Th1 型免疫应答、促进结核分枝杆菌清除和减少肺部炎症有关[30]。
3.4 GamTBVacGamTBVac 疫苗由俄罗斯卫生部研发,由Ag85A、ESAT6-CFP10 和CpG ODN 佐剂组成。GamTBVac 疫苗已成功于2020年完成Ⅱ期临床试验,该试验招募了180 名有卡介苗接种史且未感染M.tb的健康成人,结果显示其耐受性良好,并诱导了特异性和持久性的Th1 型免疫应答和体液免疫反应[31],为其Ⅲ期临床试验评估对结核病的保护效果奠定基础。
GamTBVac 疫苗的疗效是两种分枝杆菌融合抗原和CpG ODN 佐剂协同作用的结果。抗原ESAT6、CFP10 和Ag85A 具有很强的免疫原性和免疫优势,被广泛用于几代重组亚单位疫苗(H1/IC31,H4/IC31,H56/IC31,H56/CAF01)。这些抗原与CpG ODN 佐剂结合;CpG ODN 佐剂是人工合成的细菌DNA 分子,含有硫代磷酸骨架以及未甲基化的CpG 基序,能高效诱导Th1 反应、细胞毒性T 淋巴细胞作用和IFN-γ 分泌[32]。
4 展望
结核病是21世纪最重要的公共卫生问题之一,开发结核病疫苗仍然是一个关键的全球卫生优先事项。疫苗接种利用获得性免疫原理,建立有效和持久的免疫记忆,以缩短适应性免疫反应开始的时间间隔,从而能够迅速控制M.tb感染[33]。结核病亚单位疫苗具有良好的安全性、有效性,且应用广泛;然而,目前亚单位疫苗研究依旧面临许多挑战:在疫苗设计方面,筛选有效的抗原和研发效率高的佐剂较为困难,且研发周期长、需要高费用的投入;在疫苗评价方面,缺乏合适的动物评估模型和有效的鉴定标志物,临床试验的保护率与不同人群抗M.tb感染能力存在异质性有关。针对上述问题,后续研究将主要聚焦于筛选有效的抗原(或组合)与高效的佐剂、建立稳定且重复性高的动物评估模型以及统一的评价指标等。
本文对临床研究中的亚单位疫苗应用状况进行了较为系统的总结,为合理选择结核亚单位疫苗抗原和佐剂提供参考。此外,亚单位疫苗联合药物辅助治疗结核病或者作为BCG 疗效的补充也是未来结核亚单位疫苗应用重要的方向[34]。随着M.tb与宿主免疫之间的深入研究、新的抗原靶标不断被发掘、新佐剂不断被发现,未来会出现更多安全有效的亚单位疫苗来满足人类的需求。

