慢性心理应激对高脂饮食ApoE-/-小鼠肠道菌群的影响
王立 孟令丙 徐鸿轩 陈玉辉 尹家文 王倩雯 刘德平 龚涛
100730 北京医院,国家老年医学中心, 国家卫生健康委北京老年医学研究所,国家卫生健康委老年医学重点实验室,中国医学科学院老年医学研究院(王立、孟令丙、徐鸿轩、陈玉辉、尹家文、王倩雯、刘德平、龚涛);100730 北京医院神经内科(王立、陈玉辉、尹家文、王倩雯、龚涛),心血管内科(孟令丙、徐鸿轩、刘德平)
动脉粥样硬化(atherosclerosis,AS)是一种多因素疾病,其主要原因是脂质成分在血管壁的积聚,以及动脉内的慢性炎症,导致AS斑块的形成和斑块破裂[1]。AS斑块破裂引起的心肌梗死、脑梗死等心脑血管疾病及其并发症已成为威胁人类生命和健康的主要原因。因此,探讨AS性疾病的发病机制、防治已成为当前的研究热点[2-3]。已有研究表明,社会心理因素尤其是慢性心理应激(chronic psychological stress,CPS)在AS的发生发展中起着重要作用,但其在AS演变中的确切机制尚不清楚[4-5]。近年来,越来越多的证据表明肠道菌群参与了血管炎症和AS的发生发展过程[6-8]。各种小鼠模型均证实肠道菌群影响血管炎症表型、心脑血管疾病的发生和动脉血栓形成。然而,目前尚不清楚CPS是否通过改变肠道菌群进而影响AS形成和进展。本研究的目的是探讨CPS对小鼠AS的影响,并观察在CPS作用下AS模型小鼠肠道菌群的变化情况。
1 材料与方法
1.1 主要试剂与仪器
小鼠普通饲料(货号1022)和高脂饲料(货号H10141)购自北京华阜康生物科技有限公司;HE染色试剂盒(货号G1003)购自武汉赛维尔生物科技有限公司;全自动生化分析仪购自美国Beckman公司;旷场装置(尺寸:长50 cm,宽50 cm,高40 cm)及KEMaze动物行为自动分析软件购自南京卡尔文生物技术有限公司。
1.2 实验动物
10只SPF级雄性C57BL/6J小鼠和20只SPF级雄性ApoE-/-(C57BL/6J背景)小鼠购自北京华阜康生物科技有限公司。所有小鼠单笼饲养,食物和水不受限。饲养环境:温度20℃~24℃,相对湿度60%~70%,光照周期12/12 h。
1.3 AS和CPS模型构建
10只20周龄雄性C57BL/6J小鼠接受普通饲料喂饲,设为正常对照组(normal control group,NC组);20只20周龄雄性ApoE-/-小鼠随机分为2组:其中10只为AS组(atherosclerosis group,AS组),予以高脂饲料喂养12周;另10只予以高脂饲料喂养叠加慢性温和不可预知性应激(chronic unpredictable mild stress,CUMS)干预12周,为AS+CPS组。
CUMS实施方案[9-10]如下,每周随机进行以下应激方式:(1)夹尾:鼠尾末端1 cm处钳夹1 min;(2)突发震动:摇晃鼠笼15次,每次持续5 s,间隔10 s;(3)昼夜颠倒:即反转光照周期3次;(4)噪声刺激:暴露于70 dB的白噪音中7或9 h;(5)闪光刺激:低强度频闪灯照明(150次闪烁/min)9或12 h;(6)束缚:将小鼠约束于固定器中,无法转身2或4 h;(7)鼠笼倾斜:鼠笼置于45°倾斜角的平台上,每小时调整角度,共7 h;(8)潮湿的敷料24 h。
1.4 小鼠体重和血脂浓度检测
分别采集各组小鼠基线(0)和第4、8、12周体重。造模结束后小鼠禁食不禁水12 h,麻醉后心脏穿刺采血,注入EDTA抗凝管,3 000 r/min、4℃离心15 min,收集血浆后-80℃保存。采用Beckman全自动生化分析仪测定血清三酰甘油、总胆固醇、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇浓度。
1.5 旷场实验
旷场实验反应箱底部分为16个面积相同的小格,外周12格记为周边区,中间4格为中心区。将小鼠置于中心区域,动物行为学软件自动记录并分析5 min内小鼠停留在中心区的时间。旷场实验在没有干扰的隔音室中进行,每次检测完成一只小鼠后使用5%的乙醇水溶液擦洗反应箱,挥发干后再进行下一只检测,以避免由于先前小鼠留下的气味而产生的偏倚。
1.6 小鼠动脉血管组织病理学检查
小鼠麻醉后分离动脉血管,标本于4%多聚甲醛溶液中固定后,依次进行冲洗、脱水、浸蜡、石蜡包埋、制片和染色等操作。按试剂使用说明进行苏木精和伊红(H&E)染色后在显微镜下观察并拍照。用ImageJ软件测量管腔和AS斑块面积。
1.7 小鼠肠道菌群检测分析
为了解不同处理对小鼠肠道菌群多样性的影响,实验最后一天利用无菌离心管接取每只小鼠的粪便标本,立即置入液氮后转入-80℃保存以供进一步分析。 提取并扩增微生物DNA,正向引物为341F(5’-CCTACGGGNGGCWGCAG-3’),反向引物为806R(5’- GGACTACHVGGGTATCTAAT-3’),分别针对V3-V4区扩增微生物16S rDNA基因。由广州基迪奥生物科技有限公司在Illumina Novaseq 6000测序平台上进行16S测序及分析。
1.8 统计学方法

2 结果
2.1 CPS和高脂饮食对小鼠体重的影响
各组小鼠初始体重差异无统计学意义(P>0.05)。随着生长及干预进行,各组小鼠体重增加,其中NC组和AS组小鼠体重全过程均无显著改变,但AS组小鼠体重增长幅度更大,于第4周反超过NC组,此后差距逐渐加大。第12周AS组小鼠体重增长幅度较NC极显著增加(P<0.001)。与NC组比较,AS+CPS组小鼠体重增长相对较慢(图1),干预第4周AS+CPS组小鼠体重与NC组小鼠体重相比差异有统计学意义(P<0.05)。与AS组比较,AS+CPS组小鼠体重增长缓慢,第4周开始差异有统计学意义(P<0.05),干预12周后AS+CPS组小鼠体重和NC组及AS组小鼠体重相比更轻,差异有统计学意义(P<0.01),见图1。

a:NC组比AS组,b:AS组比AS+CPS组,c:NC组比AS+CPS组;a/b/cP<0.05,bb/ccP<0.01,aaaP<0.001;每组10只图1 干预前后各组小鼠体重变化趋势
2.2 CPS和高脂饮食对小鼠血脂浓度的影响
与NC组小鼠比较,AS组和AS+CPS组小鼠血浆中低密度脂蛋白胆固醇和总胆固醇浓度显著升高(P<0.001),三酰甘油和高密度脂蛋白胆固醇浓度显著升高(P<0.01)。与AS组比较,AS+CPS组小鼠血浆高密度脂蛋白胆固醇浓度显著下降(P<0.05),见表1。

表1 小鼠血脂浓度比较(mmol/L)
2.3 CPS和高脂饮食对小鼠自主行为的影响
旷场实验结果显示,干预前各组小鼠在反应箱中心区域停留的时间差异无统计学意义(P>0.05),见图2A。干预12周后,与NC组和AS组小鼠比较,接受CUMS的AS+CPS组小鼠在反应箱中心区域停留的时间显著减少(P<0.05),见图2B。

干预前基线(A),干预终点(B);aP<0.05;每组10只图2 干预前后各组小鼠在旷场反应箱中心区域停留时间变化
2.4 CPS和高脂饮食对小鼠动脉血管形态的影响
干预12周后与NC组小鼠比较,可见AS组和AS+CPS组小鼠动脉血管壁粥样硬化斑块形成(P<0.001),造成管腔狭窄(P<0.001)。与AS组小鼠比较,AS+CPS组小鼠斑块面积显著增加(P<0.01),管腔狭窄更为严重(P<0.01),见图3。

HE染色显示动脉血管壁粥样硬化斑块形态(A)、头臂干分叉处斑块面积(B)和管腔狭窄率(C);aaP<0.01,aaaP<0.001;每组8只图3 CPS和高脂饮食对小鼠动脉血管粥样硬化的影响
2.5 CPS和高脂饮食对小鼠肠道菌群的影响
2.5.1 OTUs数据分析和物种注释 在16S rRNA V3-V4基因序列相似性为97%的条件下,得到每个样本的操作分类单元(operational taxonomic units,OTUs)。其中307个OTUs为三组共有,NC组、AS组、AS+CPS组小鼠分别独有208、61、30个OTUs。这一结果表明这三个群体的肠道菌群之间有一定的共性,同时也存在一些差异。比较各组OTUs数量,结果显示NC组、AS组和AS+CPS组样本OTUs数量依次降低,见图4。

图4 维恩图展示各组间共有和特有OUTs数量
2.5.2 α多样性分析 α多样性指某个群落或生境内部物种的多样性,通常使用两个重要参数进行计算:物种丰富度和均匀度。Chao1指数主要与样品的物种丰富度有关。与NC组相比,AS和AS+CPS小鼠肠道菌群chao1指数均显著降低(NC组比AS组,P<0.01;NC组比AS+CPS组,P<0.0001; AS组比AS+CPS组,P>0.05),见图5A。Peilou指数主要反应样品内物种均匀度,结果显示与NC组相比,AS+CPS组Peilou指数显著下降,差异具有统计学意义(P<0.05),其他各组间差异不显著,见图5B。此外,Shannon指数综合反映样本丰富度和均匀度,结果显示只在NC组和AS+CPS组间存在显著差异(P<0.05),见图5C。综上表明,AS+CPS组小鼠肠道内菌群多样性明显下降。

α多样性分析: Chao1箱线图(A)、Pielou箱线图(B)和Shannon箱线图(C);β多样性分析:NMDS分析(D);aP<0.05,aaP<0.01,aaaaP<0.000 1,每组8只图5 小鼠肠道菌群多样性分析
2.5.3 β多样性分析 β多样性指不同生境之间多样性的比较,即样本间的差异,可用非度量多维尺度法(nonmetric multidimensional scaling,NMDS)分析。结果显示NC组和AS组小鼠样本分布相对集中,AS+CPS组小鼠样本分布较分散;AS和AS+CPS样本间分布距离较近,与NC组小鼠距离相对远,故与AS和AS+CPS组比较,NC组小鼠样本单独构成一类,见图5D。
2.5.4 小鼠肠道菌群组成变化 根据物种注释结果在门水平与NC组小鼠比较,AS组小鼠肠道内厚壁菌门丰度显著增加(P<0.01),而AS+CPS组小鼠肠道厚壁菌门丰度呈增加趋势(P>0.05);AS组和AS+CPS组小鼠肠道疣微菌门(P<0.001)和变形菌门(P<0.01)的丰度显著增加,拟杆菌门(P<0.001)的丰度均显著降低,厚壁菌门/拟杆菌门(F/B)比值增大。与AS组比较,AS+CPS组小鼠疣微菌门的丰度显著增加(P<0.01),放线菌门的丰度显著降低(P<0.05)。虽然与AS组比较,AS+CPS组小鼠肠道厚壁菌门和拟杆菌门的丰度均呈下降趋势(P>0.05), 但拟杆菌门的丰度下降程度更大,故F/B比值相对增大,见图6A。
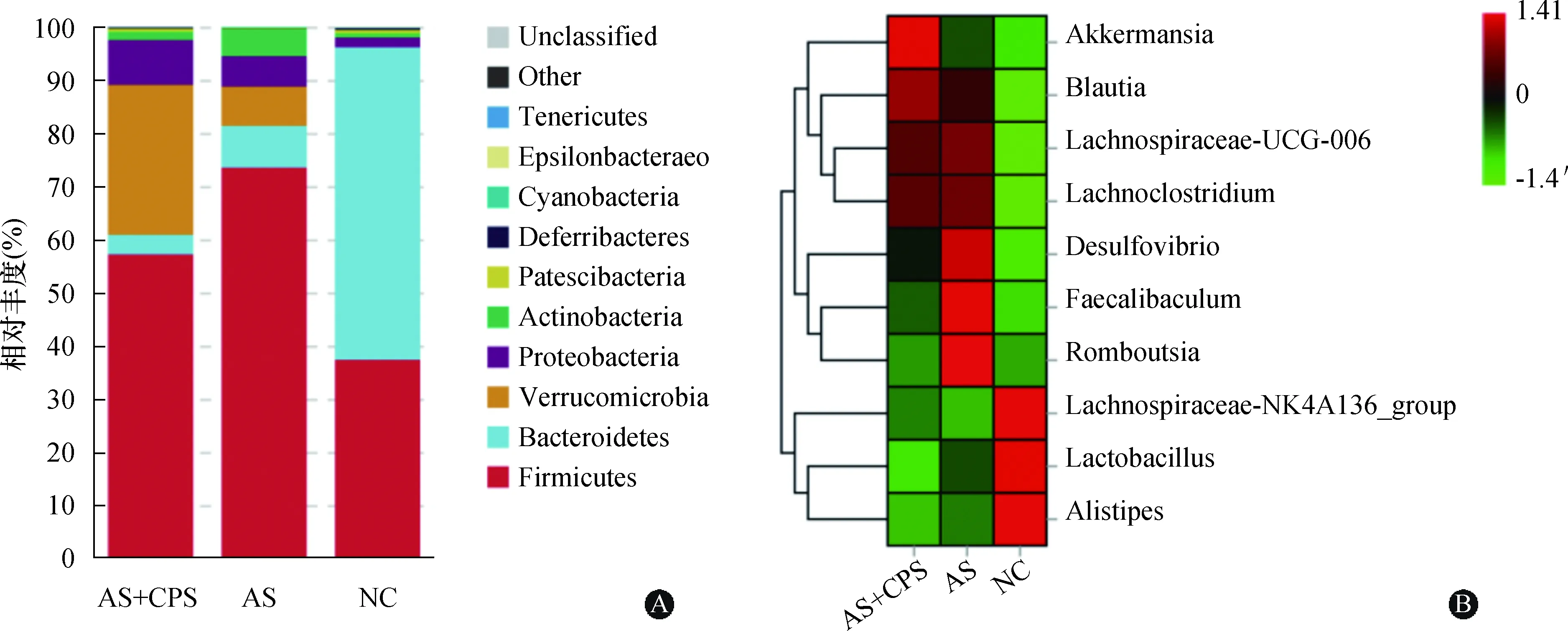
门水平物种分布堆叠图(A),属水平top10物种丰度热图(B);Firmicutes:厚壁菌门,Bacteroidetes:拟杆菌门,Verrucomicrobia:疣微菌门,Proteobacteria:变形菌门,Actinobacteria:放线菌门;Akkermansia:阿克曼氏菌属,Blautia:布劳特氏菌属,Lachnospiraceae-UCG-006:毛螺菌科-UCG-006,Desulfovibrio:脱硫弧菌属,Faecalibaculum:粪钙杆菌属,Romboutsia:罗姆布茨菌属, Lachnospiraceae-NK4A136-group:毛螺菌科-NK4A136组,Lactobacillus:乳酸杆菌属,Alistipes:理研菌属;每组8只图6 小鼠肠道菌群组成变化
在属水平与NC组小鼠相比,AS组和AS+CPS组小鼠肠道理研菌属(P<0.001)和毛螺菌科-NK4A136组(P<0.01 和P<0.05)的丰度显著降低,AS组小鼠乳酸杆菌属丰度呈下降趋势(P>0.05),AS+CPS组小鼠乳酸杆菌属丰度显著降低(P<0.05)。同时,AS组和AS+CPS组小鼠肠道布劳特氏菌属(P<0.001 和P<0.01)、毛螺菌科-UCG-006(P<0.001)和Lachnoclostridium(P<0.001 和P<0.01)的丰度显著增加。相较于AS组小鼠,AS+CPS组小鼠肠道阿克曼氏菌属的丰度显著增加(P<0.01),乳酸杆菌属、罗姆布茨菌属和粪钙杆菌属的丰度均显著降低(P<0.05),见图6B。
3 讨论
AS是一种发病机制复杂的慢性炎性与代谢性相关疾病,病程发展缓慢,主要特征为脂质在血管内膜下逐渐沉积,然后纤维组织增生及钙化沉积,动脉壁增厚变硬,粥样硬化斑块形成导致管腔变窄。在本研究中与NC组小鼠比较,AS组和AS+CPS组小鼠均喂食高脂饲料12周,成功构建AS模型。相较于NC组和AS组小鼠,AS+CPS组小鼠叠加CPS干预,研究显示AS+CPS组小鼠体重增长缓慢,在旷场实验反应箱中心区停留时间显著减少。综上表明CPS效果显著,导致该组小鼠处于持续的心理应激状态。比较不同组间小鼠动脉血管粥样硬化病变,结果表明AS+CPS组小鼠血管斑块面积增大,管腔狭窄加重。此外,本研究前期结果证实CPS可导致动脉血管粥样硬化斑块负荷增加,管腔狭窄加重,斑块稳定性降低,故CPS促进了AS的发生发展[10-11]。本研究中AS组与AS+CPS组小鼠血浆低密度脂蛋白胆固醇、总胆固醇和三酰甘油浓度无显著差异,提示CPS可能通过其他作用机制而非脂质代谢途径影响AS形成和进展。
近年来研究发现,肠道菌群失调激发机体的免疫调节,参与AS的发生发展[6-7,12]。同时研究表明CPS对肠道微生物群落组成有显著影响,提示CPS可能通过改变肠道菌群结构来影响AS发生发展。本研究利用16S测序技术对三组小鼠粪便进行检测,评估小鼠肠道菌群变化情况,结果证实,与NC组小鼠比较,AS组和AS+CPS组小鼠肠道菌群均发生了显著改变。
α多样性分析显示,与NC组比较,AS组和AS+CPS组小鼠样本Chao1指数均下降,表示物种丰富度显著下降。NC组和AS组小鼠样本Pielou指数无明显差异,而NC组和AS+CPS组小鼠样本Pielou指数显著下降,表明CPS导致肠道菌群均匀度下降。Shannon指数综合反映物种丰富度和均匀度,结果表明只在NC组和AS+CPS组小鼠间出现显著差异。综上表明高脂饮食可导致AS小鼠肠道菌群紊乱,而CPSCPS可能通过降低肠道菌群多样性进一步加重肠道菌群紊乱促进AS发生发展。
研究证实,三甲胺(trimethylamine,TMA)水平和AS发生发展密切相关[13],而产生TMA的细菌主要分布于厚壁菌门、变形菌门。本研究中,AS组和AS+CPS组小鼠肠道厚壁菌门及变形菌门的丰度增加,拟杆菌门的丰度降低,厚壁菌门/拟杆菌门增大,与以往研究结果一致[14-15]。本研究表明与AS组小鼠比较,AS+CPS组小鼠疣微菌门、放线菌门的丰度显著增加,厚壁菌门和拟杆菌门的丰度相对降低,提示CPS可能通过影响肠道菌群组成促进AS发生发展。
AS组和AS+CPS组小鼠理研菌属丰度比NC组显著降低,该属菌群参与脂肪消化,可将乳酸转化为其他短链脂肪酸,如乙酸和丙酸,短链脂肪酸具有AS保护效应[16]。此外,AS组和AS+CPS组小鼠毛螺菌科-NK4A136组的丰度显著降低,毛螺菌科-NK4A136组为产丁酸盐细菌,被证实有助于维持小鼠肠道屏障的完整性[17]。当肠道屏障受损时,肠道各种炎性介质如脂多糖更易进入血液循环损伤血管促进AS发生发展。故由于毛螺菌科-NK4A136组增强上皮屏障完整性和抑制炎症的能力,对维持胃肠道健康、减少炎性物质吸收和防止血管炎症有重要作用。AS组和AS+CPS组小鼠肠道中Lachnoclostridium丰度均显著增加,研究表明其丰度与血液氧化三甲胺(trimethylamine oxide,TMAO)水平呈显著正相关,而TMAO促进AS发生发展[18-20]。
通过观察AS组和AS+CPS组间差异物种,可以评估CPS对肠道菌群的影响。本研究显示相较于AS组,AS+CPS组小鼠肠道乳酸杆菌属、罗姆布茨菌属和粪钙杆菌属丰度均显著降低。研究证实乳酸杆菌属作为有益菌在AS发生发展中具有保护效应[21]。Zheng等[22]研究显示罗姆布茨菌属丰度和高脂饮食大鼠高密度脂蛋白胆固醇浓度正相关,而高密度脂蛋白胆固醇在AS发展过程中有保护效应。本研究中AS+CPS组小鼠高密度脂蛋白胆固醇浓度显著低于AS组小鼠,提示CPS可能通过降低罗姆布茨菌属丰度进而负向调节高密度脂蛋白胆固醇浓度促进AS发展。研究表明,粪钙杆菌属Faecalibaculum rodentium菌可产生短链脂肪酸发挥抗肿瘤作用,但也有研究报道粪钙杆菌属细菌发挥促炎作用,可能破坏肠道屏障[23-24]。此外,比较AS组和AS+CPS组小鼠肠道菌群差异物种发现CPS干预后小鼠肠道疣微菌门-阿克曼菌属丰度显著增加。近来研究显示该属中代表性菌种嗜黏蛋白阿克曼菌可通过修复肠道屏障减轻代谢性内毒素引起的炎症,从而减轻血管炎症及改善AS病变[25-26]。该现象与CPS促进AS发生发展相矛盾,分析其原因有阿克曼氏菌属包含多种细菌,彼此功能可能并不一致。此外,也可能与机体应激后启动反馈调节机制或采样时间节点有关,未来应动态采样观察不同阶段肠道菌群变化情况。总的来说肠道菌群在介导CPS促进AS发生发展中的作用极其复杂,同时存在有益菌和有害菌丰度的双向不同程度变化。
综上,本研究表明高脂饮食可导致AS小鼠肠道菌群紊乱,有益菌丰度下降,有害菌丰度增加,同时CPS促进AS病变发展,加重肠道菌群紊乱及降低菌群多样性。未来需要进一步研究CPS过程中机体肠道特异性改变的菌种对AS发生发展的影响及机制。
利益冲突:无

