膀胱癌免疫治疗相关肿瘤微环境及其在人和小鼠肿瘤中的组成特征初探
周炳坤,王博,贺情情,黄孝东,陈俊宇,黄健*
膀胱癌是男性泌尿系统中第二高发的恶性肿瘤,易于转移和复发[1,2]。对于晚期转移性膀胱癌患者而言,以铂类为基础的化疗是首选的治疗方式。但对于不适于铂类化疗或化疗无效者,免疫治疗是主要的治疗手段[3]。免疫检查点阻断(immune checkpoint blockade,ICB)治疗是新兴的免疫治疗方式,其疗效在多种恶性肿瘤中得到验证[4]。虽然ICB 治疗可改善晚期膀胱癌患者的预后[5],但多项膀胱癌ICB 治疗的临床试验表明其客观缓解率仅为17.4%~24%[6,7],且ICB 治疗有效或抵抗的机制尚不完全清楚。
肿瘤微环境(tumor microenvironment,TME)是由肿瘤细胞和免疫细胞、间质细胞及相关的细胞外基质组成[8]。TME 中各种组分间相互作用网络可影响肿瘤进展和免疫治疗疗效[9,10]。研究表明TME 中多种细胞组分与肿瘤进展相关[11-13],其中细胞毒性T 细胞、B 细胞和NK 细胞等还与ICB 治疗疗效相关[14-16]。据报道,肿瘤相关成纤维细胞(cancer-associated fibroblast,CAF)可通过重塑细胞外基质和形成免疫抑制性TME 等机制[17],参与肿瘤发生、发展和转移以及治疗抵抗[18,19]。但目前具体的TME 组成和膀胱癌免疫治疗疗效的关系尚不完全明确,且免疫治疗研究缺乏可靠的能模拟人膀胱癌TME 的动物模型,限制了对其机制的深入理解。
本研究首先通过IMvigor210 临床试验数据集的生物信息学分析,鉴定了与ICB 治疗疗效相关的差异基因、基因富集通路和细胞类型;进一步应用TCGA 膀胱癌数据集和免疫组化分析差异细胞与膀胱癌预后和进展的关系;最后我们建立了N-butyl-N-(4-hydroxybutyl)-nitrosamine(BBN)诱 导的自发小鼠膀胱成瘤模型,初步评估了该模型与人膀胱癌组织的TME 的组分特征。
1 资料与方法
1.1 临床和数据资料搜集
本研究所使用的32 例膀胱癌患者组织均来自中山大学孙逸仙纪念医院,经病理诊断为膀胱癌,实验遵循赫尔辛基宣言并获得中山大学孙逸仙纪念医院伦理委员会的批准(SYSEC-KY-KS-2018-064)。病理组织经固定、脱水、石蜡包埋后切成4 μm 切片。膀胱癌PD-L1 临床试验IMvigor210数 据 集[20]从http://research-pub.gene.com/IMvigor210CoreBiologies/packageVersions/下载和TCGA 膀胱癌数据集从https://tcga-data.nci.nih.gov/tcga/下载。
1.2 差异基因分析
晚期膀胱癌患者接受PD-L1 阻断治疗后的临床反应类型分为四类,包括:治疗有效组的完全缓解(complete response,CR)和部分缓解(partial response,PR);治疗无效组的疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。IMvigor210 数据集总计有348 例晚期膀胱癌患者,排除临床数据或基因表达数据不完整的病例后,共有298 例患者被纳入研究,其中有效组68 例,无效组230 例。使用“DESeq2”R 包筛选治疗有效组对比治疗无效组的差异基因。差异基因筛选标准为|Log2(Fold Change)|≥1.0,同时满足校正P值<0.05。利用“ggpubr”R 包进行可视化展示。
1.3 GO 和KEGG通路富集
采用R 包“clusterProfiler”、“DOSE”、“GO.db”和“topGO”进行差异基因的富集分析。GO(Gene ontology)与KEGG(Kyoto Encyclopedia of Genes and Genomes)分析中,校正P值(adjustedP)均小于0.05。GO 分析和KEGG 富集分析均对排名前20的通路进行可视化展示,其中KEGG 通路圆点越红表示越显著,越大表示富集的差异基因越多。
1.4 肿瘤微环境和细胞组分分析
采用“IOBR”R 包对PD-L1 治疗有效组对比治疗无效组的肿瘤微环境和细胞组分基因集进行分析[21]。基因集条目后缀为该基因集的具体引用出处。可视化使用“ComplexHeatmap”R 包(部分肿瘤微环境和细胞分析中的基因集条目相同)。应用Wilcoxon 秩和检验进行统计分析并以箱式图展示。
1.5 膀胱癌预后及病理分期分析
使用CIBERSORT 在TCGA 膀胱癌数据集中对活化NK 细胞和CD8+T 细胞基因集与患者总生存时间进行分析。排除含不完整基因表达量和临床信息的数据后,408 例患者被纳入分析。采用“Survminer”R 包计算细胞分数与总生存期间的最佳阈值并将患者分成高低表达组,以Kaplan-Meier法绘制生存曲线,使用Log-rank 检验进行统计学分析。可视化使用“ComplexHeatmap”R 包。TCGA 中PDGFRB 表达量与总生存期分析由Kaplan-Meier plotter(http://kmplot.com/,仅收录405 例膀胱癌患者数据,缺少3 例生存期为0 的患者数据)完成。细胞标记基因与膀胱癌病理分期关系由GEPIA2(http://gepia2.cancer-pku.cn/)中stage plot 模块完成分析。
1.6 构建BBN 诱导的自发小鼠膀胱肿瘤模型
参考Miyamoto H 等构建BBN 诱导的自发小鼠膀胱肿瘤模型[22]。用含0.05% BBN(N-butyl-N-(4-hydroxybutyl)-nitrosamine,麦克林,China)的饮用水饲养6~8 周龄C57BL/6 小鼠,每组6~10 只。从第12 周开始每隔1~2 周收获膀胱组织,组织固定在10%甲醛中,经石蜡包埋保存。切取4 μm 厚度组织进行H&E 染色以明确尿路上皮病变程度,根据尿路上皮是否发生异型性改变及其局部浸润程度,将膀胱病变分为正常、异型性增生、非肌层浸润性膀胱癌(non muscle-invasive bladder cancer,NMIBC)和肌层浸润性膀胱癌(muscle-invasive bladder cancer,MIBC)四类。
1.7 H&E 染色
石蜡切片经高温烘烤1~2 小时后,依次通过二甲苯、无水乙醇、95%酒精、85%酒精、75%酒精和纯水进行脱蜡和水合,再经苏木素染细胞核,伊红染细胞质。
1.8 免疫组化染色
石蜡切片经烘烤、脱蜡和水合处理后,使用1%H2O2室温处理10 min 以消除内源性过氧化物酶,使用5% BSA 溶液室温处理30 min 以封闭蛋白质非特异性结合位点,于4 ℃孵育一抗过夜,第二天于37℃孵育二抗30 min,然后进行DAB 显色和苏木素染色。最后在正置显微镜下拍照观察。一抗信息如下:人鼠α-SMA(1∶600,Cell signaling technology,USA)、人鼠PDGFRB(1∶800,Cell signaling technology,USA)、人NCR1(1∶1000,Abcam,USA)、鼠NCR1(1∶1000,Abcam,USA)、人CD8(1∶1000,中杉金桥,China)和鼠CD8(1∶800,Cell signaling technology,USA)。PDGFRB 组化评分采用以下标准:将DAB 染色强度按0、+1、+2 和+3 赋值0、1、2 和3 分,染色范围按0、0%~24%、25%~49%、50%~74%和75%~100%分别赋值0、1、2、3 和4 分。两者相乘即为该视野的组化评分,三个不同200X视野的平均组化评分即为该例患者的PDGFRB 组化评分。NCR1 采用定量分析,使用ImageJ 软件统计阳性细胞数,取三个200X 视野的平均值。
1.9 统计分析
R 版本为4.1.1(https://www.r-project.org/)。肿瘤微环境和细胞组分的统计分析采用Wilcoxon 秩和检验,生存曲线比较采用Log-rank 检验,NCR1 的组化定量分析和细胞标记基因与病理分期分析均采用one-way ANOVA,PDGFRB 的组化半定量分析采用Kruskal-Wallis检验。检验水准α=0.05,*为P<0.05,**为P<0.01,***为P<0.001
2 结 果
2.1 筛选差异基因和富集分析
为了筛选IMvigor210 数据集中与免疫治疗疗效相关的差异基因(DEGs),我们首先利用“DESeq2”R 包进行分析。以|log2Fold change|≥1.0,校正P值<0.05 作为筛选标准。有效组(CR/PR)对比无效组(SD/PD),分析结果显示:共有521 个基因出现差异表达,其中401 个基因表达上调,120 个基因表达下调(图1A)。
我们进一步应用“clusterProfiler”算法分析差异基因富集的GO 通路,其中包括生物过程(Biological process,BP)、细胞组成(Cellular component,CC)和分子功能(Molecular Function,MF),并对排名前20 的富集通路进行可视化展示。BP(图1B)中DEGs 主要富集在多种酶的调节通路如肽链内切酶活性负调控(negative regulation of endopeptidase activity)等和体液免疫通路如体液免疫反应(humoral immune response)等,提示治疗有效患者中适应性免疫应答尤其是体液免疫应答水平更高。对CC(图1C)的分析显示DEGs 主要富集在多种细胞器腔如内质网腔(endoplasmic reticulum lumen)等,其中44 个DEGs 富集在含胶原细胞外基质(collagen-containing extracellular matrix),提示成纤维细胞与免疫治疗疗效有关。我们对该通路中排名前20 的表达上调基因进行了标注(图1A)。此外,DEGs 还富集在攻膜复合物(membrane attack complex,MAC),表明治疗有效患者体内补体系统激活水平更高。DEGs 在MF(图1D)中主要富集在多种酶活性通路,如丝氨酸型肽链内切酶活性(serine-endopeptidase activity)等,说明ICB 治疗中多种酶活性发生了改变。KEGG 通路富集分析(图1E)发现:排名前三位的富集通路分别为神经活性配受体互作(Neuroactive ligandreceptor interaction)、补体和凝血级联反应(Complement and coagulation cascades)和药物代谢细胞色素P450(Drug metabolism-cytochrome P450),说明这三条通路在ICB 治疗中可能发挥关键性作用。
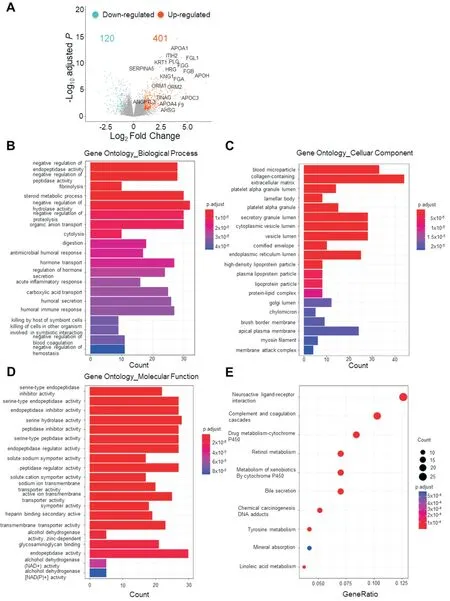
图1 IMvigor210 数据集差异基因和富集分析 A:IMvigor210 治疗有效组与无效组间差异基因火山图;B:排名前20 的生物过程(BP)通路;C:排名前20 的细胞组成(CC)通路;D:排名前20 的分子功能(MF)通路;E:排名前10 的KEGG 通路
2.2 TME 和细胞组分分析
为了鉴定与ICB 治疗疗效相关的TME 组分,我们利用“IOBR”R 包对有效组与无效组间的TME 相关基因集表达水平进行了定量分析,其中包括肿瘤细胞相关基因集和免疫细胞相关基因集。如图2A 和图2C 所示,在有效组中组蛋白(Histones)、细胞周期(Cell cycle)等肿瘤细胞相关基因集的表达水平高,提示肿瘤细胞自身特性影响ICB 治疗疗效。有效患者中CD8+T 细胞、细胞毒性细胞(Cytotoxic cells)和NK 细胞基因集表达的水平高,而肥大细胞(Mast cells)基因集的表达水平低,提示TME 中的免疫细胞在ICB 治疗中可能发挥不同功能。
为了研究与免疫治疗疗效相关的细胞类型,我们使用“IOBR”R 包对TME 中的NK 细胞、CD8+T 细胞、树突状细胞(Dendritic cell,DC)、巨噬细胞(Macrophage)和中性粒细胞(Neutrophil)以及非免疫细胞的CAFs 等进行了分析(图2B),发现主要有3 类细胞的基因集表达水平与疗效相关,包括NK 细胞、CD8+T 细胞以及CAFs。有效组中(图2C和2D),NK 细胞(P<0.01)和CD8+T 细胞(P<0.05)基因集表达的水平高;炎症性肿瘤相关成纤维 细胞(inflammatory cancer-associated fibroblasts,iCAFs)基因集表达的水平低(P<0.05,图2E)。因此,膀胱癌TME 中与ICB 治疗疗效相关的差异细胞主要为效应性的NK 细胞、CD8+T 细胞和间质中的CAFs。
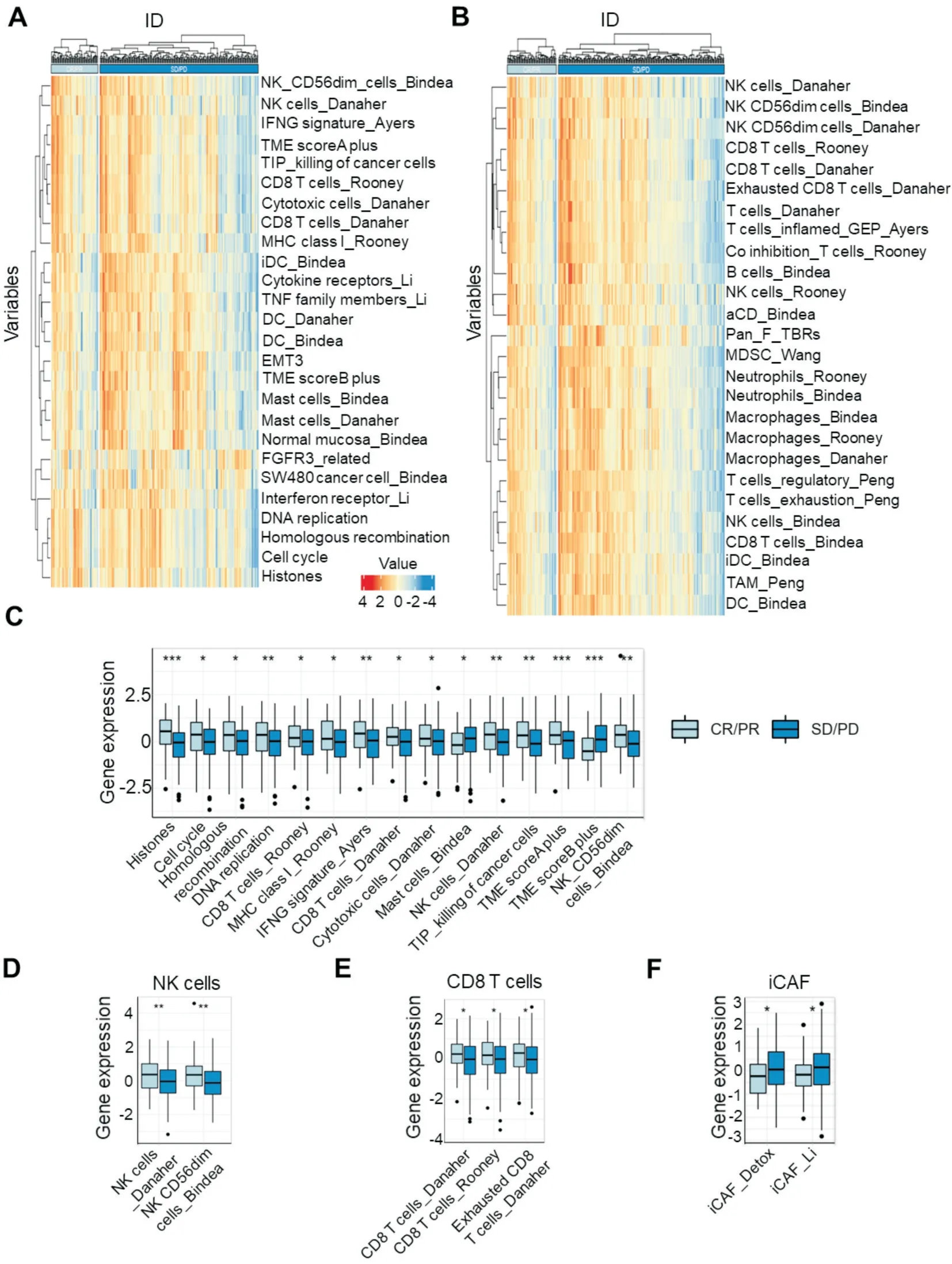
图2 肿瘤微环境和细胞组分分析 A:肿瘤微环境相关基因集热图;B:肿瘤微环境中相关细胞基因集热图;C:部分基因集箱式图统计方法:Wilcoxon 秩和检验,*为P<0.05,**为P<0.01,***为P<0.001
2.3 差异细胞与膀胱癌预后及病理分期分析
为了研究上述差异细胞与膀胱癌预后及病理分期的关系,我们利用CIBERSORT 计算TME 中活化NK 细胞和CD8+T 细胞的细胞分数并采用“Survminer”R 包计算细胞分数与患者总生存期间的最佳阈值。在TCGA 数据集中,按最佳阈值0.13将408 例患者分为活化NK 细胞基因集高表达组(n=309)和低表达组(n=99),生存分析提示活化NK 细胞基因集的表达水平与膀胱癌患者总生存期呈正相关(图3A,P=0.0011)。同时我们发现按最佳阈值0.16 将患者划分成CD8+T 细胞高表达组(n=287)和低表达组(n=121),如图3D 所示,CD8+T 细胞基因集高表达组的预后明显优于低表达组(P=0.00012)。如图3C 所示,PDGFRB 基因表达量与膀胱癌预后呈负相关(P=0.00089)。结果提示NK 细胞、CD8+T 细胞和PDGFRB 与膀胱癌患者的生存预后相关。
我们进一步分析差异细胞与膀胱癌病理分期的关系,发现NK 细胞标记物CD56(图3D,P<0.001)以及CAFs 标记物PDGFRB(图3F,P<0.0001)与膀胱癌病理分期呈正相关,而CD8+T 细胞标记物CD8A 在不同期患者中的表达量无显著差异(图3E,P=0.0934)。综上所述,NK 细胞、CD8+T 细胞和CAFs 与膀胱癌预后相关,NK 细胞和CAFs 与膀胱癌病理分期相关。

图3 差异细胞与膀胱癌预后及病理分期分析 A:活化NK 细胞基因集与膀胱癌总生存期分析;B:CD8+ T 细胞基因集与膀胱癌总生存期分析;C:PDGFRB 基因与膀胱癌总生存期分析(Kaplan Meier plotter);D:CD56 与膀胱癌病理分期;E:CD8A 与膀胱癌病理分期;F:PDGFRB 与膀胱癌病理分期
2.4 膀胱癌组织中CD8+ T 细胞、NK 细胞和CAFs的免疫组化分析
我们前期研究结果显示癌巢中CD8+T 细胞在低分期膀胱癌组织中高浸润[23]。本研究中我们又利用免疫组化对NK 细胞和CAFs 与膀胱癌病理分期的关系进行了细胞水平验证。如图4A 所示,将PDGFRB 染色强度分为0 到+3 四个等级。如图4B所示,半定量分析结果提示PDGFRB+CAFs 在不同期膀胱癌中浸润程度不同,其在Ⅲ期患者组织中浸润程度高于Ⅱ期患者(P<0.05),也高于Ⅰ期患者(P<0.01)。对NCR1+NK 细胞进行定量分析,发现NK 细胞浸润水平与膀胱癌病理分期无关(图4C,P=0.5334)。综上所述,TME 中CD8+T 细胞与膀胱癌病理分期呈负相关,CAFs 与膀胱癌病理分期呈正相关。
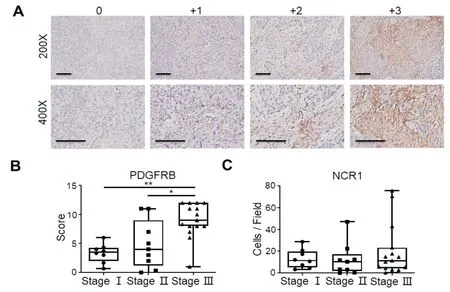
图4 膀胱癌组织验证 A:PDGFRB 染色强度分类;B:PDGFRB 在不同分期膀胱癌中的浸润水平(Kruskal-Wallis 检验);C:NCR1 在不同分期膀胱癌中的浸润水平(One-way ANOVA)比例尺为100 μm,*为P<0.05,**为P<0.01
2.5 BBN 诱导的自发小鼠膀胱肿瘤与人膀胱癌组织结构和浸润免疫细胞比较
上述生物信息学分析提示了与ICB 治疗疗效相关的信号通路、TME 组分以及细胞类型。接着我们通过BBN 连续饲养小鼠并构建自发小鼠膀胱成瘤模型。我们在不同时间点收获膀胱组织,H&E 染色发现四种主要的尿路上皮病理类型(图5A),包括正常尿路上皮(Normal)、异型性增生(Dysplasia)、非肌层浸润性膀胱癌(NMIBC)和肌层浸润性膀胱癌(MIBC)。我们将正常尿路上皮和异型性增生定义为非肿瘤病变(Non-tumor),NMIBC 和MIBC 定义为肿瘤病变(Tumor)。H&E染色结果提示:随着BBN 饲养时间的增加,膀胱肿瘤发生率保持上升趋势,第25 周以后,肿瘤发生率为100%(图5B);从第19 周开始MIBC 类型比例逐步增加(图5C)。在H&E 染色中,我们发现BBN小鼠膀胱肿瘤和人膀胱癌组织中的间质组分具有相似的分布(图5D)。利用连续切片,我们对人和BBN 小鼠膀胱肿瘤组织进行了免疫组化染色,定性分析发现α-SMA+或PDGFRB+CAFs、CD8+T 细胞以及NCR1+NK 细胞在人和小鼠组织中的浸润表型相似(图5D)。综上所述,BBN 诱导的自发小鼠膀胱肿瘤与人膀胱癌在疾病进展、间质分布和细胞浸润上具有一定相似性。
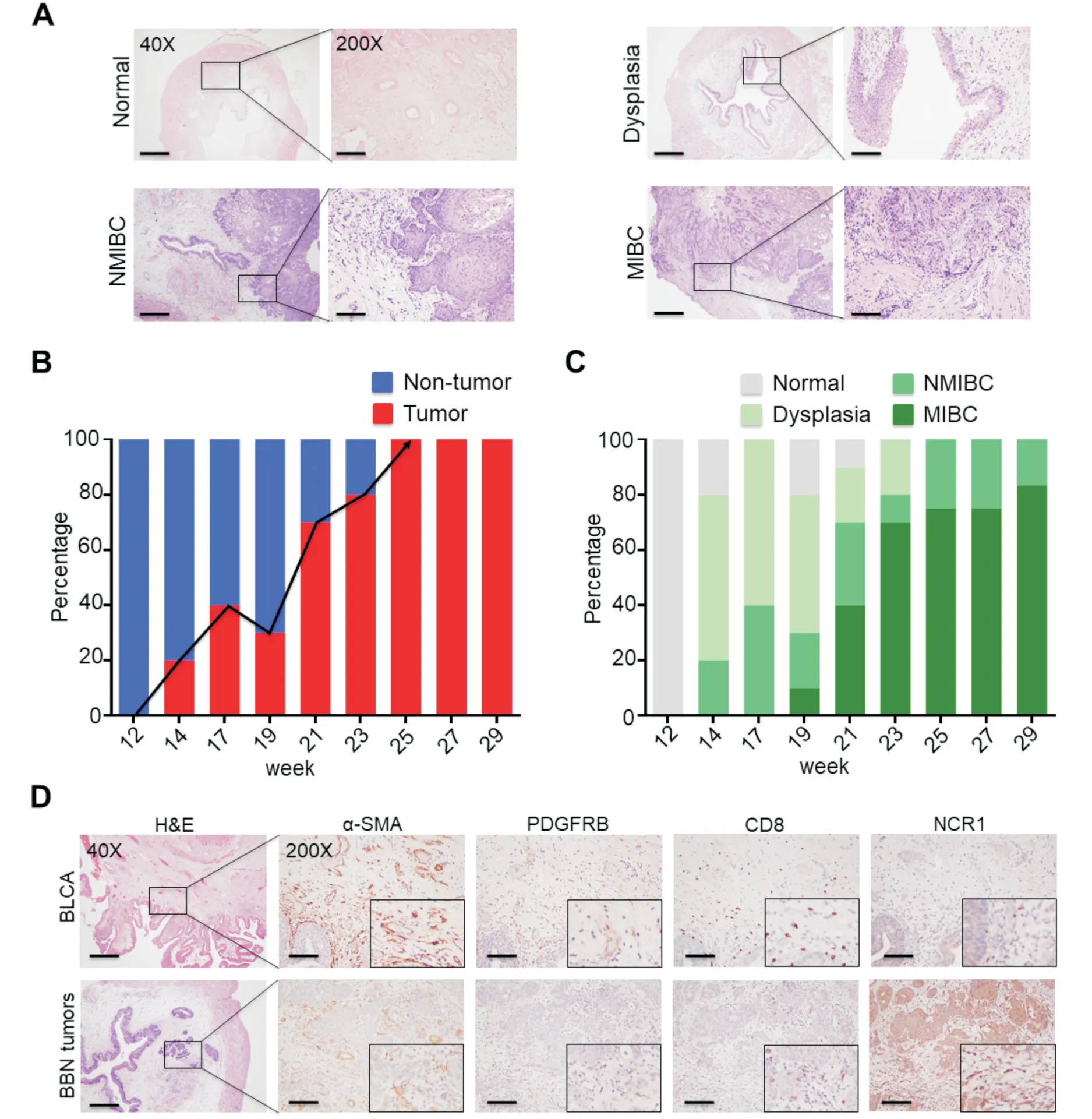
图5 BBN 诱导的自发小鼠膀胱肿瘤与人膀胱癌组织结构和免疫组成比较 A:四种病理类型的代表图,正常尿路上皮(Normal)、异型性增生(Dysplasia)、非肌层浸润性膀胱癌(NMIBC)和肌层浸润性膀胱癌(MIBC);B:小鼠膀胱成瘤率;C:膀胱病理类型频率分布;D:人膀胱癌(BLCA)和BBN 肿瘤(BBN tumors)中α-SMA+或PDGFRB+CAFs、CD8+ T 细胞和NCR1+NK 细胞的代表图40 ×代表图比例尺为500 μm,200 ×比例尺为100 μm,放大视野为400 ×
3 讨 论
膀胱癌中PD-1/PD-L1 阻断治疗具有一定疗效,但多数患者无法从中获益,TME 是影响其治疗疗效的关键因素,目前TME 组分如何影响免疫治疗疗效的机制尚不明确。本研究结合生物信息学分析和免疫组化鉴定了NK 细胞、CD8+T 细胞和CAFs 与膀胱癌患者免疫治疗疗效和生存预后、病理分期的相关性,建立了可用于评估TME 的自发小鼠膀胱成瘤模型,为加深理解免疫治疗的机理提供了新思路。
CD8+T 细胞和NK 细胞是机体免疫系统最主要的效应性细胞,但其在肿瘤进展和免疫治疗中的作用各不相同[24,25]。有研究对25 种肿瘤的TME浸润细胞进行分析发现CD8+T 和NK 细胞在不同肿瘤中的预后意义不同,例如在乳腺癌中CD8+T细胞和NK 细胞均与患者预后呈正相关,而在肺腺癌中与患者预后呈负相关[26]。CD8+T 细胞浸润与肿瘤患者预后及病理分期相关,有研究表明CD8+T 细胞在卵巢癌和胃癌内浸润越多,患者总生存时间越长[27,28];CD8+T 细胞在低分期的神经胶质瘤中浸润更多[29],但其在乳腺癌中与肿瘤高分级呈弱正相关[30]。CD8+T 细胞缺乏的“冷”肿瘤从免疫治疗中获益明显低于CD8+T 细胞浸润程度高的“热”肿瘤[31]。CD8+T 细胞在TME 中的组织分布也会影响其预后意义,卵巢癌和食管癌中的研究表明肿瘤癌巢内浸润的CD8+T 细胞而非间质内CD8+T细胞与患者预后呈正相关[32,33],而Chen 等报道膀胱癌中瘤内浸润的CD8+T 细胞与患者总生存期呈负相关[34]。黑色素瘤PD-1 阻断治疗前,TME 中预存的CD8+T 细胞对治疗时肿瘤消退至关重要[15]。其次ICB 治疗疗效也与肿瘤抗原负荷相关,肿瘤特异性CD8+T 细胞在启动阶段需要MHC-Ⅰ类分子呈递的肿瘤抗原[35]。在免疫治疗疗效预测模型中,CD8+T 细胞是PD-1/PD-L1 阻断治疗最佳的的疗效预测指标[36,37]。机制上,ICB 治疗依赖于T 细胞耗竭状态的逆转和干细胞样肿瘤浸润CD8+T细胞的增殖,其中TME 中TCF1+PD-1+CD8+T 细胞具有干细胞特性,能够介导免疫治疗中CD8+T 细胞的增殖反应[38]。多项研究也报道NK 细胞瘤内浸润程度和功能状态与患者预后相关[39,40]。NK细胞对循环肿瘤细胞具有免疫监视作用,一项晚期胃癌的研究表明外周血中循环NK 细胞的数量与患者总生存期呈正相关[28];而NK 细胞失活与肿瘤进展和转移相关[41]。NK 细胞在ICB 治疗中是独立于CD8+T 细胞的效应细胞,可以解释PD-1 阻断治疗对部分MHC-Ⅰ类分子缺乏的肿瘤依然有效以及T 细胞反应缺失时肿瘤仍能得到控制[42]。肿瘤外周NK 细胞激活状态和瘤内NK 细胞浸润程度均影响头颈鳞状细胞癌和非小细胞肺癌ICB 治疗的效果[43,44];有研究表明NK 细胞与黑色素瘤患者PD-1 阻断治疗疗效和患者总生存时间呈正相关,其分泌FLT3L 进一步激活瘤内DCs,NK-DCs 细胞轴是ICB 治疗中的积极预后因素[45]。与这些结果一致,本研究发现在膀胱癌中CD8+T 细胞和NK 细胞基因集高表达在膀胱癌免疫治疗有效组中,且其在TCGA 数据集中提示良好的预后意义,但CD8+T 细胞和NK 细胞在ICB 治疗中的具体作用机制仍需要进一步的研究。
CAFs 是TME中一类重要的抑制性细胞[46]。近年来的研究发现CAFs 可通过免疫抑制促进肿瘤进展[17]。本研究发现PDGFRB+CAFs 在高病理分期膀胱癌中浸润增加,且PDGFRB 基因高表达与膀胱癌患者不良预后相关,提示CAFs 与膀胱癌的预后及进展相关。CAFs 被报道与多种肿瘤的不良预后相关[47,48]。高表达PDGFRB 的CAFs 是影响乳腺癌预后的独立危险因素[49]。机制上,CAFs 分泌的TGF-β 通过抑制免疫细胞功能和产生免疫抑制环境参与肿瘤进展[50]。我们还发现PD-L1 治疗无效组患者中iCAFs 基因集表达的水平高,提示CAFs 可能参与膀胱癌免疫治疗抵抗。据报道,细胞外基质调节异常是PD-L1 阻断治疗失败的最强预测因素[51];TME 中CAFs 丰度与免疫治疗疗效相关[52]。CAFs 可分泌IL-6 和CXCL12 等募集并诱导髓系细胞分化为髓系来源的抑制性细胞(MDSCs),进一步影响免疫治疗疗效[53]。CAFs 也可上调CD8+T 上CTLA-4 表达,影响其瘤内浸润以抑制免疫治疗反应[54]。因此,加深理解CAFs 在膀胱癌中的免疫抑制机制并开发相关靶向药物具有重要的临床意义。
动物实验模型是开展肿瘤发病机制和治疗疗效评估的重要方法[55]。膀胱动物模型包括异位模型和原位模型等。皮下成瘤模型是最为常见的异位模型,其肿瘤恶性程度与细胞系种类直接相关[56]。人源细胞多异体种植于免疫缺陷鼠上,适合于研究肿瘤细胞表型改变,但不适用于肿瘤免疫学研究。膀胱原位模型有多种构建方式。常用的膀胱原位成瘤模型多通过小鼠经尿道膀胱灌注或膀胱肌层内注射肿瘤细胞构建,该模型有众多改良方案,但其操作困难且成瘤率不一[57]。利用Ptenfl/flp53fl/fl基因工程小鼠可成功构建与人相似的MIBC,进展过程包括NMIBC 期、MIBC 期和转移期,其分子分型接近于人basal-squamous 型膀胱癌,但该模型缺乏人膀胱癌的高负荷突变,价格昂贵,构建周期长[58,59]。BBN 是膀胱组织特异性的化学致癌物,其使用方法简单;BBN 诱导的小鼠膀胱成瘤效果好,具有完整的膀胱免疫屏障。我们利用BBN 诱导小鼠膀胱自发成瘤,初步结果显示BBN 诱导的自发小鼠膀胱肿瘤在疾病进展、间质分布和CD8+T 细胞、NK 细胞以及CAFs 浸润上与人膀胱癌组织相似。与我们的结果一致,Fantini D等报道BBN 小鼠膀胱肿瘤具有与人膀胱癌相似的高突变负荷,分子分型上接近于人basal 型膀胱癌,且其成瘤率高[60]。因此,BBN 诱导的自发小鼠膀胱成瘤模型可做为膀胱癌免疫治疗潜在的研究模型。
综上所述,本研究初步鉴定了NK 细胞和CD8+T 细胞与膀胱癌免疫治疗疗效呈正相关,而CAFs 与疗效呈负相关。这些细胞类群与膀胱癌患者的预后和/或病理分期相关。在BBN 诱导的自发小鼠膀胱肿瘤中,NK 细胞和CD8+T 细胞以及CAFs 的浸润特征与人膀胱癌组织类似,为进一步开展膀胱癌免疫治疗机制研究提供了理论依据和动物模型。

