BRAF 突变与甲状腺乳头状癌临床病理学特征关系研究
王培顺,李淑琴,王岩,汪瑞,高希涛,王昭昕,周军
随着人们对甲状腺疾病的新认识、临床病理诊断手段的进步以及细针穿刺活检的逐渐普及,甲状腺癌发病率逐年增高,其中甲状腺乳头状癌(papillary thyroid carcinoma,PTC)占所有甲状腺癌的80%~90%[1]。虽然PTC 进展缓慢且预后良好,但临床上通过患者年龄、转移程度、切除的完整性、局部浸润范围等来评估复发风险及预后尚有不足之处[2,3]。近年来,分子遗传学研究发现RAS、BRAF 突变和RET/PTC 重排会导致有丝分裂原活化蛋白激酶(MAPK)通路的异常激活,从而导致PTC 进展。其中,BRAF 突变是PTC 中最普遍的分子改变。因此,寻找抑制这些分子通路的靶向治疗有望成为将来的一个治疗方向[4,5]。本研究旨在探讨BRAF V600E 突变对PTC 临床过程的影响及其重要性。
1 资料与方法
1.1 一般资料
选取2018 年1 月至2019 年12 月在连云港市第一人民医院甲乳外科接受手术治疗的PTC 患者。本研究所有参与患者均得到本人或家属的知情同意,并报我院伦理委员会批准。纳入标准:①均接受手术治疗,且病理确诊为PTC;②有完整的术后病理组织标本;③患者无甲亢病史,也未接受甲状腺相关药物治疗;④有随访时间超过6 个月的完整资料。排除标准:①肿瘤伴严重纤维化或钙化,无法对其基因检测;②18 岁以下的未成年患者。根据上述筛选标准,最终选取符合标准的患者253 例。男69 例,女184 例。
1.2 研究方法
1.2.1 数据收集 数据收集包括性别、年龄、肿瘤位置(单侧/双侧)、肿瘤大小、多灶性、包膜外侵犯、甲状腺外扩散、桥本氏病、淋巴结清扫(中央区/侧区)和肿瘤(TNM)分期。根据(2017)美国癌症联合委员会(AJCC)第八版进行TNM 分期。收集癌组织并分析BRAF V600E 突变的存在。
1.2.2 BRAF 基因检测 手术切除的组织标本经甲醛溶液固定及石蜡包埋。切取肿瘤组织,使用DNA 提取试剂盒(厦门艾德公司)提取DNA。应用厦门艾德公司生产的检测试剂盒(ARMS 法),完全按照其说明书进行检测。提取癌组织的DNA 后,对BRAF 基因第15 号外显子进行实时荧光定量PCR测序,判断有无BRAF 突变。BRAF V600E 突变检测结果判断:待测样品的内控HE(或VIC)信号应升起;如待测样本外控FAM 信号的每个反应管内的荧光信号到达设定的域值时所经历的循环数(cycle threshold,Ct)≥28,则样本为阴性(野生型),如样本的FAM信号Ct值<28,则样本为阳性(突变型)。
1.3 统计学处理
采用SPSS 21.0 软件进行数据分析,计数资料采用例(比率)表示,计数资料间比较采用χ2检验或Fisher 确切概率法。进一步采用多因素Logistic回归分析。P<0.05 为差异有统计学意义。
2 结 果
2.1 PTC 患者临床特征及预后
253 例接受甲状腺手术的PTC 患者中,平均年龄为44.6±10.1 岁(18~79);肿瘤平均大小为1.7±0.8 cm(0.4~6.3 cm);术前未发现肺或骨等远处转移病例。患者中,实施单侧甲状腺全切加中央区淋巴结清扫76 例,双侧甲状腺全切加双侧中央区淋巴结清扫127 例,甲状腺全切除加双侧中央区淋巴结清扫加单侧颈侧区淋巴结清扫32 例。25.3%的患者为双侧,38.3%的患者发现多发肿瘤,分别有18.6%(47/253)和2.0%的患者出现包膜外侵犯和甲状腺外扩散,22.1%的患者患有桥本氏病。所有患者淋巴结转移率为25.3%(64/253),包括25.3%中央区LNM 和16.2%侧方LNM。最终病理分期中Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ分别为97(38.3%)、64(25.3%)、56(22.1%)和36(14.2%)。
患者随访期8~32 个月,平均随访18 个月。随访期间无死亡病例,无复发、转移病例。
2.2 BRAFV600E 突变患者的临床病理特征
253 例甲状腺乳头状癌组织中BRAF 基因突变为205 例,BRAF 基因突变率为81%。单因素分析显示,年龄>45 岁患者的基因突变率明显大于年龄≤45岁患者,差异有统计学意义(P<0.01)(见表1)。进一步将年龄分层(小于25 岁,25~35 岁,35~45 岁,45~55 岁,大于55 岁),结果显示BRAF 突变率随着年龄的增长而增加。BRAF 突变率在有无淋巴结转移组和临床分期Ⅰ、Ⅱ期组和Ⅲ、Ⅳ期组间比较,差异有统计学意义(P<0.05);而与性别、是否合并桥本氏病、家族史、肿瘤大小、是否侵犯血管、包膜外侵等临床特征无明显相关性(见表1)。BRAF 突变率在有无颈侧区淋巴结清扫组间比较,差异有统计学意义(P<0.05);而与有无中央区淋巴结清扫无明显相关性(见表1)。进一步多因素Logistic 回归分析显示年龄≥45 岁、高肿瘤分期、区域淋巴结转移是BRAF 突变的独立影响因素(均P<0.05)(见表3)。

表1 BRAF 突变检测与PTC 临床病理学特征的关系[n(%)]
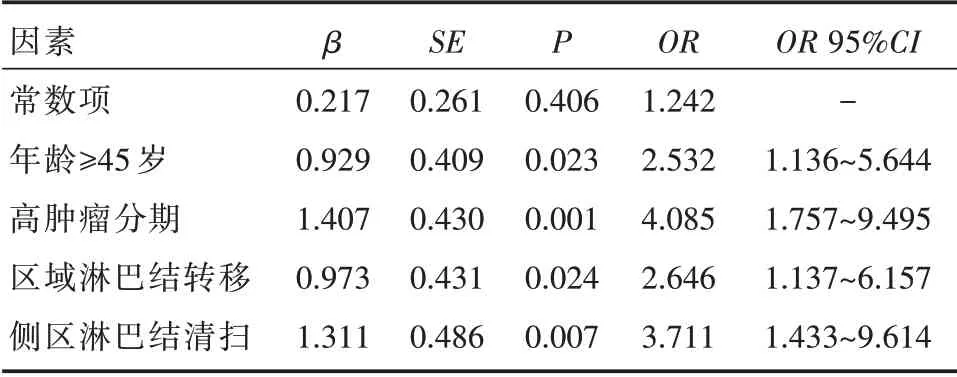
表3 BRAF 突变检测与PTC 临床病理学特征的多因素Logistic 回归分析
3 讨 论
细针穿刺(fine-needle aspiration,FNA)细胞学检查是甲状腺结节良恶性诊断的重要方法,基因检测可协助提高确诊率。BRAF在甲状腺FNA基因检测中研究得最多,BRAF 在PTC 中突变率较高,而在良性结节罕见突变,因此BRAF 成为PTC 非常重要的肿瘤标志物。本文目的在于进一步探究PTC 患者中BRAF 基因的突变率,及其与PTC 临床病理特征的关系。限于病灶细针穿刺技术水平以及细胞学诊断水平等原因,细针穿刺细胞学检查存在一定局限性,因此本文采用对术后病理标本行基因检测,提高了研究的准确性。结果显示BRAF 突变出现于81%的PTC 患者,而且BRAF 突变发生率随着PTC 患者年龄的增长而明显增加。据报道,PTC 患者中BRAF 基因的突变率高达36%~83%[6],而且由于各地碘摄取率的不同,尤其高发于亚洲国家[7]。本研究结果与文献报道基本一致。
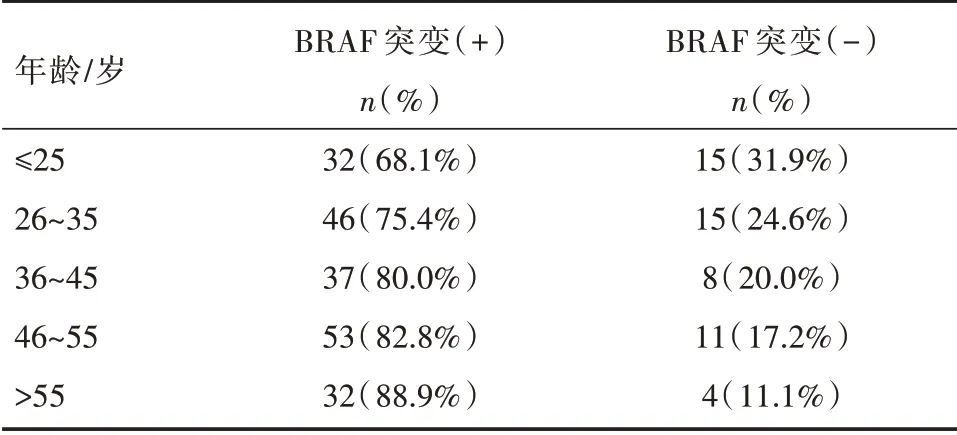
表2 BRAF 突变与年龄的关系[n(%)]
本研究中,BRAF 基因突变的发生率随着患者年龄增长而增加,同样符合既往研究[8]。最近的一篇报道中,同样发现了BRAF 突变与年龄的相关性[9],其中患者被分成5 个年龄段,BRAFV600E在≤25、26~35、36~45、46~55、>55 岁患者中的突变率依次为55%、80%、85%、88%、90%。而且,这一现象同样被发现于结直肠癌患者中[10]。
PTC 中存在多种基因的改变,包括BRAF 突变、RAS 突变、RET/PTC 重排等。其中,BRAF 突变在PTC 中最为常见。BRAF 突变激活MAPK 通路,从而引起细胞生长、增殖和分化[11]。有研究认为,BRAF 突变的PTC 患者往往肿瘤较大,容易侵犯包膜及血管,易于发生淋巴结转移[12]。而且具有较高的病理分期,临床上容易复发,预后较差[13]。然而,也有不少研究得出相反的结论。例如Mitsutake等[14]研究发现BRAF 基因突变与PTC 的侵袭性并无显著相关性。在本研究中,笔者通过比较在不同肿瘤大小、病理分期、是否淋巴结转移、是否包膜外侵及是否淋巴结清扫等患者中BRAF 的突变率,发现BRAF 突变的PTC 患者更容易出现局部淋巴结转移,而且明显增加颈侧区淋巴结清扫的概率。由于本团队仅在术中快速病理明确侧方淋巴结转移的情况下,予以治疗性颈侧区淋巴结清扫;而对于绝大多数PTC 患者,常规予以治疗性或预防性中央区淋巴结清扫。所以这也解释了本研究结果中BRAF 突变率与侧区淋巴结清扫明显相关(P<0.05),而与中央区淋巴结清扫无明显相关性。而肿瘤大小、是否侵犯血管、包膜外侵等其他侵袭性临床病理特征并未在本研究中表现出与BRAF突变率的明显相关性。本研究多因素Logistic回归分析显示:年龄大于等于45 岁、高肿瘤分期、区域淋巴结转移是BRAF 突变的独立影响因素(均P<0.05)。随着年龄增长,BRAF 更容易发生突变,从而导致肿瘤恶性程度增加,易于发生颈部淋巴结转移。较高年龄的淋巴结转移PTC 患者也因此具有较高的临床分期。
综上所述,本研究结果显示BRAF 在PTC 中有较高的突变率,有助于PTC 的临床确诊。BRAF 基因突变的PTC 具有较高的临床分期,更容易出现局部淋巴结转移,增加了颈侧区淋巴结清扫的概率,因此可以用来预测肿瘤的恶性程度。限于本研究病例数相对较少,且为单中心研究,尚需多中心更大样本量进一步研究探索。

