山药多糖的氨取代修饰和保润性能研究
白家峰,熊亚妹,刘远上,孙懿岩,刘绍华,贾学伟,许春平
(1.广西中烟工业有限责任公司技术中心,南宁 530001;2.郑州轻工业大学食品与生物工程学院,郑州 450002;3.河北中烟工业有限责任公司,石家庄 050000)
山药为薯蓣科薯蓣属,为薯蓣属植物地下块茎。由于块茎富含尿囊素、多糖、黏蛋白、各种维生素、皂苷和微量元素[1,2],具有降脂降压、延缓衰老、强健脾胃、抑制肿瘤等功效[3-6],是药食同源的植物[7],也是中国重要的出口特色蔬菜和保健品配料之一。
对多糖结构进行修饰是目前多糖领域的研究重点之一[8]。采取有效的方法对多糖结构修饰是增加其生物活性并促进其生物活性呈现的有效方式。如栾芳[9]通过化学修饰的方法,引入季铵基团,结果表明,季铵基团不仅能提高抗氧化能力,还能增强抑菌活性。季铵基团增强了壳聚糖衍生物的正电荷密度,季铵基团越多,活性越好。季铵基团是抑菌活性提高的主要因素,季铵基团越多,抑菌活性越好。季铵盐化多糖具有良好的亲水性、生物可降解性、生物相容性和抗菌活性等性能,在食品、医药和化妆品等领域具有潜在的应用价值[10]。
目前从天然植物中提取多糖作为新型的保润剂成为一个研究热点,相关报道表明这种新型保润剂不仅使烟丝能够保润防潮,降低烟气中的烟碱和焦油量,同时可以提高燃吸的感官质量,增加香味[11]。现在对天然植物多糖结构修饰的研究较多,但未见对山药多糖进行氨取代以及氨取代山药多糖的保润性能的研究。本研究对怀山药多糖进行氨取代修饰,并将修饰前后的多糖加入烟丝中进行保润性研究,以期为研制出一种新型烟草保润剂提供理论依据。
1 材料与方法
1.1 材料、试剂和仪器
材料:烟丝,河南中烟许昌卷烟厂;脱脂山药粉,产自河南焦作怀山药。
试剂:α-淀粉酶、CH3I、H2O2、NaCl、NaBH4、KBr,天津市大茂化学试剂厂;NaOH,天津市光复科技发展有限公司;氯仿,烟台市双双化工有限公司;正丁醇,天津市富宇精细化工有限公司;(3-氯-2-羟丙基)三甲基氯化铵溶液,德州曼巴商贸有限公司;丙二醇,天津市风船化学试剂科技有限公司;二甲基亚砜,郑州艾克姆化工有限公司;纤维素酶,江苏锐阳生物科技有限公司;BSTFA-TMCS(99∶1),东京化成工业株式会社。以上试剂均为分析纯。D6-二甲基亚砜(99.9%),郑州艾克姆化工有限公司,为色谱级。分子筛,上海麦克林生化有限公司。
仪器:SCIENTZ-10N冷冻干燥机、NB-DZF-6050真空干燥箱,郑州南北仪器设备有限公司;MSH280-Pro磁力搅拌机、Cence湘仪TDZ5-WS离心机、N-1100旋转蒸发仪,上海爱朗仪器有限公司;BINDER恒温恒湿箱、ATY124电子天平,上海本熙测控设备科技有限公司;MB-1-1封闭式调温加热器,北京科伟永兴仪器有限公司;DHG-914385-III电热恒温鼓风干燥箱,上海新苗医疗器械制造有限公司;Nicolet5700傅立叶变换红外光谱仪(FTIR),美国布鲁克海文仪器公司;尺寸排阻色谱-多角度激光光散射-示差折光联用仪(SEC/MALLS/RI),美国怀亚特技术公司;UV-17001C紫外分光光度计,上海凤凰光学科仪有限公司。
1.2 试验方法
1.2.1 山药多糖的提取取经乙酸乙酯脱脂过的山药粉200 g,加入0.9%(质量分数,下同)NaCl溶液4 000 mL,加热至50~60℃浸提。搅拌24 h后加入0.25%α-淀粉酶10 g和0.05%纤维素酶2 g进行酶解处理,调节温度为50℃左右,磁力搅拌24 h,静置3~4 h[12]。
将上述得到的混合溶液进行离心以完全分离渣和上清液,上清液加入比例为4∶1的氯仿与正丁醇,通过Sevage法[13]除蛋白,机械搅拌静置离心,重复3次,合并上清液并过滤浓缩至500 mL。渣先后经过0.03%NaBH4溶液和3%NaOH溶液共2 000 mL,0.05%NaBH4溶液和5%NaOH溶液共2 000 mL碱处理后,用醋酸中和,机械搅拌后静置离心,过滤浓缩分离上清液。用H2O2除色素,透析7 d,浓缩后冷冻干燥得到山药多糖。
1.2.2 氨取代山药多糖的制备称取山药多糖200 mg,加入0.5 mol/L NaOH溶液40 mL,磁力搅拌至多糖完全溶解。取(3-氯-2-羟丙基)三甲基氯化铵溶液1 mL缓慢加入多糖溶液中,继续在80℃水浴锅中加热搅拌8 h,透析7 d,浓缩后冷冻干燥得到氨取代山药多糖。
1.2.3 GC-MS单糖分析甲基化是一种可以测量多糖结构的化学分析方法,可以用于确定多糖中单糖残基之间的连接位置。以下方法根据文献[14]稍作修改。在N2保护下,将2.5 g NaH加入到25 mL DMSO中以获得甲基化试剂(SMSM),通过在SMSM中使用CH3I将10 mg多糖甲基化3次,然后在去离子水中透析并冷冻干燥。通过FT-IR检测甲基化多糖是否成功,然后加入2 mol/L三氟乙酸3 mL在120℃下水解6 h。用NaBH4还原部分甲基化的单糖,并用乙酸中和,然后在120℃下用乙酸酐乙酰化3 h。将样品用氮气吹干并溶解在CHCl3中。最后通过0.22μm膜过滤。
GC-MS条件[15]为:色谱柱为HP-5MS型弹性石英毛细管柱(30.0 m×250μm×0.25μm),进样量为1μL,采用程序升温,初始温度为80℃,保持2 min,以5℃/min的速度升温至240℃,分流比1∶1。氦气流速为1 mL/min,EI离子源70 eV,接口温度和离子源温度分别为200、240℃。
1.2.4 红外吸收光谱分析用分析天平分别称量3 mg氨取代山药多糖样品和山药多糖样品,与一定量的KBr混合均匀压成薄片,然后用FT-IR光谱仪在4 000~400 cm-1区间内扫描红外吸收值[16]。
1.2.5 核磁共振波谱分析用分析天平称量20 mg山药多糖样品,加入0.5 mL的D6-二甲基亚砜,配制成40 mg/mL溶液,在80℃条件下机械搅拌至溶解,静置后进行1HNMR、13CNMR测定[17]。所有化学位移的单位用ppm表示。
1.2.6 光散射分析分别用分析天平精确称量15 mg氨取代山药多糖样品和山药多糖样品。然后加入0.9%NaCl溶液5 mL,80℃下搅拌8 h至溶解。测试温度25℃,进样量100μL,流速为0.4 mL/min。流动相为0.02%NaN3和0.2%NaNO3水溶液,用Astra软件进行数据采集和分析[18]。
1.2.7 保润性能测试称取烟丝4份,每份20 g放入托盘中,放入恒温恒湿箱中,控制温度为22℃,相对偏差在1℃左右,相对湿度为60%,相对偏差在2%左右,在48 h内平衡烟草水分。之后分别称取氨取代山药多糖样品和山药多糖样品0.02 g溶于1.98 mL的去离子水中,配制2 mL 1%的丙二醇溶液,量取2 mL去离子水,将这4种溶液分别装入喷壶,均匀地喷洒在烟丝上;放入恒温恒湿箱中调节温度为22℃,相对偏差在1℃左右,湿度为60%,相对偏差在2%左右,平衡水分。平衡48 h后将托盘取出分别称量质量3次,取平均值记为m0;然后再放回恒温恒湿箱中,温度调为22℃,相对偏差在1℃左右,湿度为40%,相对偏差在2%左右,每隔6 h称量烟丝质量,计为m1,直至烟丝质量基本保持不变;然后将烟丝置于烘箱中,调节温度为105℃,烘至烟丝的质量基本没有变化[19],经过冷却后称取干烟丝的质量记为m。则烟丝的初始含水率(W0)为:

样品中的烟丝即时含水率(W)为:

以时间为横坐标,即时含水率为纵坐标制作烟丝的保润性能图[20]。
2 结果与分析
2.1 山药多糖的单糖分析
通过从山药中提取山药多糖,共得到山药多糖9.2 g,提取率为4.6%。甲基化用于分析单糖组成,由表1可知,在山药多糖中检测到糖链上残基类型主要构型为→4)-Glcp-(1→、→6)-Glcp-(1→、→6)-Galp-(1→、→3)-Manp-(1→、→2,3)-Manp-(1→和端基Glcp-(1→,除少量甘露糖(9.3%)和半乳糖(4.6%)外,山药多糖主要由葡萄糖(86.1%)组成。糖链主链主要由→4)-Glcp-(1→组成,含有少量末端糖基Glcp-(1→,糖链支化点应为→2,3)-Manp-(1→。

表1 山药多糖甲基化分析结果
2.2 红外光谱分析
在多糖的结构分析中,红外光谱可以识别多糖官能团,进行定性分析。图1是山药多糖及其氨基化修饰后的红外光谱图,在波数3 350 cm-1处有1个较宽的伸缩振动峰,是多糖羟基O-H的伸缩振动峰,C-H键在波数2 820 cm-1附近出现较强的吸收峰。1 700 cm-1处的吸收峰是由羰基C=O伸缩振动引起的。在波数1 050 cm-1处出现2个强吸收峰,是典型的吡喃糖苷的吸收峰。在波数1 350~1 500 cm-1区域的峰可以看出,山药多糖和氨取代山药多糖光谱有明显的差异,其中波数1 480 cm-1处是羟基与氨基结合基团的特征吸收峰[8],这说明氨取代修饰成功。

图1 傅里叶红外光谱
2.3 核磁共振波谱分析
核磁共振技术在研究糖链结构中起重要作用,其可以提供诸如单糖构型、糖苷键和与糖残基的连接序列之类的信息,为分析多糖结构提供最重要的数据。基于文献[21]可获得部分NMR光谱(1H,13CNMR)特征峰的归属。山药多糖的13CNMR如图2所示,碳的化学位移见表2,在异头碳区域,发现3个异头碳信号,依次标记为C1、C1′和C1″,其化学位移分别为100.7、97.4和92.5 ppm。由于C4去屏蔽导致其信号向低场移动大约9 ppm(C4信号从70 ppm移动至79 ppm),通过一维核磁初步判断山药多糖是α-1,4结构。

表2 山药多糖峰的化学位移
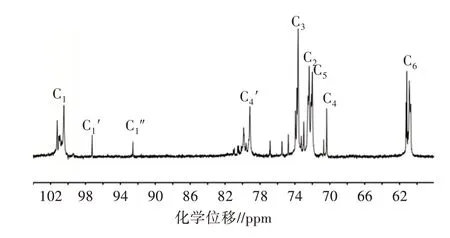
图2 山药多糖的一维核磁碳谱
对所有糖残基的1H进行归属,结果如图3所示,在13C谱图的异头碳吸收峰中,在100.7 ppm处的峰响应值较高,该异头碳信号所对应的异头氢信号为5.1~5.2 ppm,表明糖残基为典型的α构型,结合前文“2.1”中分析结果,证明山药多糖主链化学结构为α-1,4-葡聚糖,与淀粉结构类似。

图3 山药多糖的一维核磁氢谱
淀粉是各类植物储存能量和养分的主要方式,山药块茎中含有大量的淀粉。淀粉有直链和支链淀粉两大类,直链淀粉是D-葡萄糖基以α-(1,4)糖苷键连接的多糖链,支链淀粉分子中除有α-(1,4)糖苷键的糖链外,还有α-(1,6)糖苷键连接的分支。直链淀粉遇碘呈蓝色,支链淀粉遇碘呈紫红色。将8 g KI溶于100 mL去离子水中,待全部溶解后加入1 g I2,振荡溶解制成KI-I2溶液,验证所提山药多糖是否含有淀粉结构。山药多糖、提取多糖剩余的山药渣和标样淀粉均以相同浓度(0.2 mg/mL)溶于水中,滴加KI-I2溶液后,结果如图4所示。标样淀粉变蓝,山药渣也变蓝,颜色略浅,说明山药渣中含有淀粉结构;而所提山药多糖仍保持无色透明溶液,结合单糖分析和核磁的结果,说明其主链一级化学结构虽然类似淀粉,但是其侧链和空间结构与淀粉不同。

图4 淀粉、山药渣和山药多糖溶液滴加碘液后的颜色变化
2.4 山药多糖和氨取代山药多糖的SEC/MALLS/RI分析
山药多糖的链构象采用尺寸排阻色谱(SEC)-多角度光散射(MALLS)-示差折光仪(RI)分析,结果如图5所示。根据山药多糖经SEC色谱柱后不同流出时间的示差和光散射信号图,把图分为3个区域,其中组分1可能为山药多糖聚集体峰,组分2为多糖峰,组分3为溶剂峰。根据示差信号统计,聚集体所占质量分数为0.58%,含量较少,但是其粒径较大,因此光散射信号较强。采用Zimm图拟合方法处理,得到不同组分的分子大小和均方根旋转半径,结果如表3所示。由表3可知,组分1相对分子质量超过千万,与示差检测器结果结合可知,组分1应有少量的山药多糖聚集体。由于多糖具有多羟基结构,分子链又较大,因此易发生分子链直接相互缠结,出现聚集体,因此多糖溶液常出现单体和聚集体共存的情况。另外M w/M n称为多分散指数,用于阐明聚合物(如多糖)相对分子质量分布的宽度。Mw/M n的值越大,相对分子质量分布越宽。山药多糖多分散指数接近2,说明其分散程度较低,相对分子质量较为均一。

表3 山药多糖和氨取代山药多糖的相关分子参数

图5 山药多糖SEC/MALLS/RI色谱
通过测定不同相对分子质量级分的Mw与Rw连续试验数据点,并建立二者的函数关系,即Rw=K Mwα,指数α与在指定溶剂中大分子的形状和构象相关,可用于判断高分子在相应溶液中的链构象,其中logK为y轴上截距,α为直线斜率,通过计算得出K值为-1.34,α值为0.66,接近0.50~0.60,证明高分子在溶液中呈现无规线团链构象。采用SEC/MALLS/RI检测得到山药多糖的摩尔质量为1.747×105g/mol,远大于氨取代山药多糖摩尔质量1.115×104g/mol,说明衍生化后,山药多糖发生降解。另外经过氨基化修饰后,多糖的多分散系数增加,摩尔质量分布变宽,可能是因为氨基化过程中,在NaOH的作用下发生了不均匀的降解所致。
2.5 保润性能研究分析
在烟丝中分别添加1%丙二醇溶液、1%氨取代山药多糖溶液、1%山药多糖溶液和去离子水,放置恒温恒湿箱中,测定烟丝的含水率。由图6可知,丙二醇组的含水率为13.78%,山药多糖组的含水率为13.77%,氨取代山药多糖组的含水率为14.05%,去离子水组的含水率为13.62%。当恒温恒湿箱相对湿度调为40%时,随着时间的增加烟丝的含水率逐渐下降,但是丙二醇组和山药多糖组的含水率均高于去离子水组,24 h后4组烟丝的含水率趋于稳定。其中在前6 h内4组烟丝含水率下降速率均很快,前18 h丙二醇组烟丝的含水率平均下降速率(0.19%/h)明显小于氨取代山药多糖组(0.22%/h)、山药多糖组(0.23%/h)和去离子水组(0.22%/h)。最后趋于稳定时,丙二醇组烟丝的含水率为9.79%,相比于初始含水率下降了3.99个百分点,氨取代山药多糖组烟丝的含水率略低于丙二醇组,为9.66%,相比于初始含水率下降了4.39个百分点,山药多糖组烟丝的含水率是9.29%,相比于初始含水率下降了4.48个百分点,烟丝的含水率最低的组是去离子水组,为8.74%,相比于初始含水率下降了4.88个百分点。因此可以得出,相对于去离子水组来说,添加一定浓度的丙二醇溶液和多糖(包括山药多糖和氨取代山药多糖)溶液都能在一定程度上减缓水分散发的速度。糖类之所以具有保润效果可能是因为其结构中含有亲水性的基团羟基,通过与水分子作用产生氢键从而具有持水能力,可以捕获空气中的水分,还可以减少烟丝中的水分向空气中的挥发,因此可以维持烟丝中的水分含量处于稳定水平。氨取代山药多糖的保润性能优于山药多糖是由于其结构中含有氨基基团,因此吸湿能力强于山药多糖。但是氨取代多糖和山药多糖的保润效果没有传统的保润剂丙二醇好,原因可能是因为丙二醇的吸湿能力更强。

图6 山药多糖和氨取代山药多糖的含水率
3 小结
通过GC-MS法分析山药多糖的单糖组成,结果表明,山药多糖主要由葡萄糖(86.1%)、甘露糖(9.3%)、半乳糖(7.2%)组成。通过傅里叶红外分析山药多糖和氨取代山药多糖的官能团,表明氨取代修饰成功。用SEC/MALLS/RI分析山药多糖和氨取代山药多糖的摩尔质量及分子构象,结果表明,山药多糖的摩尔质量为1.747×105g/mol,多分散系数为2.027,均方根旋转半径为119.5 nm,表明高分子在溶液中呈现无规线团链构象。氨取代山药多糖的摩尔质量为1.115×104g/mol,多分散系数为3.582。通过核磁共振波谱分析和GC-MS分析,山药多糖组分主要为α-1,4-葡聚糖。山药多糖和氨取代山药多糖均具有一定的保润性,且氨取代山药多糖比山药多糖保润性更强,但效果略低于丙二醇。

