抑制组织蛋白酶B对脓毒症急性肺损伤小鼠肺组织细胞焦亡的影响
杨柳,刘强胜,张彬,何倩雯,李祯,刘安鹏,郑锋,詹佳*
1武汉大学中南医院麻醉科,武汉 430071;2湖北文理学院附属医院/襄阳市中心医院麻醉科,湖北襄阳 441000
脓毒症是由于入侵的病原体引起的免疫应答不能恢复到稳态,最终形成以持续的过度炎症及免疫抑制为特征的病理综合征[1]。近年来,虽然人们对脓毒症复杂病理机制的认识有所提升,并实施了早期目标导向治疗、使用抗生素及生命体征支持等治疗方案,但并未降低其高重症率及高病死率的现状[2]。随着对脓毒症诱导的免疫抑制在器官功能损伤方面研究的深入,靶向细胞焦亡通路的临床试验将为脓毒症患者的治疗提供更多的选择[3-4]。焦亡是由半胱天冬酶(caspase)-1介导的一类伴有炎性介质释放的程序性细胞死亡[5]。肺脏是脓毒症发生时极易损伤的器官之一[6],脓毒症早期即可发生急性肺损伤或急性呼吸窘迫综合征,与脓毒症的发病率及病死率密切相关[7]。在脓毒症发生过程中,激活的Toll样受体4(Toll-like receptor 4,TLR4)一方面通过上调含pyrin结构域核苷酸结合寡聚结构域样受体家族3(nucleotide-binding oligomerization domain,leucine- rich repeat and pyrin domain-containing 3,NLRP3)炎性小体促进细胞焦亡,另一方面通过激活MyD88及核因子(NF)-κB信号通路,上调IL-1RI的表达,增加细胞对IL-Iβ的敏感性,从而促进细胞焦亡,两者相互作用加重肺损伤[8]。所以,抑制肺组织细胞焦亡在脓毒症急性肺损伤的治疗中尤为重要。组织蛋白酶B(cathepsin B,CTSB)是一种在多种细胞中广泛表达的半胱氨酸蛋白水解酶[9],其表达异常增加或过度激活与炎症、感染、肿瘤及神经退行性疾病密切相关[10]。CTSB抑制剂的临床应用受到广泛关注,但其是否能通过抑制细胞焦亡从而改善脓毒症,目前尚未明确。本研究通过建立脓毒症小鼠急性肺损伤模型,探讨能否通过靶向抑制CTSB的表达抑制肺组织焦亡,从而改善脓毒症引起的急性肺损伤。
1 材料与方法
1.1 实验动物分组及处理 30只SPF级健康雄性C57BL/6小鼠,8~10周龄,体重(23±1) g,购自北京维通利华实验动物技术有限公司,饲养于武汉大学中南医院动物实验中心。采用随机数字表法分为3组:假手术组(n=6)、脓毒症组(n=15)及脓毒症+组织蛋白酶B抑制剂CA-074组(脓毒症+CA-074组,n=9)。脓毒症组及脓毒症+CA-074组均使用经典的盲肠结扎穿孔(cecal ligation and puncture,CLP)法[11]构建小鼠脓毒症模型:将小鼠用戊巴比妥钠60 mg/kg腹腔注射麻醉后,固定于手术台上,剔除手术部位体毛,消毒手术野,于剑突下1 cm沿腹中线作一条长1~2 cm的切口,打开腹腔,探取盲肠并分离,注意避免损伤血管及腹腔脏器。用4-0丝线小心结扎盲肠远端1/3处,于盲肠盲端至结扎部位的中点处,用20G无菌针头刺穿盲肠,挤出少许肠内容物后将盲肠放回腹腔,并逐层关腹。术毕皮下注射预热的37 ℃无菌生理盐水(5 ml/100 g)复苏,并在暖灯下观察至少2 h。假手术组除不行盲肠结扎及穿孔外,其他操作同脓毒症组。术后15 min,脓毒症+CA-074组小鼠腹腔注射10 mg/kg CA-074。实验过程符合国家及单位有关动物管理和使用的规定。
1.2 小鼠肺泡灌洗液中白细胞计数及白细胞介素(IL)-18、IL-1β水平检测 CLP术后24 h,将小鼠用戊巴比妥钠腹腔注射麻醉后固定于试验台上,颈部消毒,暴露右主支气管,注意避免伤及血管,用20G静脉留置针穿刺气管并结扎固定。1 ml磷酸缓冲盐溶液(PBS)缓慢注入肺部,轻轻挤压胸廓约3 s后回抽,将回抽液置于5 ml的Eppendorf 3810型微量离心管中,重复上述操作3次。将回收液于4 ℃下1500×g离心10 min,收集上清,-20 ℃保存,采用酶联免疫吸附实验(ELISA)检测细胞因子IL-18、IL-1β水平。采用改良牛鲍计数板计数下层液中白细胞的数量。
1.3 小鼠肺组织病理学变化及肺损伤评分 取右侧中叶肺组织,4%多聚甲醛固定,石蜡包埋、切片,将切片放入苏木精水溶液中染色数分钟,酸水及氨水中分色,流水冲洗脱水后,酒精伊红染色液染色2~3 min。染色完成后,脱水封片,光学显微镜观察。根据肺组织病理学变化(组织坏死、肺泡水肿、透明膜形成、出血及炎性细胞浸润等)进行肺损伤评分,视病变程度依次计为0~4分。无病变计0分,病变范围≤10%计0.5分,病变范围10%~25%计1分,病变范围25%~50%计2分,病变范围50%~75%计3分,病变范围>75%计4分,总分0~16分。
1.4 肺组织湿/干重比 取左侧肺组织,用吸水纸吸取表面水分及血液,称重为湿重(W)。置于65 ℃恒温烘箱中,每24 h称重1次,直至前后两次重量之差小于1%,记录为干重(D)。计算湿/干重比(W/D)。
1.5 RT-PCR法测定肺组织相关基因mR NA表达水平 取右上叶肺组织,采用Tr i z o l(国药集团化学试剂有限公司)法提取总R N A。按照EntiLinkTM1st Strand cDNA Synthesis Kit试剂盒(武汉ELK Biotechnology公司)使用说明进行反转录。以β-actin为内参照。引物序列如下:β-actin上游5'-CTGAGAGGGAAATCGTGCGT-3',下游5'-CCACAGGATTCCATACCCAAGA-3';小凹蛋白-1(caveolin-1)上游5'-AGGTGACTGAGAAGCAAGT GTATG-3',下游5'-CAAGCGGTAAAACCAATATTT TG-3';单核细胞趋化蛋白诱导蛋白1(MCPIP1)上游5'-CCCAAGCCTTCCACTCTAGAAC-3',下游5'-TTCCTCCAAGATGGCACAAAC-3';Caspase-1上游5'-GATGGCATTAAGAAGGCCCA-3',下游5'-CCC TATCAGCAGTGGGCATC-3';成孔效应蛋白D(gasdermin D,GSDMD)上游5'-CGTGGCAGGAGCA GAGTTCT-3',下游5'-ATAGAGCGCACTTGTGGGG A-3';CTSB上游5'-GCTGTCGGATGACCTGATTAA C-3',下游5'-ATCTATGTCCTCACCGAACGC-3'。按照EnTurboTMSYBR Green PCR SuperMix试剂盒(武汉ELK Biotechnology公司)说明书操作,采用10 μl体系进行PCR扩增。反应体系:2×Master Mix 5.0 μl,引物工作液(2.5 μmol/L)1.0 μl,模板1.0 μl,ddH2O 2.0 μl,PCR仪校正染料1.0 μl。反应条件:95 ℃预变性3 min;95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸30 s,共循环40次。使用StepOneTMReal-Time PCR仪(美国Life Technologies公司)进行扩增并分析处理数据。采用2-ΔΔCt法计算目的基因的相对表达量。
1.6 Western blotting测定肺组织中CTSB、caspase-1及G S D M D 蛋白表达水平 取右下叶肺组织50~100 mg,置于1~2 ml匀浆器中,用干净的剪刀将组织块剪碎,按照每20 mg组织150~250 μl裂解液的比例加入高效RIPA组织/细胞裂解液(美国ASPEN公司),冰上匀浆,于4 ℃下13 000×g离心15 min,收集上清并使用BCA法检测蛋白浓度。取40 μg总蛋白上样进行SDS-PAGE凝胶电泳,分离蛋白转印至PVDF膜,使用5%脱脂奶粉室温封闭2 h,以阻断非特异性结合,再加入兔抗鼠β-actin一抗(1:10 000)、兔抗鼠CTSB一抗(1:1000)、兔抗鼠caspase-1一抗(1:1000)、兔抗鼠GSDMD一抗(1:1000),以上抗体均购自武汉三鹰生物科技有限公司,4 ℃脱色摇床孵育过夜。用TBST在室温下脱色摇床上洗3次,每次10 min。使用上述方法稀释HRP山羊抗兔二抗(1:10 000,美国ASPEN公司),室温下孵育1~2 h,洗膜后ECL法显影。
1.7 统计学处理 数据采用SPSS 21.0及GraphPad Prism 8进行统计分析。正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较用LSD-t检验及Tamhane's T2检验。计数资料以例(%)表示,组间比较采用卡方检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结 果
2.1 CLP术后24 h小鼠基本情况及存活率 与术前相比,假手术组小鼠术后24 h基本情况无明显变化,存活率100.0%;脓毒症组小鼠出现背部竖毛、行动迟缓、厌食、精神萎靡、寒颤抽搐等症状,存活率为40.0%(6/15);脓毒症+CA-074组小鼠的上述症状有不同程度的缓解,存活率为66.7%(6/9)。与假手术组比较,脓毒症组小鼠24 h存活率明显降低(P<0.05);脓毒症+CA-074组与脓毒症组小鼠存活率无明显差异(P>0.05)。
2.2 各组小鼠肺组织病理变化 假手术组肺泡结构清晰,肺泡壁不厚,肺间质内几乎无炎性细胞浸润;与假手术组比较,脓毒症组肺泡结构破坏严重,肺泡间隔增厚及水肿,肺间质中见大量炎性细胞浸润及点状或片状出血灶;与脓毒症组比较,脓毒症+CA-074组肺泡结构破坏减轻,肺间质水肿缓解,间质内炎性细胞浸润减少(图1)。
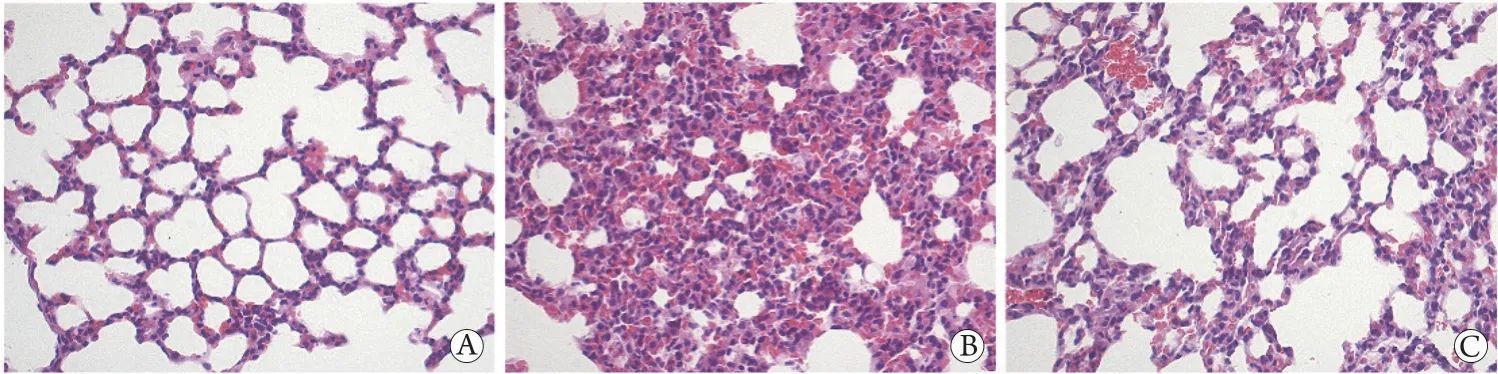
图1 各组小鼠肺组织病理学变化(HE染色,×400)Fig.1 Pathological changes of lung tissues of mice in each group (HE ×400)
2.3 各组小鼠肺组织相关指标比较 与假手术组比较,脓毒症组损伤性指标caveolin-1mRNA水平明显升高,修复性指标MCPIP1mRNA水平明显降低,肺损伤评分增加,肺组织湿/干重比增加,差异有统计学意义(P<0.05);与脓毒症组相比较,脓毒症+CA-074组caveolin-1mRNA水平降低,MCPIP1mRNA水平升高,肺损伤评分降低,肺组织湿/干重比降低,差异有统计学意义(P<0.05,表1)。
表1 各组小鼠肺组织中caveolin-1及MCPIP1 mRNA水平、肺损伤评分及肺组织湿/干重比值比较 (±s,n=6)Tab.1 Comparison of caveolin-1 and MCPIP1 mRNA level, lung injury score and wet/dry weight ratio of lung tissues of mice in each group (±s, n=6)

表1 各组小鼠肺组织中caveolin-1及MCPIP1 mRNA水平、肺损伤评分及肺组织湿/干重比值比较 (±s,n=6)Tab.1 Comparison of caveolin-1 and MCPIP1 mRNA level, lung injury score and wet/dry weight ratio of lung tissues of mice in each group (±s, n=6)
Caveolin-1. 小凹蛋白-1;MCPIP1. 单核细胞趋化蛋白诱导蛋白1;与假手术组比较,(1)P<0.05;与脓毒症组比较,(2)P<0.05
组别 Caveolin-1 mRNA MCPIP1 mRNA 肺损伤评分(分) 肺组织湿/干重比假手术组 1.00±0.09 0.98±0.13 0.93±0.27 5.37±0.52脓毒症组 3.01±0.34(1) 0.24±0.02(1) 11.35±1.73(1) 14.32±2.16(1)脓毒症+CA-074组 1.77±0.15(1)(2) 0.55±0.07(1)(2) 8.45±2.36(1)(2) 11.12±2.01(1)(2)F 126.889 103.084 60.091 41.235 P<0.001 <0.001 <0.001 <0.001
2.4 各组小鼠炎性指标比较 与假手术组比较,脓毒症组肺泡灌洗液中白细胞计数增加,焦亡相关炎性因子IL-18、IL-1β水平上升,差异有统计学意义(P<0.05);与脓毒症组比较,脓毒症+CA-074组白细胞计数减少,IL-18、IL-1β水平降低,差异有统计学意义(P<0.05,表2)。
表2 各组小鼠肺泡灌洗液中白细胞计数及IL-18、IL-1β水平比较 (±s,n=6)Tab.2 Comparison of leukocytes count, IL-18 and IL-1β levels in BALF of mice in each group (±s, n=6)
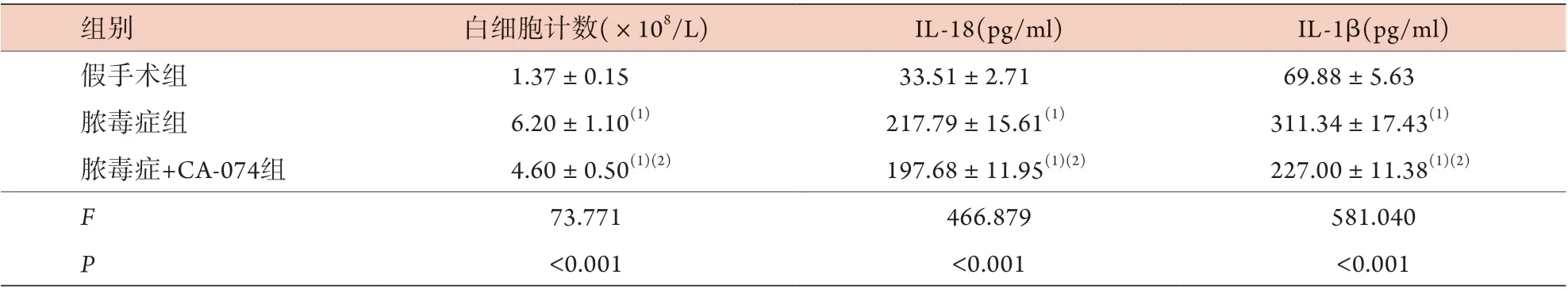
表2 各组小鼠肺泡灌洗液中白细胞计数及IL-18、IL-1β水平比较 (±s,n=6)Tab.2 Comparison of leukocytes count, IL-18 and IL-1β levels in BALF of mice in each group (±s, n=6)
IL-18. 白细胞介素-18;IL-1β. 白细胞介素-1β;BALF. 支气管肺泡灌洗液;与假手术组比较,(1)P<0.05;与脓毒症组比较,(2)P<0.05
组别 白细胞计数(×108/L) IL-18(pg/ml) IL-1β(pg/ml)假手术组 1.37±0.15 33.51±2.71 69.88±5.63脓毒症组 6.20±1.10(1) 217.79±15.61(1) 311.34±17.43(1)脓毒症+CA-074组 4.60±0.50(1)(2) 197.68±11.95(1)(2) 227.00±11.38(1)(2)F 73.771 466.879 581.040 P<0.001 <0.001 <0.001
2.5 各组小鼠肺组织CTSB、caspase-1及GSDMDmRNA表达水平比较 与假手术组比较,脓毒症组中CTSB、caspase-1及GSDMDmRNA表达增高,差异有统计学意义(P<0.05);与脓毒症组比较,脓毒症+CA-074组中CTSBmRNA表达无明显变化(P=0.973),caspase-1及GSDMDmRNA表达下降,差异有统计学意义(P<0.05,表3)。
表3 各组小鼠肺组织中CTSB、caspase-1及GSDMD mRNA表达水平比较(±s,n=6)Tab.3 Comparison of the expression levels of CTSB, caspase-1 and GSDMD mRNA in lung tissues of mice in each group (±s,n=6)

表3 各组小鼠肺组织中CTSB、caspase-1及GSDMD mRNA表达水平比较(±s,n=6)Tab.3 Comparison of the expression levels of CTSB, caspase-1 and GSDMD mRNA in lung tissues of mice in each group (±s,n=6)
组别 CTSB mRNA Caspase-1 mRNA GSDMD mRNA假手术组 0.99±0.08 1.00±0.06 1.00±0.18脓毒症组 5.31±0.26(1) 6.33±0.29(1) 11.17±0.41(1)脓毒症+CA-074组 5.32±0.32(1) 4.83±0.23(1)(2) 9.87±0.39(1)(2)F 618.739 940.458 1536.724 P<0.001 <0.001 <0.001
2.6 各组小鼠肺组织CTSB、caspase-1及GSDMD蛋白表达水平比较 与假手术组比较,脓毒症组CTSB、caspase-1及GSDMD蛋白表达明显增加,差异有统计学意义(P<0.05);与脓毒症组比较,脓毒症+CA-074组中CTSB、caspase-1及GSDMD蛋白表
CTSB. 组织蛋白酶B;Caspase-1. 半胱天冬酶-1;GSDMD.成孔效应蛋白D;与假手术组比较,(1)P<0.05;与脓毒症组比较,(2)P<0.05达明显减少,差异有统计学意义(P<0.05,图2)。
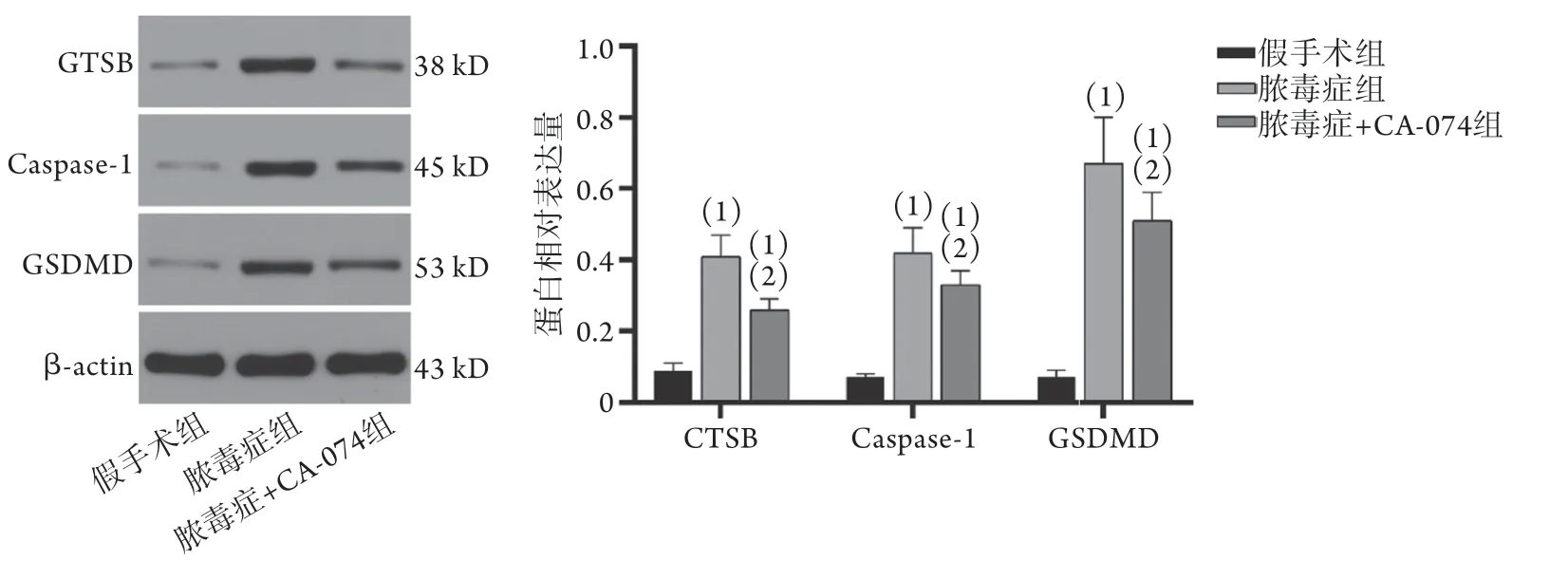
图2 各组小鼠肺组织中CTSB、caspase-1及GSDMD蛋白表达水平比较Fig.2 Comparison of the expression levels of CTSB, caspase-1 and GSDMD protein in lung tissues of mice in each group
3 讨 论
Caveolin-1是细胞质膜微囊(caveolae)的重要组成部分,在保持微囊完整性、囊泡的运输及细胞信号传导中起一定作用。有研究表明,caveolin-1及微囊在免疫细胞中的普遍分布提示它们可能与脓毒症有关[12],并且caveolin-1在炎症反应强烈的区域表达增多[13],是反映炎症损伤的指标。MCPIP1作为一种炎症信号传导抑制因子,在维持内皮细胞的稳态及功能中起重要作用[14],是反映组织修复的指标。本研究结果显示,与假手术组比较,脓毒症组小鼠肺组织湿/干重比增加,损伤性指标caveolin-1mRNA表达水平增高,修复性指标MCPIP1mRNA表达水平下降,肺损伤评分增加,且出现了竖毛、腹泻、精神萎靡、活动能力减退等脓毒症相关症状,存活率明显降低,表明脓毒症肺损伤模型制备成功。
细胞焦亡是一类由caspase-1介导炎症介质释放引起的程序性细胞死亡,在感染、炎症及免疫性疾病中扮演重要的角色[15]。CTSB是一种在多种细胞中广泛表达的半胱氨酸蛋白水解酶,主要存在于溶酶体中[16],它能降解通过内吞或吞噬作用进入细胞的蛋白,还能降解细胞内的细胞器及通过自噬处理的蛋白[17],参与细胞凋亡、抗原提呈、炎症反应、细胞自噬及细胞外基质降解等多种病理生理过程[18]。在脓毒症小鼠模型中,中性粒细胞胞外诱捕网导致溶酶体破裂,触发CTSB的释放,诱导NLRP3炎性小体的形成及caspase-1的激活[19],活化的caspase-1一方面刺激IL-18及IL-1β转化为成熟的炎性因子[19-20],另一方面切割GSDMD形成可以在细胞上成孔的GSDMD-N片段,诱导细胞穿孔、破裂,释放大量炎性介质[20]。caspase-1及GSDMD作为细胞焦亡通路的重要介质,是评价细胞焦亡的重要指标。本研究结果显示,与假手术组比较,脓毒症组CTSB、焦亡相关炎性因子IL-18和IL-1β,以及焦亡相关蛋白caspase-1、GSDMD的表达水平明显增加,表明CTSB可能在脓毒症急性肺损伤的肺组织焦亡中发挥调节作用。
CTSB是存在于各种生物体内的半胱氨酸蛋白酶,在溶酶体内通过激活其他蛋白水解酶系统、活化某些酶原或激素前体肽的方式参与蛋白质的加工及降解[21]。异常的CTSB表达增加或激活增强在炎症、感染、肿瘤及神经退行性疾病等病理状态下起关键作用[10]。因此,CTSB特异性抑制剂的应用为这些疾病的治疗提供了新的靶点。目前,通过结构导向设计的CTSB人源化抗体抑制剂(商品名:赫赛汀)已用于乳腺癌的临床治疗。而一种新型的抗体-前肽融合技术,能够使CTSB抑制剂在纳米水平呈现高特异性,也处于研发阶段[22]。由此可见,CTSB抑制剂具有广泛的临床应用前景。有研究发现,CTSB的表达增加促进了NLRP3炎性小体的激活,而使用CTSB抑制剂后,可减轻NLRP3炎性小体的激活[23]。因此,本研究参照文献的方法,使用10 mg/kg CTSB抑制剂CA-074腹腔注射[24],探讨CTSB在脓毒症肺损伤中的作用。结果显示,与脓毒症组相比,脓毒症+CA-074组caveolin-1表达水平降低,MCPIP1表达水平升高,肺组织湿/干重比降低,肺损伤评分降低,表明CTSB抑制剂CA-074有改善肺损伤、促进肺组织修复的作用。使用CTSB抑制剂CA-074后,焦亡相关炎性因子释放减少,焦亡相关蛋白caspase-1及GSDMD表达降低,提示抑制CTSB可阻断肺组织焦亡途径,减轻肺损伤。使用CTSB抑制剂CA-074后,与脓毒症组相比,CTSB蛋白表达降低,而CTSBmRNA无明显改变,提示CA-074不影响CTSB的转录水平,可能参与翻译水平或者降解途径的调节,具体机制有待后续进一步研究。CA-074作为CTSB的特异性抑制剂,其减轻肺损伤的机制可能与干扰NLRP3激活,从而抑制焦亡有关。与脓毒症组相比,脓毒症+CA-074组小鼠存活率无明显差异,可能与样本量太少,或观察时间过短等原因有关。但本研究尚存在以下不足:(1)仅进行了单次给药术后24 h的形态学分析及指标检测,后续将对长期用药实验后的生存情况及炎症损伤进行评估。(2)本研究发现抑制CTSB表达可以减轻肺组织焦亡,但其具体机制仍需要进一步深入研究。
综上所述,在脓毒症急性肺损伤中,CTSB表达增高可导致肺组织焦亡,抑制CTSB表达可阻断肺组织焦亡途径,从而改善脓毒症急性肺损伤。

