PRDX6在多囊卵巢综合征患者中的表达变化及其与糖脂代谢、性激素水平的相关性分析
周玲,廖明钰,李行,沈如飞,张玉玲,彭桂亮,郑宏庭,隆敏*
1陆军军医大学第二附属医院内分泌科,重庆 400037;2南京大学医学院附属金陵医院内分泌科,南京 210016
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是以月经紊乱、高雄激素血症、卵巢多囊样改变为主要临床特征的生殖内分泌疾病[1-2]。有研究发现,超过50%的PCOS患者超重或肥胖[3],提示PCOS易引起糖尿病。PCOS和2型糖尿病(T2DM)两种疾病联系紧密,临床应加强肥胖PCOS患者的糖尿病筛查。T2DM是一种胰岛素抵抗或分泌不足引起的慢性代谢性疾病,可导致糖脂代谢异常及相关代谢紊乱[4-5],继而引发心血管疾病、肝脏病变等,严重威胁人类健康[6-7];另有研究发现,肥胖与T2DM的发病率呈正相关[8]。近年来,越来越多的研究发现,过氧化还原酶6(peroxidoreductase 6,PRDX6)参与了细胞氧化还原过程,可调节磷脂代谢转换并保护细胞免受氧化损伤[9],并参与了动脉粥样硬化和T2DM的发病,但其在肥胖中的作用尚不清楚[10];此外还有研究发现,PRDX6参与了脂肪酸代谢等氧化还原过程[11-12]。但鲜有PCOS患者血浆PRDX6与糖脂代谢和性激素指标相关性的研究。因此,本研究分析了血浆PRDX6在PCOS患者中的表达变化及其与糖脂代谢、性激素指标的相关性,旨在为将其作为PCOS潜在的治疗靶点提供依据。
1 资料与方法
1.1 研究对象 本研究为回顾性病例对照研究。收集2020年1-10月就诊于陆军军医大学第二附属医院的47例PCOS患者(PCOS组)的临床资料,年龄为23~31(27.1±4.2)岁,并收集同期在本院体检中心体检的60名健康女性作为健康对照组,年龄为21~31(26.3±5.1)岁。进一步根据体重指数(BMI)分为两个亚组:正常体重组(BMI≤24 kg/m2,其中PCOS组17例、健康对照组36名)与超重体重组(BMI>24 kg/m2,其中PCOS组30例、健康对照组24名)。PCOS诊断采用2003年鹿特丹标准[13],即满足以下3条中的任意2条:(1)排卵稀发或无排卵;(2)高雄激素血症的临床和(或)生化证据;(3)多囊卵巢。纳入标准:在符合PCOS诊断标准的基础上,仅纳入年龄为23~31岁的患者;排除标准[14]:(1)通过相应检查排除甲状腺功能障碍(甲状腺功能八项)、高催乳素血症(血清催乳素)、库欣综合征(皮质醇节律)、先天性肾上腺皮质增生(17α-羟孕酮)、肾上腺肿瘤(肾上腺CT)、妇科恶性肿瘤(妇科彩超)等疾病;(2)近1个月内使用激素或降糖药物;(3)有酗酒或药物滥用史。本研究获陆军军医大学第二附属医院伦理委员会批准(2020-研第124-01),所有患者均签署知情同意书。
1.2 研究方法
1.2.1 检测指标及定义 测量所有受试对象的身高、体重、臀围(H)、腰围(W),计算体重指数(BMI)和腰臀比(WHR)。所有研究对象采血要求空腹8 h,次日清晨采集3 ml静脉血,且入院后均在同一时间用水银测压计连续测量右臂血压3次,取后两次血压平均值记录收缩压(SBP)和舒张压(DBP),检测空腹血糖(FBG)、尿酸(UA)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、糖化血红蛋白(HbA1c)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰转肽酶(γ-GGT)、尿素氮(UREA)、肌酐(CREA)、白细胞计数(WBC)、空腹胰岛素(FINS)、睾酮(T)、促黄体素(LH)、促卵泡素(FSH)、雌二醇(E2)、孕酮(P)、催乳素(PRL)水平。其中FBG和UA测定采用酶法,TC、TG、HDL、LDL采用比色法,HbA1c采用阴离子交换高效液相色谱法,ALT、AST、γ-GGT、UREA、CREA、WBC采用荧光染色法,FINS、T、LH、FSH、E2、P、PRL采用化学发光免疫分析法。计算稳态模型评估的胰岛素抵抗指数(HOMA-IR)[HOMA-IR=FINS(mU/L)×空腹血糖(mmol/L)/22.5]、胰岛β细胞功能(HOMA-β)[H O M A-β=(F I N S×2 0)/(空腹血糖-3.5)]、BMI[BMI=体重(kg)/身高(m)2]、WHR[WHR=腰围/臀围]及促黄体素/促卵泡素(LH/FSH)比值。疾病定义如下:糖尿病(FBG >7 mmol/L)、高脂血症(TG >1.7 mmol/L或TC >5.2 mmol/L)、胰岛素抵抗(HOMA-IR >2.5)、高血压(SBP >139 mmHg)。
1.2.2 血浆PRDX6水平测定 外周静脉血3000 r/min(离心半径为140 mm)离心5 min,收集部分血浆于-80 ℃冻存。采用武汉云克隆科技股份有限公司(货号:SEF756Hu;批号:L200515133)的ELISA试剂盒进行PRDX6水平测定。试剂盒的最低检测浓度为0.114 ng/ml,可测浓度范围为0.312~20.000 ng/ml,批内差<10%,批间差<12%。
1.2.3 指标分析 对PCOS组与健康对照组的血浆PRDX6及糖脂代谢、性激素水平进行比较,然后进一步分析PRDX6与糖脂代谢、性激素水平的相关性,并通过受试者工作特征(ROC)曲线分析PRDX6对糖脂代谢和性激素指标的诊断效能。
1.3 统计学处理 采用SPSS 22.0(IBM Co.,USA)软件进行统计分析。计量资料符合正态分布的以±s表示,两组间比较采用t检验,不符合正态分布的采用M(Q1,Q3)表示,组间比较采用非参数检验;计数资料以例(%)表示,两组间比较采用χ2检验。当血浆PRDX6水平与一般临床资料、糖脂代谢及性激素的关系符合正态分布时采用Pearson相关分析,不符合正态分布时采用Spearman相关分析。采用ROC曲线分析PRDX6对糖脂代谢和性激素指标的诊断效能。P<0.05为差异有统计学意义。
2 结 果
2.1 两组血浆PRDX6水平比较 PCOS组患者的血浆PRDX6水平较健康对照组升高约2.3倍,差异有统计学意义(P<0.0001);BMI>24 kg/m2时,PCOS组患者的血浆PRDX6水平较健康对照组升高约4.86倍,差异有统计学意义(P<0.0001);BMI<24 kg/m2时,PCOS组患者的血浆PRDX6水平较健康对照组升高约1.95倍,差异有统计学意义(P<0.0001)。
2.2 两组临床资料比较 PCOS组BMI、体重、DBP、γ-GGT、UA、CREA和WBC高于健康对照组(P<0.05),且糖尿病、高脂血症、胰岛素抵抗的患病率高于健康对照组(P<0.05);当BMI≤24 kg/m2时,PCOS组UA、CREA高于健康对照组(P<0.05),AST低于健康对照组(P<0.05),且胰岛素抵抗患病率高于健康对照组(P<0.05);当BMI>24 kg/m2时,PCOS组DBP、ALT、AST、γ-GGT、UA和WBC高于健康对照组(P<0.05),高脂血症和胰岛素抵抗患病率高于健康对照组(P<0.05)(表1)。
2.3 两组糖脂代谢和性激素指标比较 糖脂代谢指标方面,PCOS组TG、LDL、FINS、HbA1c、HOMA-IR和HOMA-β高于健康对照组(P<0.05),HDL低于健康对照组(P<0.05);当BMI≤24 kg/m2时,PCOS组FBG低于健康对照组(P<0.05);当BMI>24 kg/m2时,PCOS组TG、LDL、FINS、HbA1c、HOMA-IR和HOMA-β高于健康对照组(P<0.05),HDL低于健康对照组(P<0.05)。性激素指标方面,PCOS组T、LH和LH/FSH高于健康对照组(P<0.05),E2和P低于健康对照组(P<0.05);当BMI≤24 kg/m2时,PCOS组T和LH/FSH高于健康对照组,E2和P低于健康对照组(P<0.05);当BMI>24 kg/m2时,PCOS组T、LH、LH/FSH高于健康对照组(P<0.05),E2和P低于健康对照组(P<0.05)(表2)。
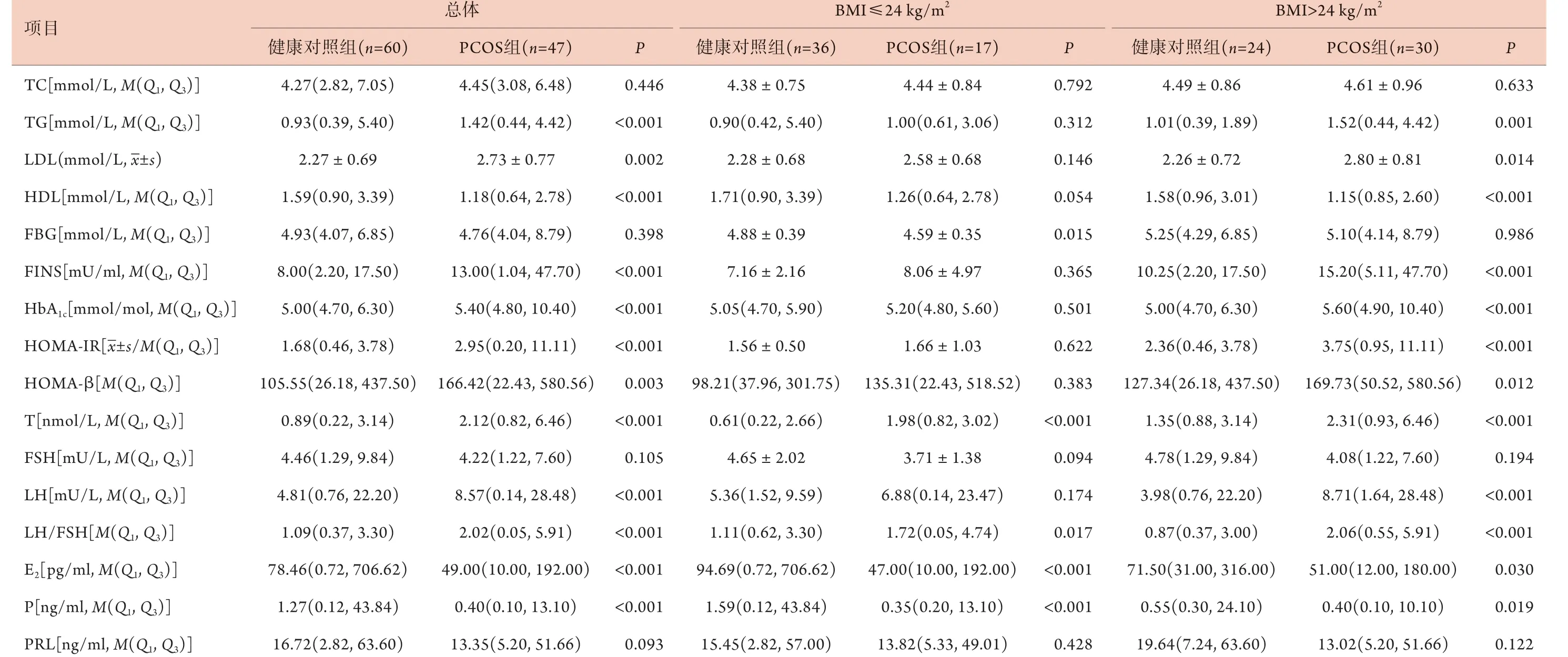
表2 PCOS组与健康对照组糖脂代谢和性激素指标的比较Tab.2 Comparison of glucose and lipid metabolism and sex hormone indexes between PCOS group and healthy group
2.4 P R DX 6 水平与糖脂代谢和性激素指标的相关性 由于PCOS组BMI明显高于健康对照组[(24.27±2.82) kg/m2vs. (23.24±1.93) kg/m2,P=0.035,表1],因此,采用偏相关校正BMI后进行相关性分析,结果显示,血浆PRDX6水平与HDL呈负相关(r=-0.225),与TG、LDL、HOMA-β呈正相关(r分别为0.223、0.229、0.201,P<0.05);此外,血浆PRDX6水平与T、LH、LH/FSH呈正相关(r分别为0.397、0.251、0.279,P<0.01),与E2、P呈负相关(r分别为-0.249、-0.231,P<0.05)(表3)。
当BMI≤24 kg/m2时,PCOS组与健康对照组BMI差异无统计学意义(P=0.613,表1),因而无需校正BMI。相关分析显示,血浆PRDX6水平与SBP呈负相关(r=-0.382,P<0.05),与其他糖脂代谢指标无相关性(P>0.05);此外,血浆PRDX6水平与E2、P呈负相关(r分别为-0.355、-0.500,P<0.05),与T呈正相关(r=0.371,P<0.05)(表3)。

表1 PCOS组与健康对照组的临床资料比较Tab.1 Comparison of the clinical data and other indicators between PCOS group and healthy group
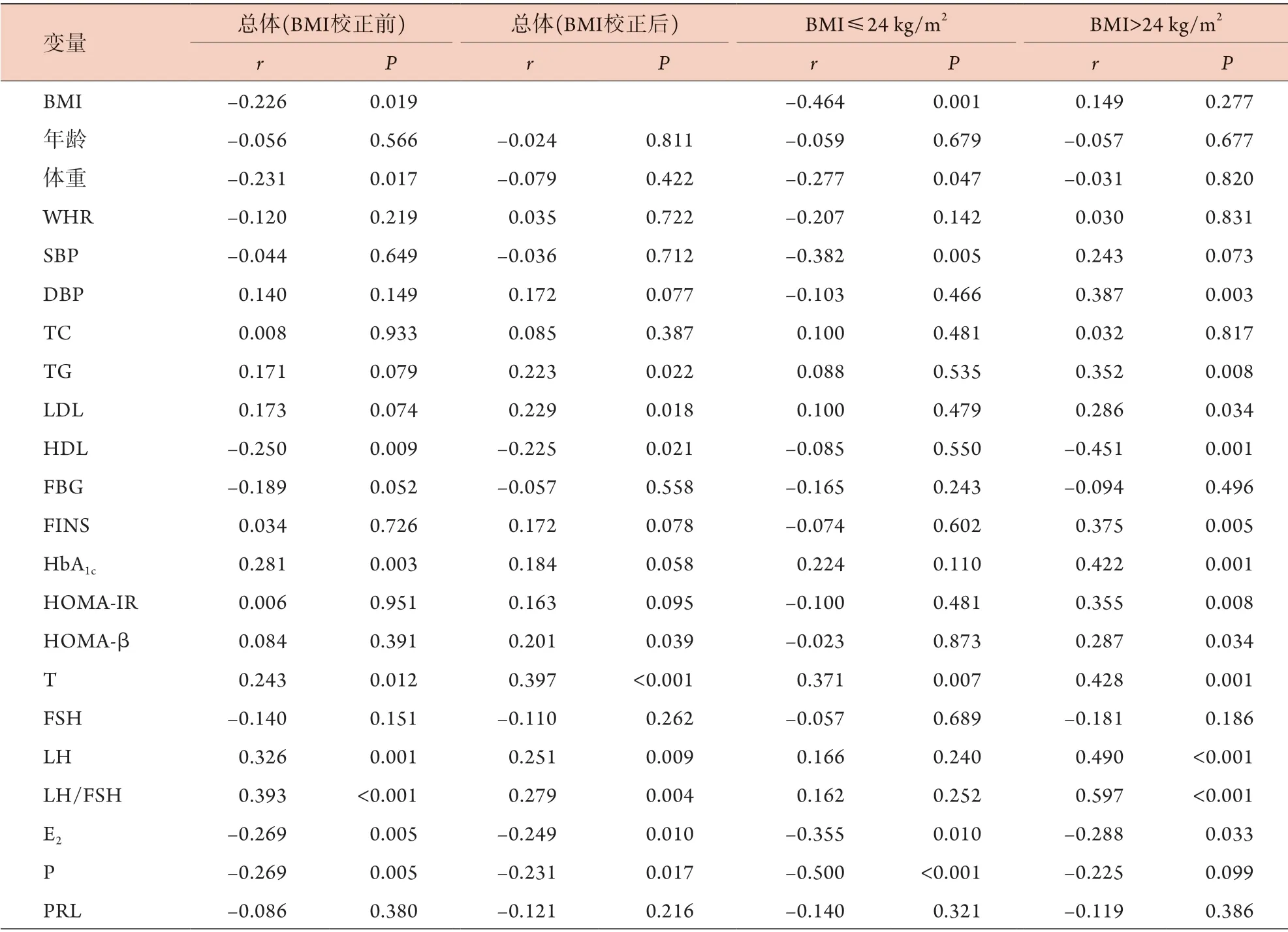
表3 PRDX6与糖脂代谢和性激素指标的相关性Tab.3 Correlation of PRDX6 with glucose and lipid metabolism and sex hormone indexes
当BMI>24 kg/m2时,PCOS组与健康对照组BMI差异无统计学意义(P=0.142,表1),因而无需校正BMI。相关分析显示,血浆PRDX6水平与DBP、TG、LDL、FINS、HbA1c、HOMA-IR、HOMA-β呈正相关(r分别为0.387、0.352、0.286,0.375、0.422、0.355、0.287,P<0.05),与HDL呈负相关(r=-0.451,P=0.001);此外,血浆PRDX6水平与T、LH、LH/FSH呈正相关(r分别为0.428、0.490、0.597,P<0.005),与E2呈负相关(r=-0.288,P=0.033)(表3)。
2.5 PRDX6预测糖脂代谢和性激素指标的ROC曲线分析 PRDX6预测所有患者糖脂代谢指标HOMA-IR的ROC曲线下面积(AUC)为0.753(95%CI 0.684~0.822,P<0.0001),预测所有患者性激素指标LH的AUC为0.592(95%CI 0.515~0.668,P<0.0001)。PRDX6预测PCOS患者糖脂代谢指标HOMA-IR的AUC为0.917(95%CI 0.860~0.973,P<0.0001),预测PCOS患者性激素指标LH的AUC为0.544(95%CI 0.426~0.663,P=0.461)(图1)。
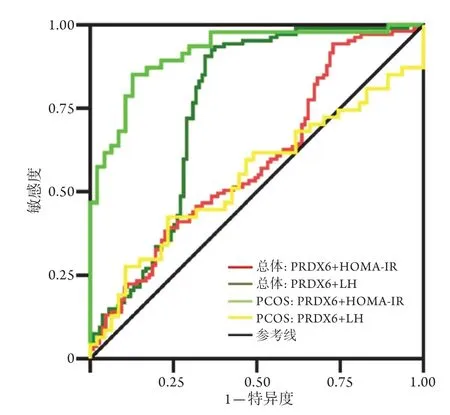
图1 PRDX6预测糖脂代谢和性激素指标的ROC曲线Fig.1 ROC curve of PRDX6 predicting glucose and lipid metabolism and sex hormone indicators
3 讨 论
PCOS是以月经紊乱、高雄激素血症、卵巢多囊样改变为主要特征的生殖内分泌疾病,常并发排卵障碍、肥胖、糖耐量减低、高血压、大血管疾病和血脂异常、外周胰岛素抵抗等。肥胖型PCOS患者更容易产生胰岛素抵抗,引起糖脂代谢紊乱,二者的相关性也已被证实,但其发病机制仍未明确[15-16]。有研究发现,PCOS患者的糖脂代谢异常与雄激素[17]、胰岛素敏感性[18-19]、血脂水平[20]等诸多指标相关。目前普遍认为机体发生代谢异常的最初表现为胰岛素抵抗和高胰岛素血症,其中胰岛素抵抗可导致血糖、低密度脂蛋白胆固醇升高,TG、血清高密度脂蛋白水平降低,进而促进继发性高胰岛素血症相关的体重增加,导致胰岛素抵抗恶化及其代谢后遗症;而胰岛素抵抗作为肥胖相关疾病的基础,可增高T2DM和PCOS的患病率[21-22]。因此,本研究探讨了PCOS患者与健康人血浆PRDX6水平的差异及其与糖脂代谢、性激素指标的相关性。
PRDX6是一种新型的抗氧化酶,可调节氧化应激和炎性因子水平,其结构独特,是连接氧化还原稳态与增殖的重要环节,可表现出多种功能,其活性调控受亚细胞定位、底物结合及翻译后修饰等因素影响[23]。目前的研究证实,PRDX6在不同的代谢性疾病、眼损伤、男性不育、肿瘤、炎性疾病、缺血性脑卒中、创伤性脑损伤及神经退行性病变中发挥作用[24-25]。但血浆PRDX6在PCOS中的作用仍未明确,迄今鲜有研究报道血浆PRDX6与PCOS患者糖脂代谢或性激素的相关性。
本研究结果发现,P C O S 组患者的血浆P R D X 6 水平明显高于健康对照组,相关分析结果显示,当B M I >2 4 k g/m2时,P C O S 组患者较健康对照组出现了明显的胰岛素抵抗和高脂血症,血浆P R D X 6 水平与糖脂代谢指标DBP、TG、LDL、FINS、HbA1c、HOMA-IR、HOMA-β等呈正相关,与HDL呈负相关(P<0.05),提示血浆PRDX6水平与BMI>24 kg/m2的PCOS患者的糖脂代谢相关。故推测血浆PRDX6可能通过增加胰岛素抵抗而使超重的PCOS患者发生糖脂代谢紊乱,与既往报道胰岛素抵抗引起糖脂代谢紊乱的结论一致[26-27],也与文献认为肥胖型PCOS患者更易产生胰岛素抵抗而引发糖脂代谢紊乱的结论一致[15-16]。此外,本研究还发现,与健康对照组比较,BMI>24 kg/m2的PCOS患者血浆PRDX6水平与性激素指标T、LH、LH/FSH呈正相关,与E2呈负相关(P<0.05),提示血浆PRDX6与BMI>24 kg/m2的PCOS患者的性激素代谢相关。而当BMI≤24 kg/m2时,P CO S 患者未出现任何糖脂代谢指标异常(P>0.05),但其血浆PRDX6水平与性激素指标T呈正相关(P<0.001),与E2和P呈负相关(P<0.05),提示血浆PRDX6水平可能是影响PCOS患者糖脂代谢和性激素指标的危险因素,可参与代谢性疾病的发生,与文献报道一致[28]。血浆PRDX6水平增高对BMI>24 kg/m2的PCOS患者糖脂代谢和性激素紊乱的影响较BMI<24 kg/m2的PCOS患者更大,推测其可能是PCOS患者糖脂代谢、性激素指标异常的预警指标。最后,本研究ROC曲线分析结果显示,PRDX6预测所有患者糖脂代谢指标HOMA-IR的AUC为0.753,而预测PCOS患者HOMA-IR的AUC(0.917)明显增加,提示血浆PRDX6可作为PCOS患者糖脂代谢异常的预测因子。
综上所述,本研究结果显示,血浆PRDX6水平与PCOS患者糖脂代谢、性激素指标异常有关,并发现BMI>24 kg/m2的PCOS患者血浆PRDX6水平升高对糖脂代谢、性激素紊乱的敏感性更高,并可能通过增加胰岛素抵抗而引起糖脂代谢异常。遗憾的是,本试验未将临床研究结合基础实验进行相互印证,因此,下一步拟开展基础研究探讨PRDX6调控超重PCOS患者糖脂代谢和性激素指标的机制,这可能有助于寻找PCOS的发病机制,改善预后,并提高患者的生活质量。

