ERK1/2信号蛋白和蛋白降解酶在骨关节炎患者软骨/软骨下骨中的表达及其意义
蒲沛东,马腾洋,周士平,张赛,韩飞,马青源,王超,王维山*
1石河子大学医学院第一附属医院骨科中心,新疆石河子 832000;2解放军69337部队卫生队,新疆塔城 834600;3解放军69245部队医院骨科,乌鲁木齐 830000;4解放军32330部队卫生队,乌鲁木齐 830000
骨关节炎(osteoarthritis,OA)是一种以不同程度的关节疼痛、僵硬、功能障碍和畸形为特征的慢性退行性关节病[1-2]。OA特征性病理改变为软骨降解与软骨下骨代谢紊乱[3]。研究发现,软骨降解和软骨下骨改变与OA发展存在内在联系[4-5],但由于目前对OA病变的认识不足,尚无有效的方法阻止OA的进展。软骨降解和软骨下骨代谢改变共同促进OA的发生发展,因此探讨导致二者共同信号的通路及蛋白水解酶的作用对调控和阻止疾病进展可能具有重要意义。细胞外信号调节激酶1/2(extracellular signal regulated kinases 1/2,ERK1/2)是丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)家族的一员,对骨和软骨的正常生长发育及代谢起着重要的调控作用,且在OA中呈高表达[6]。蛋白降解酶是一类催化多肽或蛋白水解的酶,可降解软骨基质使软骨发生退变,降低关节的稳定性,促进OA的发生[7],尤其以基质金属蛋白酶(matrix metalloproteinases,MMPs)[8]和聚蛋白多糖酶(Aggrecanase)目前研究最多且发挥作用最为显著。研究发现,尿激酶型纤溶酶激活物(urokinase type plasmin activator,uPA)激活后,MMP-3即可发挥较强的软骨基质降解作用,且可与激活的MMP-9发挥较强的级联放大作用,从而促进软骨降解[9-10]。本课题组前期对OA临床标本进行研究发现,软骨/软骨下骨中的MMPs不仅参与软骨降解,还在软骨下骨代谢过程中发挥作用[11]。聚蛋白多糖酶是带有血小板凝血酶敏感蛋白样模体的解整连蛋白金属蛋白酶(a disintegrin and metalloproteinase with thrombospondin motifs,ADAMTs)家族成员,能与细胞外基质(extracellular matrix,ECM)结合并参与其代谢过程[12]。在小鼠模型中已经证实,敲除ADAMT5基因可抑制OA和炎症性关节炎的发生发展[13],由此可见,ADAMT5在OA病变中发挥重要作用。软骨下骨位于软骨与骨组织之间,其改变是OA发生机制的重要组成部分[14-15],因此对软骨下骨微结构进行研究也可为探讨OA病变机制提供新的依据。本研究探讨了ERK1/2信号蛋白与OA致病相关蛋白降解酶在软骨/软骨下骨中的表达及其意义,以期为OA的早期诊断及治疗提供新的方法与思路。
1 资料与方法
1.1 试剂及仪器 ERK1/2、pERK1/2、MMP-3、MMP-9、ADAMT5一抗购自英国Abcam公司;山羊抗兔IgG二抗购自美国Sigma公司;QuantiNova SYBR Green PCR Kit (500)购自德国QIAGEN GmbH公司;SDS-PAGE Gel Kit购自北京Solarbio科技有限公司;Trizol试剂和SuperScriptFirst-Strand Synthesis System反转录试剂盒购自美国Invitrogen公司。PCR扩增仪(AG 22331 Hambrug)购自德国Eppendorf Corporation公司;紫外分光光度仪购自北京Tiangen公司。
1.2 组织标本 收集2017年12月-2019年12月于石河子大学医学院第一附属医院关节外科住院的明确诊断为OA并行全膝关节置换术的50例患者的膝关节胫骨平台样本及创伤科因外伤截肢的10例患者(无任何形式的关节疾病)的健康膝关节胫骨平台样本(作为对照)。50例OA患者中,男24例,女26例,年龄(69.3±5.2)岁。10例截肢患者中,男6例,女4例,年龄(56.1±4.4)岁。根据OARSI-Modified Manking评分及病变程度将所有标本分为对照组、轻度组(OARSI-Modified评分1~15分,Manking评分1~9分)及重度组(OARSI-Modified评分16~24分,Manking评分10~14分)。所有研究对象均签署知情同意书,本研究经石河子大学医学院第一附属医院伦理委员会批准(2017-119-01)。
1.3 纳入和排除标准 参照2014年国际骨关节炎研究协会制定的膝关节OA诊断标准,在排除类风湿关节炎、肿瘤性疾病及创伤的情况下,符合以下1+2条、1+3+5+6条或1+4+5+6条即可诊断为OA。(1)患者自觉膝关节有疼痛感;(2)膝关节负重位X线片显示膝关节关节间隙变窄、不对称,关节软骨硬化增生,并有骨赘,在硬化的关节软骨下方出现囊性改变;(3)完成关节液实验室检查2次,检查结果符合OA诊断标准:关节液清亮,黏稠度正常,淡黄色,同时炎性指标如红细胞沉降率(ESR)及C反应蛋白处于正常范围;(4)膝关节活动度尚且存在,没有关节强直等表现;(5)年龄≥40岁;(6)关节活动时具有骨擦音或感觉到骨擦感。
对照组排除有膝关节创伤史、其他形式的关节炎、代谢性骨病、骨肿瘤或者服用影响骨重塑的药物者,以及未包含足够的软骨下骨胫骨平台(软骨下骨板和软骨下小梁骨的总厚度<5 mm)者。
1.4 HE染色观察软骨退变情况及破坏程度 胫骨平台组织切片经二甲苯脱蜡、乙醇水化后,于37 ℃恒温0.4%胃蛋白酶溶液中修复30 min;PBS漂洗3次,滴加3%过氧化氢修复30 min;PBS漂洗3次,5%胎牛血清封闭30 min。苏木精复染30 s、1%盐酸酒精酸化3~5 s后冲洗,返蓝10 min;PBS漂洗3次,经95%乙醇清洗、无水乙醇脱水、二甲苯透明后,光学树脂封片。其中细胞核呈紫蓝色,软骨基质呈蓝色。显微镜下观察软骨细胞数量及染色深度并进行OARSI评分。OARSI评分标准:(1)6个等级。1级关节软骨表面尚完整;2级关节软骨表面不连续,在中层软骨区域伴随出现细胞增殖;3级软骨表面可见垂直裂纹,其深度可达中层软骨;4级出现软骨侵蚀,软骨基质丢失;5级钙化软骨层或软骨下骨完全暴露;6级关节变形及微骨折,有骨赘形成。(2)4个阶段。阶段1指受累关节软骨小于整个软骨表面的10%,阶段2指受累关节软骨占整个软骨表面的10%~25%,阶段3指受累关节软骨占整个软骨表面的25%~50%,阶段4指受累关节软骨范围达到整个软骨表面的50%及以上。等级和阶段相乘后得到软骨破坏程度的最终评分,评分越高表明关节软骨破坏程度越重。
1.5 免疫组化染色检测ERK1/2、pERK1/2、MMP-3、MMP-9、ADAMT5的表达情况 胫骨平台组织切片经二甲苯脱蜡、乙醇水化后,于0.4%胃蛋白酶溶液中置于37 ℃恒温箱静置修复30 min;PBS漂洗3次,滴加3%过氧化氢修复30 min;PBS漂洗3次,5%胎牛血清封闭液封闭30 min;滴加ERK1/2(1:50)、pERK1/2(1:200)、MMP-3(1:100)、MMP-9(1:100)、ADAMT5(1:50)一抗4 ℃孵育过夜,PBS漂洗3次;滴加山羊抗兔IgG二抗37 ℃孵育30 min;DAB显色后冲洗,经苏木精复染30 s、1%盐酸酒精酸化3~5 s、冲洗至无颜色后,返蓝10 min;清洗及脱水后光学树脂封片。显微镜下计数阳性细胞数及着色强度来判断阳性强度。判断标准:阳性细胞数百分比<5%、5%~25%、25%~50%、50%~75%、75%~100%,分别计0、1、2、3、4分;着色强度为无着色、浅棕黄色、棕黄色、棕褐色,分别计0、1、2、3分。由两项评分相乘获得最终积分,0~1、2~4、5~8、9~12分分别评定为-、+、++、+++,其中-为阴性,+为弱阳性,++/+++为强阳性。
1.6 Western blotting检测ERK1/2、pERK1/2、MMP-3、MMP-9、ADAMT5蛋白的表达 将胫骨平台组织样品研磨成粉状收集到1.5 ml EP管中,加入1 ml RIPA及蛋白酶抑制剂,4 ℃孵育过夜;匀浆90 min,4 ℃下12 000 r/min离心30 min,取上清,分装于EP管中。使用紫外分光光度计测定蛋白质浓度,然后向EP管中加入1/4的Loading Buffer煮沸10 min,于-80 ℃保存备用。电泳转膜后将PVDF膜置于5% BSA中室温封闭2 h,于摇床上用TBST洗膜5 min×3次,滴加一抗4 ℃孵育过夜;TBST漂洗3次,滴加二抗室温孵育2 h。TBST漂洗3次,洗膜后显影,根据内参条带灰度值调整上样量。实验重复10次。
1.7 实时定量PCR(RT-qPCR)检测ERK1/2、MMP-3、MMP-9、ADAMT5mRNA的表达 采用QIAGEN试剂盒和Trizol试剂提取胫骨平台组织总RNA,使用SuperScriptFirst-Strand Synthesis System反转录为cDNA。以cDNA为模板,行RT-qPCR检测。反应体系20 μl:SYBR GreenMaster PCR Mix 10 μl、DPEC水5 μl、上下游引物各1 μl、Rox 2 μl及cDNA 1 μl。反应条件:95 ℃预变性2 min;95 ℃变性30 s,60 ℃延伸30 s,共40个循环。以β-actin为内参,采用2-ΔΔCt法分析ERK1/2、MMP-3、MMP-9和ADAMT5mRNA相对表达水平。引物序列如表1所示。

表1 RT-qPCR引物序列Tab.1 Primer sequence of RT-qPCR
1.8 Micro-CT扫描分析软骨下骨的厚度 沿长轴扫描标本(扫描精度:18 μm;过滤器:0.5 ml Al),180°螺旋扫描(电压60 kV,电流368 μA),重建图像数据后观察冠状、矢状和横断面结构。经3D重建后,选择人类胫骨平台中软骨下骨的感兴趣区(ROI,9 mm×9 mm×5 mm,垂直于关节表面),测量ROI的骨矿物质密度(BMD)、骨体积分数(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)及骨小梁间距(Tb.Sp)。
1.9 统计学处理 采用SPSS 20.0软件进行统计分析。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用非参数检验;计数资料以率(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 OA胫骨平台标本大体形态 如图1所示,OA胫骨平台外侧面的关节软骨轻度磨损,软骨表面相对完整;内侧平台表面不均匀,关节受力的区域和严重磨损的区域有软骨剥脱迹象,表面骨赘增生,可见软骨下骨裸露和软骨下骨钙化。
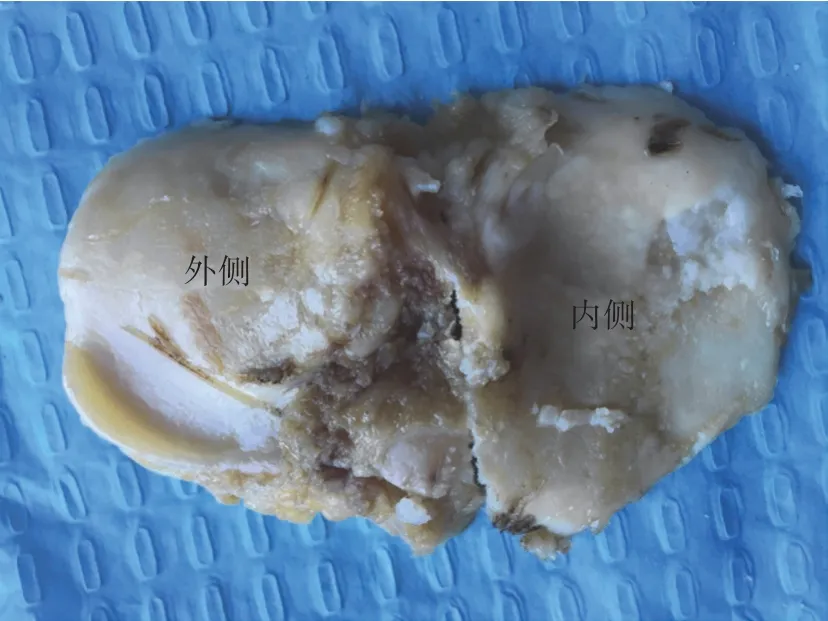
图1 OA胫骨平台大体观察Fig.1 Gross observation of knee OA and tibial plateau
2.2 各组软骨退变情况及破坏程度 根据OARSIModified Manking评分,50例OA患者中,轻度组31例,重度组19例。HE染色结果显示,对照组软骨表面完整无磨损,未见硬化软骨,未见暴露的软骨下骨;轻度组软骨变薄,软骨细胞层次排列不清,软骨下骨厚度增加,软骨表面不均匀且有深达软骨下骨的裂缝;重度组软骨几乎完全消失,软骨下骨明显暴露并变形,钙化软骨增厚,软骨下骨区骨细胞减少、骨小梁增粗,骨小梁排列紊乱(图2)。OARSI评分结果显示,与对照组相比,轻度组、重度组OARSI评分明显升高[(8.14±0.56)分、(23.33±0.17)分vs. (3.53±0.11)分,P<0.05],且重度组高于轻度组,差异有统计学意义(P<0.05,图2)。

图2 各组软骨退变情况及破坏程度(HE染色,n=10)Fig.2 Degeneration and damage degree of cartilage in each group (HE staining, n=10)
2.3 各组软骨下骨中ERK1/2、pERK1/2表达情况 免疫组化染色结果显示,与对照组比较,轻度组和重度组软骨下骨中pERK1/2多为高度表达(χ2=65.618,P<0.001),特别是在软骨下骨靠近软骨区域,但各组ERK1/2表达情况无明显差异(图3A)。Western blotting检测结果显示,与对照组相比,轻度组和重度组软骨下骨中pERK1/2蛋白表达水平升高(0.42±0.03、0.51±0.07vs. 0.21±0.05,P<0.05),且重度组高于轻度组(P<0.05,图3B)。RT-qPCR检测结果显示,各组ERK1/2mRNA表达水平无明显差异(P>0.05,图3C)。
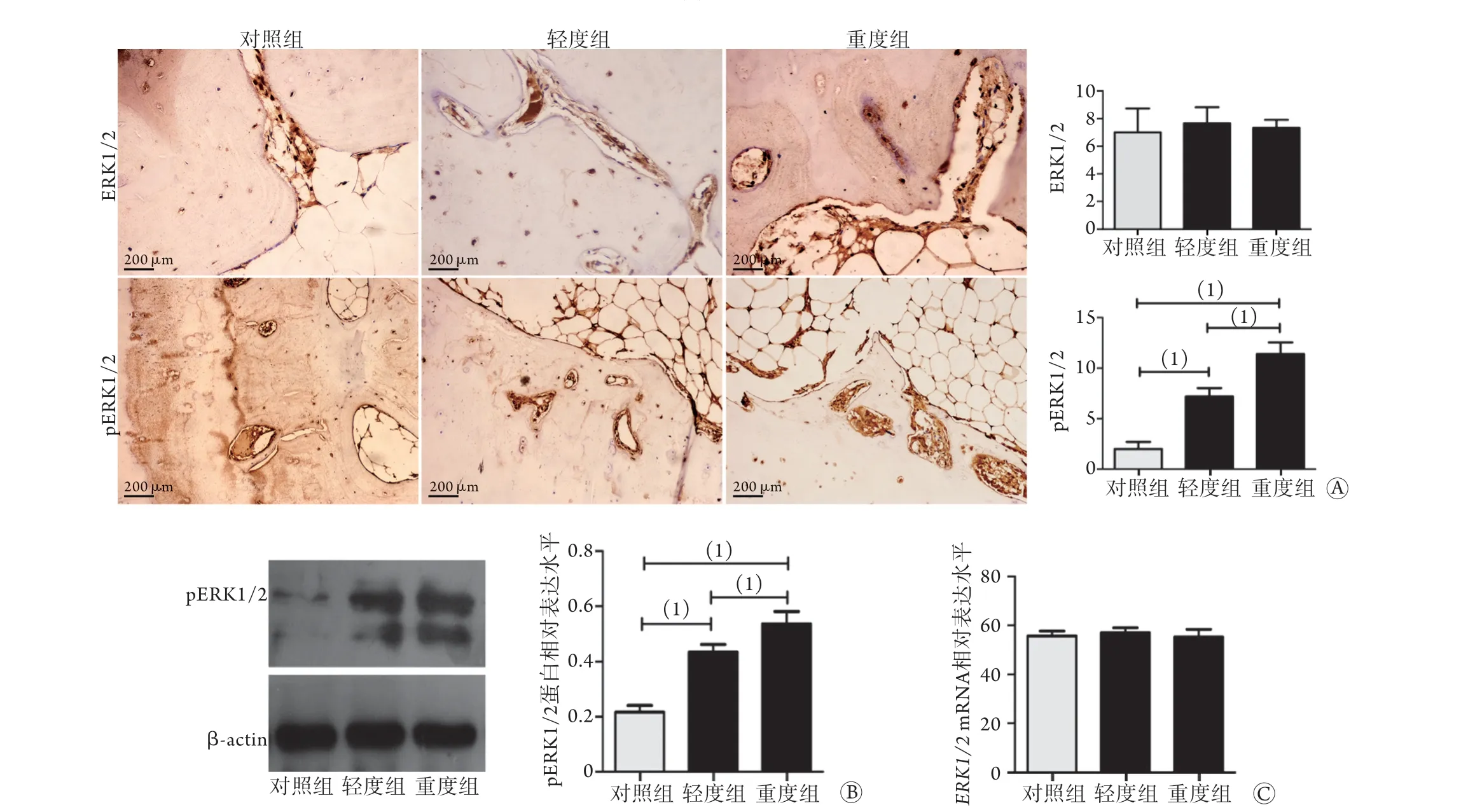
图3 各组软骨下骨中ERK1/2、pERK1/2表达情况Fig.3 Expression of ERK1/2 and pERK1/2 in subchondral bone of each group
2.4 各组软骨/软骨下骨中MMP-3、MMP-9和ADAMT5蛋白和mRNA表达情况 免疫组化染色结果显示,与对照组比较,轻度组和重度组软骨/软骨下骨中MMP-3、MMP-9和ADAMT5表达水平明显升高(χ2=43.927,P<0.001,n=47),且重度组高于轻度组,差异有统计学意义(P<0.05,图4A)。
Western blotting检测结果显示,与对照组比较,轻度组和重度组软骨/软骨下骨中MMP-3(0.43±0.04、0.57±0.04vs. 0.14±0.08,P<0.001)、MMP-9(0.32±0.06、0.46±0.03vs. 0.12±0.05,P<0.01)、ADAMT5(0.62±0.01、0.85±0.06vs.0.24±0.04,P<0.05)蛋白表达水平升高,且重度组高于轻度组,差异有统计学意义(P<0.05,图4B)。
RT-PCR检测结果显示,与对照组比较,轻度组和重度组软骨/软骨下骨中MMP-3(30.44±0.47、108.82±0.11vs. 1.00±0.08,P<0.05)、MMP-9(5.63±0.31、36.94±0.24vs. 1.00±0.10,P<0.05)、ADAMT5(18.09±0.38、93.52±0.61vs. 1.06±0.09,P<0.05) mRNA相对表达水平升高,且重度组高于轻度组,差异有统计学意义(P<0.05,图4C)。
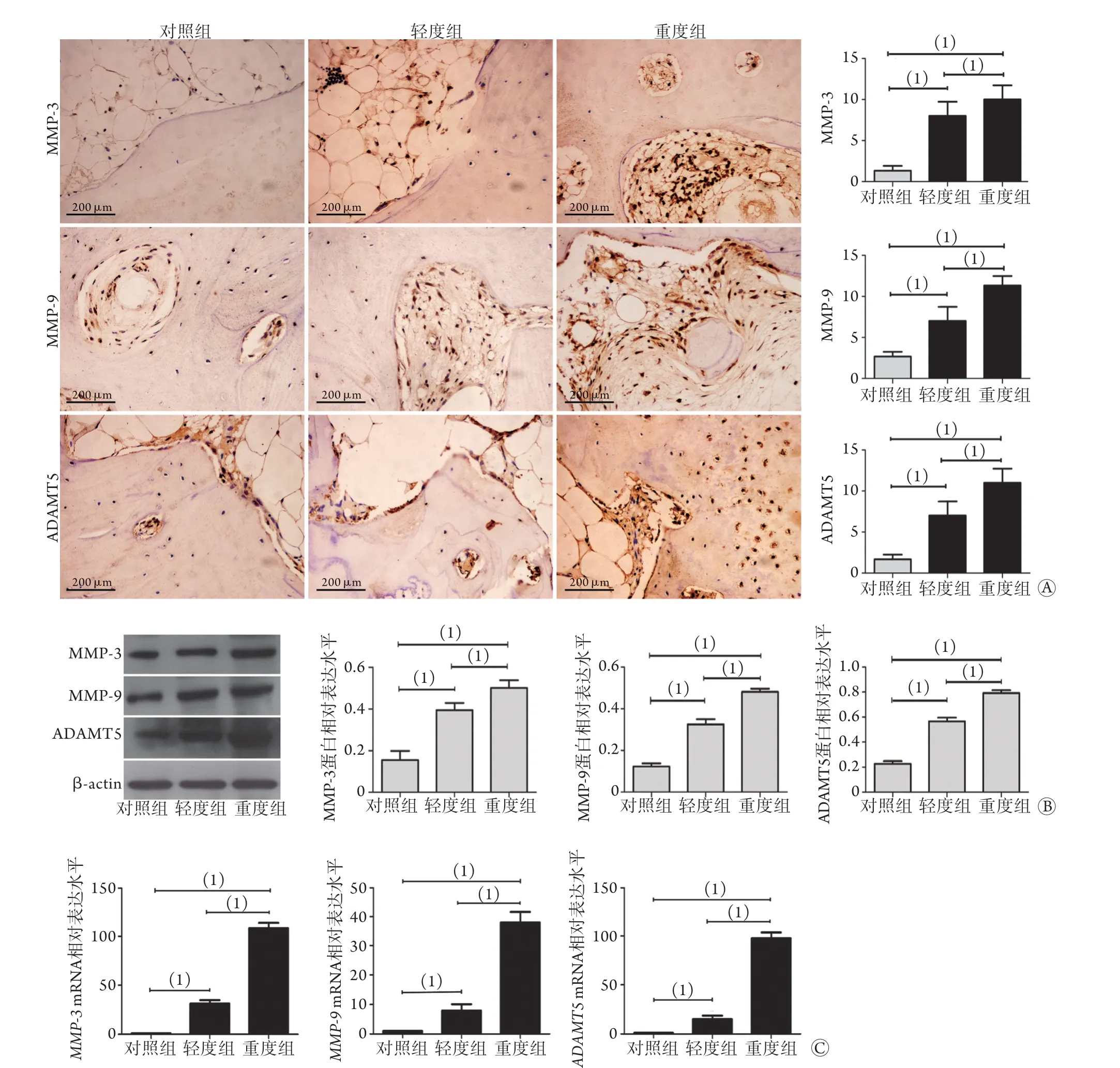
图4 MMP-3、MMP-9和ADAMT5蛋白和mRNA在软骨/软骨下骨中的表达情况Fig.4 Expression of MMP-3, MMP-9 and ADAMT5 protein and mRNA in cartilage and subchondral bone
2.5 Micro-CT对软骨下骨微结构改变的鉴定情况
Micro-CT扫描显示,对照组软骨厚度正常,骨小梁排列稀疏无增粗,相互连接呈拱桥状;轻度组和重度组中软骨厚度降低,软骨下骨骨小梁排列紊乱,小梁厚度增加,间隙变窄,相互连接呈现为厚板状。与对照组比较,轻度组和重度组软骨/软骨下骨中BV/TV、Tb.Th、Tb.N、BMD明显增高,Tb.Sp明显降低,差异有统计学意义(P<0.05,图5、表2)。
表2 各组软骨下骨感兴趣区域BV/TV、Tb.Th、Tb.N、Tb.Sp、BMD比较(±s)Tab.2 Comparison of subchondral bone regions of interest BV/TV, Tb.Th, Tb.N, Tb.Sp and BMD in each group (±s)
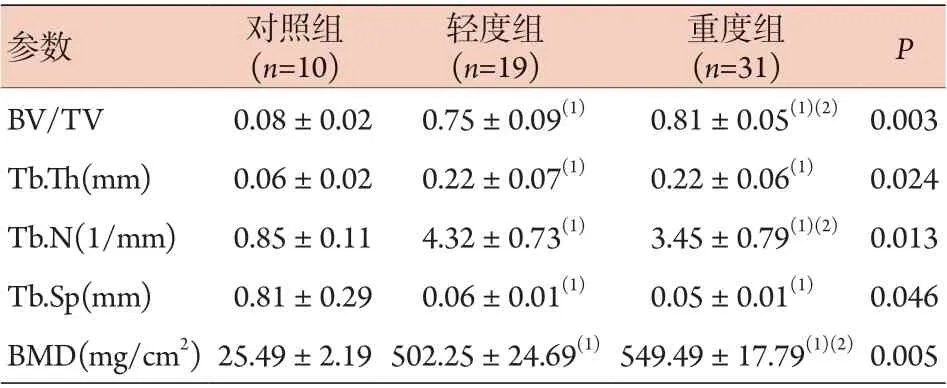
表2 各组软骨下骨感兴趣区域BV/TV、Tb.Th、Tb.N、Tb.Sp、BMD比较(±s)Tab.2 Comparison of subchondral bone regions of interest BV/TV, Tb.Th, Tb.N, Tb.Sp and BMD in each group (±s)
BV/TV. 骨体积分数;Tb.Th. 骨小梁厚度;Tb.N. 骨小梁数量;Tb.Sp. 骨小梁间距;BMD. 骨密度;与对照组比较,(1)P<0.05;与轻度组比较,(2)P<0.05
参数 对照组(n=10)轻度组(n=19)重度组(n=31) P BV/TV 0.08±0.02 0.75±0.09(1) 0.81±0.05(1)(2) 0.003 Tb.Th(mm) 0.06±0.02 0.22±0.07(1) 0.22±0.06(1) 0.024 Tb.N(1/mm) 0.85±0.11 4.32±0.73(1) 3.45±0.79(1)(2) 0.013 Tb.Sp(mm) 0.81±0.29 0.06±0.01(1) 0.05±0.01(1) 0.046 BMD(mg/cm2) 25.49±2.19 502.25±24.69(1) 549.49±17.79(1)(2) 0.005
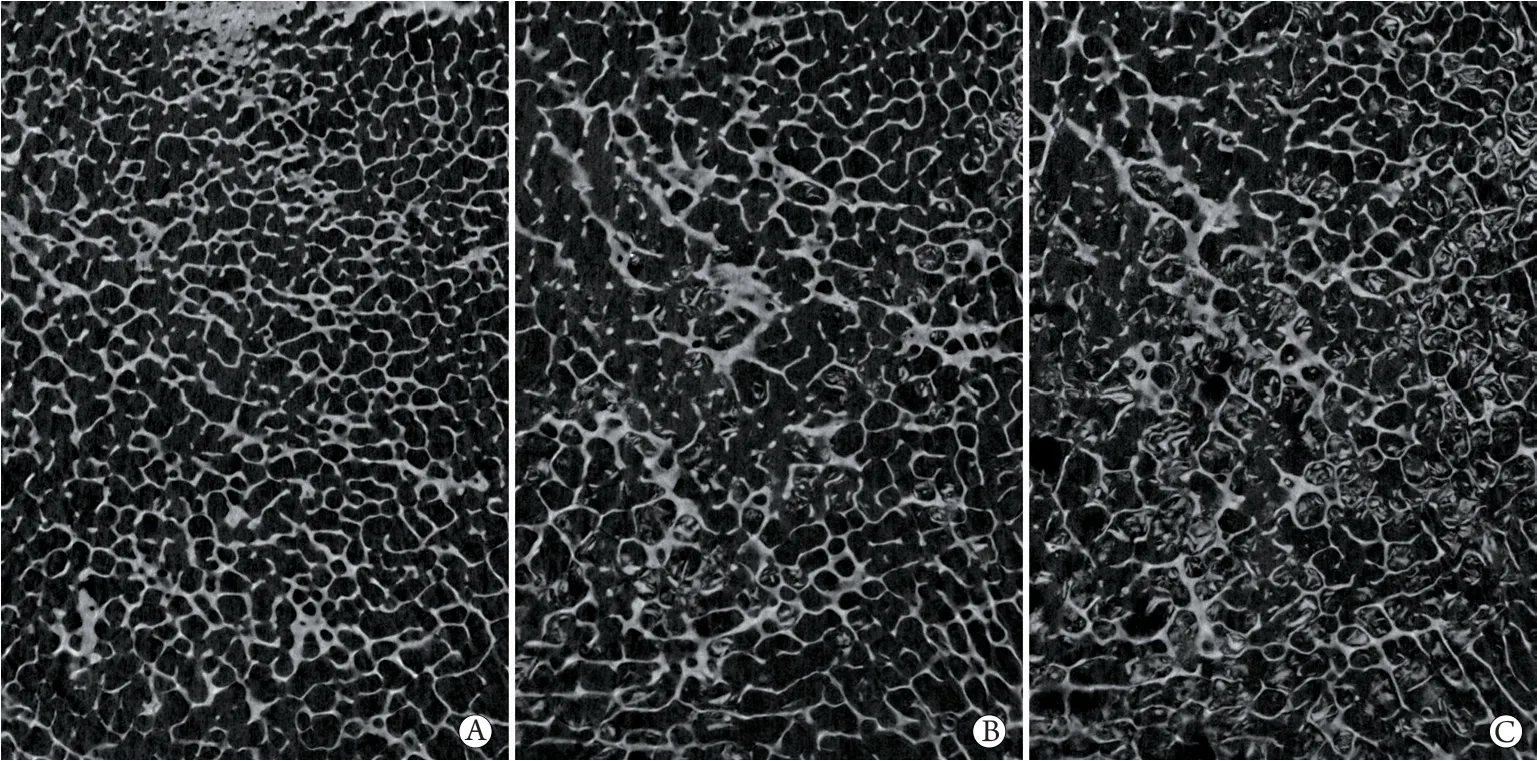
图5 各组软骨下骨感兴趣区域micro-CT扫描冠状面图像Fig.5 Micro CT scanning coronal images of regions of subchondral bone regions interest in each group
3 讨 论
MAPK可介导多种细胞凋亡[16],调控成骨细胞和软骨细胞的分化及增殖。越来越多的证据表明,MAPK的激活在OA病理改变中发挥主导作用,主要通过刺激软骨细胞[17]和成骨细胞[18]的分化及增殖来诱导MMPs的表达。ERK1/2信号通路是MAPK最为重要的激活途径,与软骨基质降解及软骨细胞肥大分化有关[19]。研究发现,通过抑制IL-1β来诱导ERK途径的激活可延缓OA的进展[20],与靶向抑制MAPK通路(特别是抑制ERK1/2信号通路)的作用一致[21],且该作用在骨性关节炎动物模型中也得到证实[22]。目前对ERK1/2信号通路在人软骨/软骨下骨中表达的研究较少,为此本研究对人OA胫骨平台标本进行分析,发现软骨/软骨下骨中ERK1/2的磷酸化增加且与病变程度呈正相关,与Prasadam等[23]在OA软骨细胞层面的研究结果相符。赵晋等[24]在体外实验中证实,软骨下骨层面pERK1/2信号蛋白发生了改变,但不同退变程度关节中ERK1/2蛋白和mRNA的表达差异并不明显。
MMP-3又称间充质裂解酶[25],在OA患者的软骨、滑膜、滑液和外周血中呈高表达[26],其作用为降解软骨基质。MMP-9又称明胶酶[27],目前已有研究证实其在OA软骨组织中呈高表达[28]。β-连环蛋白可诱导软骨细胞中MMP-9高表达[29],从而导致小鼠膝关节OA的发生,由此推测,MMP-9在软骨下骨中也呈高表达,本研究证实了这一推测。越来越多的证据表明,ERK激活后可介导MMPs的产生,从而促进软骨降解[30-31]。软骨降解与软骨/软骨下骨的相互作用有关,且MMPs在软骨/软骨下骨中的表达增加也促进了两者的相互作用。本研究检测了人OA胫骨平台标本软骨/软骨下骨中ERK1/2及pERK1/2的表达,发现pERK1/2表达增加,且同一区域中MMP-3和MMP-9也呈高表达,由此推测,软骨下骨中ERK1/2信号通路的激活可能会促进MMPs的合成增加,最终导致软骨和软骨下骨相互作用增强并发生软骨降解。ADAMT5是一种可在没有MMPs参与情况下水解聚集蛋白聚糖的酶[32-33]。研究证实,ADAMT5在OA动物模型[34]和人关节软骨外植体[35]中均呈高表达。本研究检测了人OA胫骨平台标本软骨/软骨下骨中ADAMT5的表达,发现ADAMT5表达增加。最近有学者对OA关节软骨细胞(ACC)和软骨下骨成骨细胞体外共培养模型进行研究发现,ADAMTS和MMPs的上调与MAPK-ERK1/2信号的激活有关,而MAPK-ERK抑制剂PD98059可逆转共培养细胞中ADAMTS和MMPs的过表达[23],与本研究在人OA胫骨平台标本软骨下骨层面的检测结果一致。
机体通过协调骨形成和骨吸收来实现骨重塑,其中成骨细胞沉积钙化骨基质而破骨细胞再吸收骨[36-37]。活化的ERK1/2可调控软骨下骨中成骨细胞和破骨细胞的分化而影响骨形成[38-39],但OA关节中发生了异常骨重塑,软骨下骨结构的变化导致应力不均匀及关节软骨的退化,进一步导致未结合的骨重塑发生。本研究micro-CT及免疫组化染色结果显示,与完整的软骨组织相比,软骨区损伤的软骨下骨微结构发生异常增生,ERK1/2蛋白的磷酸化增加,诱导成骨细胞和破骨细胞的分化而导致异常骨重塑,进而诱发OA的发展。
综上所述,本研究结果表明,OA软骨/软骨下骨中pERK1/2、MMP-3、MMP-9及ADAMT5呈高表达,且软骨下骨微结构发生改变,而pERK1/2表达增加可能是蛋白降解酶活性增强及软骨下骨微结构改变的原因之一。OA的病理机制复杂,其发生发展不仅与软骨退变有关,还与软骨下骨有关,但本研究缺乏对上述因子的对照实验,须进一步在细胞培养和动物模型中利用抑制剂加以验证,以期为OA的早期诊断及治疗提供更多的理论依据。

