肝切除术后重症患者发生肺不张的影响因素分析
王斌,沈佳伟,安友仲
北京大学人民医院重症医学科,北京 100044
肺不张是临床上常见的术后并发症,尤其对于行腹部手术的患者,因手术操作的影响及术后疼痛的干扰,术后常发生肺不张[1]。肝脏手术是一种常见的上腹部手术,手术部位靠近膈肌,术后肺部并发症发生率高,肺不张的发生率亦明显增高,常导致患者气管插管时间及住院时间延长,甚至导致病死率上升,尤其对重症患者的影响更加突出[2-3]。对于可能发生肺不张的高危患者,提前予以适当干预可改善病情,但关键在于对高危患者的识别[4-5]。目前研究尚未明确肝切除术后肺不张的危险因素。本文回顾性分析肝切除术后重症患者发生肺不张的危险因素,以期能早期识别高危患者并实施抢先治疗,从而改善患者的生存预后。
1 资料与方法
1.1 一般资料 选取2014年1月-2019年12月在北京大学人民医院行肝脏手术的患者442例。纳入标准:(1)年龄>18岁;(2)行肝脏部分切除术后转入ICU,急性生理与慢性健康评分Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)>10分。排除标准:(1)资料不全;(2)围手术期发生呼吸心跳骤停等突发事件;(3)术前存在肺部感染或慢性阻塞性肺病等其他肺部疾病。本研究通过北京大学人民医院伦理委员会批准(2021PHB024-001)。
1.2 研究方法 术后由影像科专业医师诊断肺不张:胸部X线片或CT显示纵隔、肺门或膈肌向受累区域移动的肺混浊影,以及邻近非肺不张肺的代偿性过度膨胀[6]。据此将442例患者分为肺不张组(n=99)与非肺不张组(n=343)。通过查询病历的方式搜集患者的相关资料:性别,年龄,体重指数(body mass index,BMI),吸烟史,肝脏手术史,并发症(糖尿病、高血压、冠心病、腹水、脾大),实验室检查(术前白蛋白、总胆红素、白细胞、血小板、纤维蛋白原、凝血酶原时间、活化部分凝血活酶时间),手术情况(手术时间、是否开腹手术、微波消融、肝门阻断时间、多部位手术),麻醉情况[美国麻醉师协会(ASA)分级、术中最低体温、术中入液量、术中失血量、术中尿量、是否行神经阻滞],入住ICU情况(APACHE Ⅱ评分、乳酸水平、首日入量),围手术期低血压(术中或术后需泵入血管活性药物维持血压者),是否输血等,以及预后情况(低氧血症发生情况、院内病死情况、带气管插管时间、入住ICU时间及住院时间)。
1.3 统计学处理 采用SPSS 23.0软件进行统计分析。正态分布的连续变量以±s表示,组间比较采用t检验;非正态分布的连续变量以M(Q1,Q3)表示,组间比较采用Mann-WhitneyU检验。分类变量以例(%)表示,组间比较采用χ2检验。应用logistic回归模型分析肝切除术后患者肺不张的独立危险因素。P<0.05为差异有统计学意义。
2 结 果
2.1 两组一般资料比较 与非肺不张组比较,肺不张组患者手术时间长,多部位手术比例高,术中入液量、失血量及尿量多,入住ICU乳酸水平高,ICU首日入量多,围手术期低血压比例高,差异有统计学意义(P<0.05);两组其他指标差异无统计学意义(P>0.05,表1)。
2.2 两组预后指标比较 与非肺不张组比较,肺不张组患者低氧血症发生率及院内病死率高,气管插管时间、入住ICU时间及住院时间长,差异有统计学意义(P<0.05,表2)。

表2 两组肝切除术后重症患者预后指标比较Tab.2 Comparison of the prognostic index between the two groups of severe patients after hepatectomy
2.3 肝切除术后重症患者发生肺不张的影响因素以表1中两组比较P<0.10的指标为自变量,以患者术后出现肺不张为因变量,进行单因素logistic回归分析,结果显示,手术时间、多部位手术、术中入液量、术中尿量、ICU首日入量、围手术期低血压、术中输血与重症患者术后发生肺不张有关(表3);再次以单因素logistic回归分析中P<0.10的指标为自变量,以患者术后出现肺不张为因变量,进行多因素logistic回归分析,结果显示,手术时间和围手术期低血压是肝切除术后重症患者发生肺不张的独立危险因素(表4)。
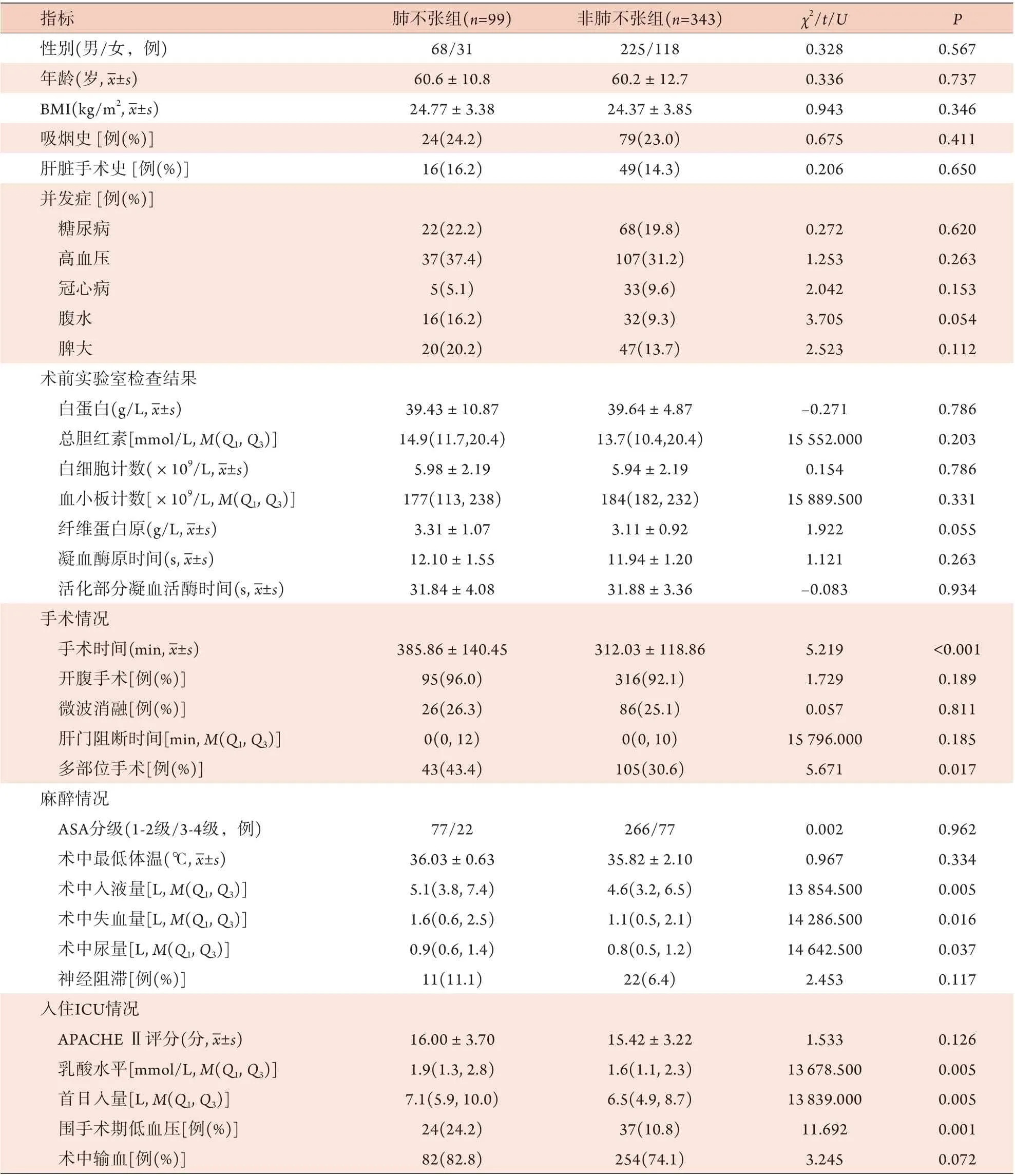
表1 两组肝切除术后重症患者一般资料比较Tab.1 Comparison of general data between two groups of severe patients after hepatectomy

表3 影响肝切除术后重症患者发生肺不张的单因素logistic回归分析Tab.3 Univariate logistic regression analysis of atelectasis of severe patients after hepatectomy
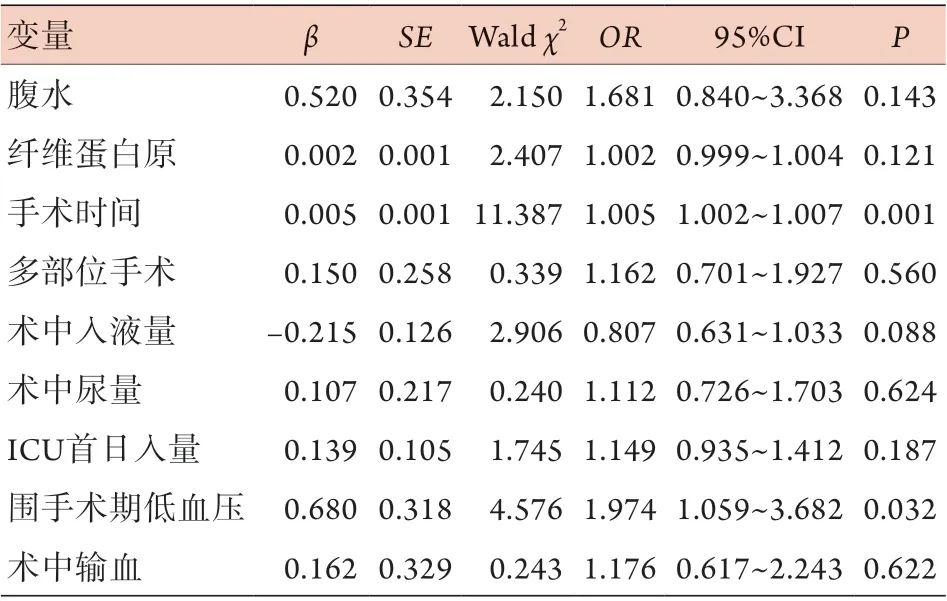
表4 肝切除术后重症患者发生肺不张危险因素的多因素logistic回归分析Tab.4 Multivariate logistic regression analysis of the factors affecting atelectasis of severe patients after hepatectomy
3 讨 论
我国肝脏恶性肿瘤发病率逐年增高,2020年,肝脏恶性肿瘤在肿瘤疾病谱中居第5位[7]。目前手术仍是肝脏肿瘤的首选治疗方法[8-9]。肝脏手术属于上腹部手术,手术部位紧邻膈肌,且肝脏肿瘤患者多合并腹水、低蛋白血症,因此术后易发生肺部并发症,尤其是重症患者的病情更加复杂危重,术后肺不张等肺部并发症的发生率更高,对患者的影响更大[10]。患者发生肺不张时,肺组织塌陷,气体交换能力下降,呼吸困难,致使患者气管插管时间延长。本研究中肝切除术后重症患者的肺不张发生率为22.4%,而肺不张组的低氧血症发生率高达49.5%,明显高于非肺不张组(27.7%),这也导致肺不张组气管插管时间和住院时间均显著长于非肺不张组。此外,肺不张组院内病死率达5.1%,也明显高于非肺不张组(0.5%)。本研究纳入的患者为重症患者,这在以往的研究中少见,也导致本研究中患者低氧血症发生率及病死率较以往研究为高[11-12]。
肺不张的发生极大地损害了重症患者的预后及生存,也显著增加了医疗费用及医疗资源的消耗,分析肺不张的危险因素,有助于对其进行早期识别及防治。本研究通过多因素Logistic回归分析发现,手术时间及围手术期低血压是肝切除术后重症患者发生肺不张的独立危险因素。
手术时间的延长意味着全身麻醉时间延长,全身麻醉时由于气管插管的置入,使患者丧失了声门开闭的功能,易导致肺不张的发生[13]。全身麻醉时患者丧失自主呼吸,由麻醉机进行机械通气,患者膈肌的运动与自主呼吸时不同,自主吸气时膈肌顶部下移,主要以后膈顶为主,而机械通气送气时膈肌前部下降更加明显,膈肌后部活动较自主呼吸时弱化,背部肺组织容易出现不张[14]。进行全身麻醉尤其是应用肌松剂后,患者胸廓肌肉张力减弱,腹部脏器更易于向头部运动,压迫膈肌,进而压迫肺组织[15]。同时麻醉中多吸入60%~100%的高浓度氧气,肺泡气吸收后没有氮气的支撑,肺泡容易塌陷,也是诱发肺不张的主要因素[16]。另外,肝脏手术靠近膈肌,手术时间延长意味着膈肌部位操作时间的延长,更增高了肺不张的发生概率。而且手术时间延长常意味着手术更加复杂和困难,创伤更大,也是造成肺不张的重要原因。
围手术期低血压在重症患者中更为常见,本研究将术中或者术后需泵入包括去甲肾上腺素、多巴胺在内的血管活性药物维持血压定义为围手术期低血压。围手术期低血压往往意味着休克的发生,患者的病情更加危重,更加虚弱,卧床及机械通气时间相应也更长[17]。围手术期低血压还意味着组织灌注的不足,患者脏器功能更易受损[18],伴随休克的液体复苏较一般患者也更加积极,相应地患者出现胸腔积液或感染等问题的可能性更大,肺不张发生率可能因此而增高。
为减少肝切除术后肺不张的发生以及改善患者的预后,术前应积极完善检查及准备,仔细制定手术预案,尽量缩短手术及全身麻醉的时间;手术完毕以及转入ICU后,在拔管前应对高危患者实施更积极的肺复张[4];实施神经阻滞等确切的镇痛措施,解除疼痛对患者呼吸的限制,鼓励患者积极进行包括咳痰、深呼吸或吹气球等内容在内的呼吸锻炼,从而减少肺不张的发生[5]。另外,术中及ICU内给予适当液体复苏,减少围手术期血管活性药物的应用及围手术期低血压事件的发生,尽快改善患者循环不稳状态,也有利于减少术后肺不张,促进患者尽快康复。
综上所述,肝切除术后转入ICU的重症患者肺不张发生率高,肺不张患者病死率及住院时间较非肺不张患者明显增高;手术时间延长及围手术期低血压是肝切除术后重症患者发生肺不张的独立危险因素。早期识别高危患者并提前实施积极的肺复张及呼吸锻炼,有助于预防术后肺不张的发生并改善预后。但本研究也存在一定局限性:首先,这是一项单中心回顾性研究,在确定因果关系的强度方面次于前瞻性研究。此外,样本量不够大,今后尚需通过大样本前瞻性研究对结论进行验证。

