不同解冻方式对817肉鸡食用品质和肌原纤维蛋白特性的影响
王建军,雷阳,黄天然,黄明*
(1.南京农业大学食品科学技术学院/农业农村部肉品加工重点实验室/江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095;2.南京黄教授食品科技有限公司/江苏省畜禽产品加工工程技术研究中心/国家禽肉加工技术研发专业中心,江苏 南京 211225)
中国是肉鸡生产和消费大国,肉鸡主要由白羽、黄羽和817肉鸡组成。817肉鸡又称肉杂鸡或杂交小肉鸡,具有成活率高、生长速度快、肉质鲜美等特点,经过30多年的发展,现已成为我国肉鸡产业的三大主导类型之一[1]。
目前817肉鸡的初加工产品以冷冻的整鸡以及分割鸡肉产品为主。冷冻肉在加工之前需要解冻,而不恰当的解冻方式会加剧汁液流失以及维生素、氨基酸等营养物质的损失,从而降低产品的营养价值和商业价值[2]。因此,选择正确的解冻方式对肉品质的保证至关重要。食品工业中常用的解冻方式主要有流水解冻、低温解冻和空气解冻。流水解冻具有解冻效率高、操作简单、解冻肉品质良好等特点。谭明堂等[3]比较了5种解冻方式(空气解冻、静水解冻、流水解冻、微波解冻和超声波解冻)对鱿鱼品质的影响,发现流水解冻的鱿鱼保水性最好,肌肉组织结构完整,脂质和蛋白氧化程度小,而空气解冻的鱿鱼品质较差。低温解冻温度低,可延缓脂质和蛋白的氧化但存在解冻耗时长,设备占地面积大等缺点。刘磊等[4]研究报道了流水解冻、低温解冻和快速微波解冻对鹅腿肉的影响,发现低温解冻的鹅腿肉剪切力值小、蛋白质氧化程度小、二级结构稳定,品质最佳。超声波解冻作为一项新兴的解冻技术,原理是食品的冻结区域对超声波的吸收比未冻结区域高出几十倍,并且在初始冻结点附近的吸收能力最大[5],所以超声波解冻效率高,解冻均匀,可以减少解冻过程肉品质的劣变。Guo等[6]研究了不同超声功率(0、200、400、600 W)对白牦牛背最长肌的影响,发现400 W超声波解冻可以提高解冻效率,维持牦牛肉的保水性和色泽,显著增加游离氨基酸、矿物质、维生素等营养物质的含量。然而这些解冻方式的研究对象主要集中在猪肉、牛肉、羊肉、鱿鱼等畜肉和水产品上,针对禽肉尤其是817肉鸡的研究鲜有报道。因此,本试验以817肉鸡的鸡胸肉为研究对象,研究4种解冻方式(空气解冻、流水解冻、超声波解冻和低温解冻)对鸡胸肉食用品质和肌原纤维蛋白特性的影响,旨在为817肉鸡在生产加工中选择合适的解冻方式提供试验依据。
1 材料与方法
1.1 材料与仪器设备
817肉鸡由南京黄教授食品科技有限公司提供,平均活重1.2 kg。5,5-二硫代-2-硝基苯甲酸(DTNB)、氯化钾、磷酸二氢钾、磷酸氢二钾、五水硫酸铜等均为国产分析纯。
RC-4温度记录仪购自杭州美控自动化技术有限公司;CR-400手持色差仪购自日本Konia Minolta公司;FE20手持pH计购自瑞士Metler Toledo公司;C-LM3B数显式肌肉嫩度仪购自北京布拉德科技发展有限公司;Ultra TurraxT25高速匀浆机购自德国IKA公司;JY LabramHR800显微激光拉曼仪购自法国Jobin-Yvon公司;TECAN多功能酶标仪购自德国IKA公司;Zs90Zeta电位仪购自英国马尔文公司。
1.2 试验方法
1.2.1 样品处理将45块新鲜鸡胸肉剔除筋膜,修整成大小均一的椭圆形,长约10 cm,宽约5 cm,质量为(200±10)g,随机分成5组,每组9块。1组为对照组(室温,CK),其余4组样品插入RC-4温度记录仪后于-20 ℃冷库冷冻24 h(中心温度-18 ℃)。分别采用空气解冻(KQ)、流水解冻(LS)、超声波解冻(CS)和低温解冻(DW)4种方法处理,当肉样中心温度达到0 ℃时视为解冻完成。具体解冻方式见表1。

表1 鸡胸肉的4种解冻方式Table 1 Four thawing methods of chicken breast
1.2.2 pH值的测定将手持pH计插入解冻后的样品中测定pH值,每个样品在不同位置测3次,取平均值[4]。
1.2.3 解冻损失、蒸煮损失和滴水损失的测定[4]解冻损失率:鸡肉样品解冻前称重记为m1,解冻后用滤纸吸干表面水分再称重并记为m2。解冻损失率=(m1-m2)/m1×100%。
蒸煮损失率:从每块样品上切取约80 g(m1)肉于自封袋中并做好标记,水浴加热至中心温度75 ℃,保温30 min,取出冷却至室温,用滤纸擦干表面水分后称重并记为m2。蒸煮损失率=(m1-m2)/m1×100%。
滴水损失率:沿着肌纤维方向从各组肉样上切取3 cm×2 cm×1 cm的肉块称重记为m1,用铁丝钩住一端,使肌纤维垂直向下悬挂于一次性纸杯中,保鲜膜封口后在4 ℃冰箱中放置24 h后称重并记为m2。滴水损失率=(m1-m2)/m1×100%。
1.2.4 色泽和剪切力的测定手持色差仪测定肉样L*值(亮度值)、a*值(红度值)和b*值(黄度值)。每个样品在不同位置测3次,取平均值[4]。
剪切力:沿着肌纤维方向将测完蒸煮损失率的样品切成3 cm×1 cm×1 cm的3个肉条,用嫩度仪垂直肌纤维方向进行剪切,每个肉条剪切1次,结果取平均值[4]。
1.2.5 低场核磁共振分析将各组鸡胸肉切成2 cm×2 cm×1 cm的肉块并用保鲜膜包好放入核磁检测管中,线圈温度32 ℃,在质子共振频率21 MHz下使用CPMG序列测定T2弛豫时间。扫描16次,重复获取 4 096 个回波数据,拟合0.01~3 000 ms的弛豫时间。
1.2.6 肌原纤维蛋白(MP)的提取以及溶解度和浊度的测定采用Traore等[7]的方法提取MP。采用Martini等[8]的方法,取2 mL MP(2 mg·mL-1)于10 mL离心管中,2 000g4 ℃条件下离心20 min。用双缩脲试剂法测定上清液的蛋白浓度。溶解度=上清液蛋白浓度/原蛋白浓度×100%。将2 mg·mL-1MP在600 nm处的吸光值作为浊度。
1.2.7 粒径和Zeta电位以及总巯基含量的测定采用Su等[9]的方法,将1 mg·mL-1MP用0.22 μm过滤器(水系)过滤后,采用Zs90Zeta电位仪测定粒径和Zeta电位。采用Xue等[10]的方法测定总巯基含量。
1.2.8 拉曼光谱分析采用Sun等[11]的方法,用50×透镜的显微镜将激光束聚焦在蛋白上,采集400~4 000 cm-1的信号。具体参数:扫描2次,曝光60 s,分辨率2 cm-1,采样速度120 cm-1·min-1。用PeakFit 4分析二级结构的百分比。
1.2.9 三级结构的测定采用Li等[12]的方法,使用TECAN多功能酶标仪测定0.1 mg·mL-1MP的荧光发射光谱,激发波长295 nm,发射波长300~400 nm,狭缝宽度20 nm,扫描速率1 200 nm·min-1。
1.3 数据分析
采用SAS 9.0软件进行单因素方差分析(ANOVA),采用Duncan’s多重比较分析差异显著性,显著水平设为0.05。使用Origin 2021软件作图。

图1 不同解冻方式肉样中心温度的变化曲线Fig.1 Variation curve of meat sample center temperature under different thawing methods
2 结果与分析
2.1 解冻过程中鸡肉中心温度的变化情况
由图1可知:4种解冻方式解冻速率由大到小依次为LS、CS、KQ、DW,解冻时间分别为24.2、56.8、174.3、660.0 min。此外,4种解冻方式在肉的中心温度为-18~-5 ℃时解冻速率较快,在-5~-1 ℃时解冻速率减小。
2.2 不同解冻方式对鸡胸肉食用品质的影响
由表2可知:处理组与CK组的pH值无显著性差异(P>0.05)。CK组的蒸煮和滴水损失率最低。与其他处理组相比,LS组的解冻、蒸煮和滴水损失率最低,而DW组的解冻、蒸煮和滴水损失率最高。CK组的L*值和a*值显著高于KQ、CS和DW组(P<0.05),处理组之间L*值和a*值无显著性差异,CK、KQ和LS组的b*值显著高于CS和DW组。DW组的剪切力值显著高于KQ组,且CK、KQ、LS和CS组之间无显著性差异。表明解冻过程对鸡胸肉pH值无影响,对剪切力影响较小,对色泽有显著影响,CK和LS组的保水性较好,KQ和DW组较差。
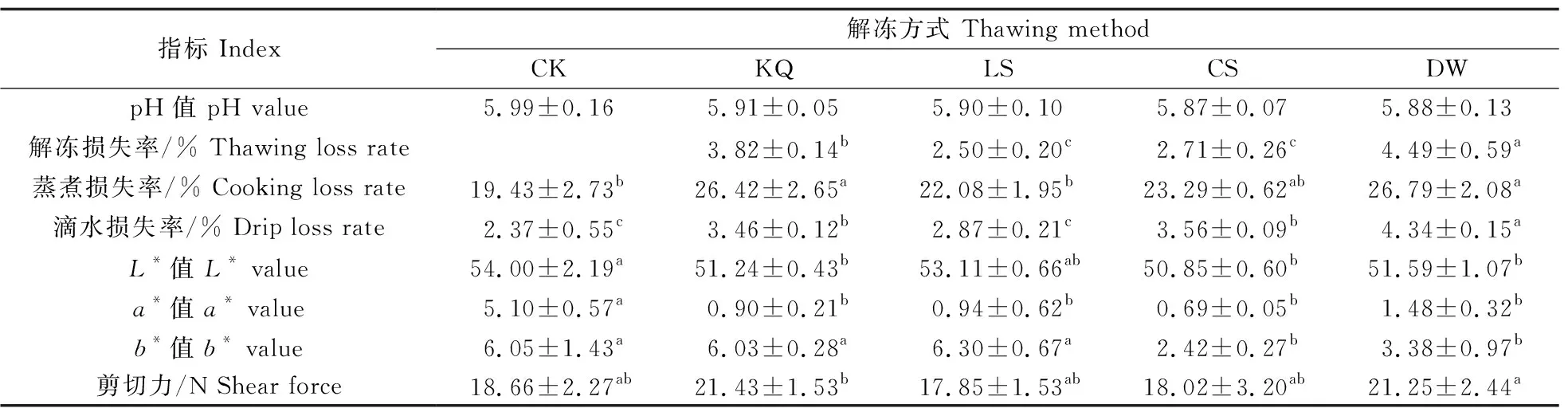
表2 不同解冻方式对鸡胸肉食用品质的影响Table 2 The effect of different thawing methods on the edible quality of chicken breast
2.3 不同解冻方式对鸡胸肉水分分布的影响
由图2-A可知:低场核磁出峰时间分别为1~10 ms(T2b)、10~100 ms(T21)和100~1 000 ms(T22),分别对应结合水、不易流动水和自由水。由图2-B可知:不同解冻方式对鸡胸肉T2弛豫时间有显著影响(P<0.05)。CK组的T2b、T21和T22最短而DW组最长。LS组的T2b显著短于KQ组,KQ和LS组的T21显著短于CS组,LS和CS组的T22显著短于KQ组。表明,与CK组相比解冻过程延长了T2弛豫时间,使不易流动水向自由水迁移。由图2-C可知:不同解冻方式对鸡胸肉T2峰比例有显著影响。CK、LS和DW组的结合水比例显著高于KQ和CS组,CK和LS组的不易流动水比例显著高于DW组,KQ、CS、DW组的自由水比例显著高于LS组。表明CK和LS组含有较多的结合水和不易流动水,其他3个处理组表现出不易流动水向自由水迁移的趋势,与保水性结果相一致。

图2 不同解冻方式对鸡胸肉水分分布(A)、T2弛豫时间(B)和T2峰比例(C)的影响Fig.2 The effect of different thawing methods on chicken breast water distribution(A), T2 relaxation time(B)and T2 peak ratio(C)
2.4 不同解冻方式对鸡胸肉肌原纤维蛋白(MP)特性的影响
2.4.1 不同解冻方式对MP溶解度和浊度的影响由图3可知:CK组的溶解度显著高于处理组,LS组显著高于KQ和DW组。DW组的浊度显著高于CK和3个处理组,CK和LS组显著低于其他3个处理组,KQ和CS组之间无显著性差异,与溶解度结果相对应。表明解冻过程增加了蛋白的聚集,处理组中LS和CS组的聚集程度较小,KQ和DW组较大。

图3 不同解冻方式对肌原纤维蛋白溶解度和浊度的影响Fig.3 The effect of different thawing methods on the solubility and turbidity of myofibril protein
2.4.2 不同解冻方式对MP粒径和Zeta电位的影响由图4-A可知:DW组的粒径显著高于CK组(P<0.05),处理组之间无显著性差异,而KQ和DW组的粒径要大于LS和CS组。表明解冻过程导致蛋白的聚集,DW组的聚集程度最大,LS组最小。由图4-B可知:CK组Zeta电位的绝对值显著高于处理组,DW组显著低于CS组,KQ、LS和CS组之间无显著性差异。表明解冻过程改变了MP的稳定性,CK组最稳定,DW组最不稳定。
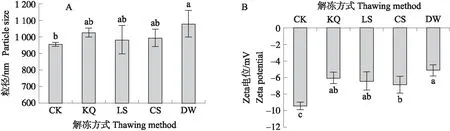
图4 不同解冻方式对肌原纤维蛋白粒径(A)和Zeta电位(B)的影响Fig.4 The effect of different thawing methods on particle size(A)and Zeta potential(B)of myofibril protein
2.4.3 不同解冻方式对MP总巯基的影响由图5可知:CK组的总巯基含量显著高于处理组,LS和CS组显著高于KQ和DW组。表明解冻过程导致蛋白的氧化,LS和CS组的氧化程度低于KQ和DW组。
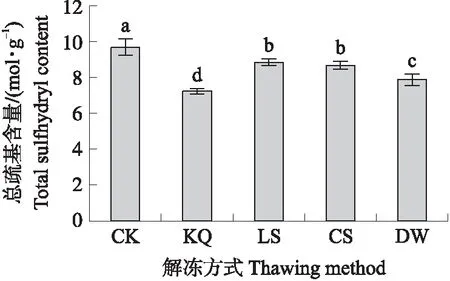
图5 不同解冻方式对肌原纤维蛋白总巯基 含量的影响Fig.5 The effect of different thawing methods on the total sulfhydryl content of myofibril protein
2.4.4 不同解冻方式对MP二级结构的影响由图6可知:CK组α-螺旋的含量最高(48.23%),其次是LS组(36.09%),DW组(30.26%)最低。处理组的β-折叠含量都高于CK组。CS组β-转角的含量最高,CK组最低。CK组和DW组无规则卷曲的含量高于其他3个处理组。表明解冻过程对MP二级结构的比例产生了影响,表现为α-螺旋的减少和β-折叠的增加。
图6 不同解冻方式对肌原纤维蛋白二级结构比例的影响Fig.6 The effect of different thawing methods on myofibril protein secondary structure ratio
2.4.5 不同解冻方式对MP三级结构的影响由图7-A可知:CK组的荧光强度最高,其次是LS组,其他3个处理组的荧光强度相对接近但都远离CK组。表明解冻过程对MP三级结构产生了影响,其中LS组的影响最小,对其他3个处理组影响较大。由图7-B可知:处理组的最大荧光发射波长(λmax)出现了显著的红移(向更长的波长),但LS组的λmax显著短于其他3个处理组。
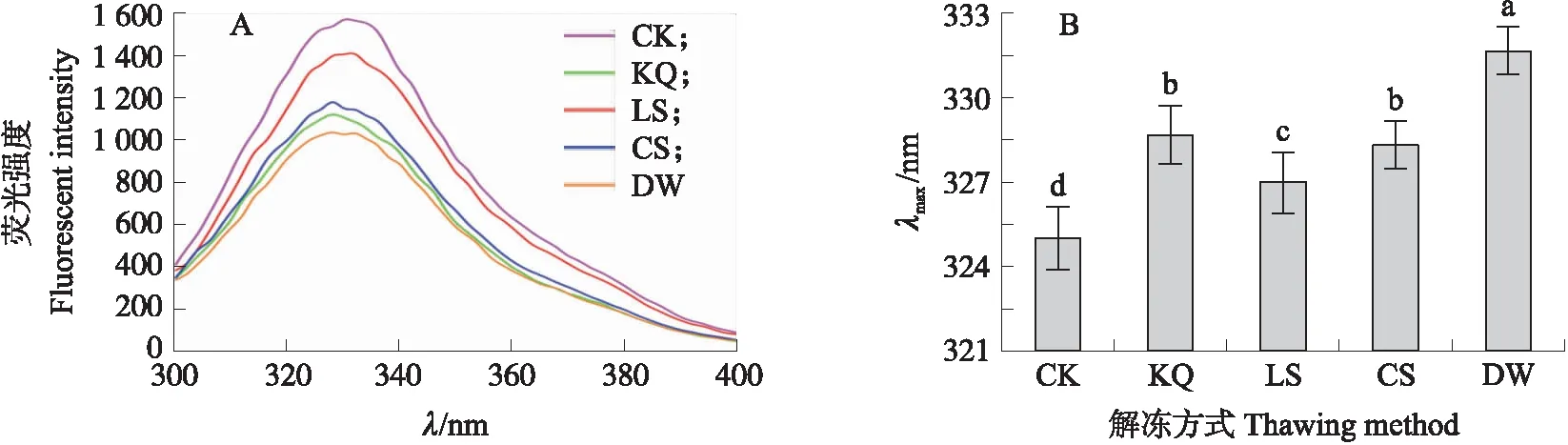
图7 不同解冻方式对肌原纤维蛋白荧光光谱(A)和λmax(B)的影响Fig.7 The effect of different thawing methods on the fluorescence spectrum(A)and λmax(B)of myofibril protein
3 讨论
流水解冻和超声波解冻热交换效率高,解冻时间短,而空气解冻热交换效率低,低温解冻温度低,所以解冻时间长。本研究中,4种解冻方式的解冻速率在-18~-5 ℃较快,-5~-1 ℃较慢,可能是因为-5~-1 ℃是肉的最大冰晶形成区,此区域肉的导热系数降低,同时-5~-1 ℃也是解冻时最大冰晶融化的温度带,冰晶融化时会释放大量潜热,使得鸡胸肉和水的温差变小,所以解冻速率减小。
本研究表明,解冻过程对pH值无显著影响,LS和CS组的保水性指标都优于KQ和DW组,DW组a*值的平均值大于其他3个处理组,处理组的剪切力值均出现了不同程度的增加。可能是因为鸡胸肉已经度过了僵直期,糖酵解酶和蛋白酶的作用已完成,pH值较稳定,不再受冷冻和解冻的影响[13]。保水性是反映肉质的重要指标,解冻过程增加了肉样的汁液流失,因为蛋白质氧化生成二硫键和羰基改变了肌肉蛋白结构,导致肌肉细胞损伤,降低了保水能力[14]。本试验中LS和CS组的解冻时间短,氧化程度小,保水性较好。KQ、LS和CS组的解冻温度较高,导致肌肉的部分细胞骨架蛋白变性使得细胞中亚铁血红素水解,降低了红度值[15]。嫩度是评定肉品质的重要指标,剪切力可以客观反映肉的嫩度[16]。本试验中处理组的剪切力值增加,可能是因为解冻过程发生汁液流失,导致只有少量的水用于水合肌纤维,增加了肉的韧性[17]。低场核磁共振可用来分析肉样中水的含量、分布和流动性[18]。本研究表明,处理组的T2弛豫时间与CK组相比均出现了不同程度的延长,LS组的结合水和不易流动水含量最高,自由水含量较少。说明解冻会导致不易流动水向自由水迁移,而LS组只有很少的结合水和不易流动水转变成自由水,因为结合水和不易流动水能够抵抗冻融[19],所以LS组的保水性较好,这与Zheng等[20]的研究结果一致。溶解度和浊度是评估MP聚集的指标[21]。本研究表明,CS组的溶解度较高,CK和LS组的浊度最小,表明MP聚集程度较小,可能是超声波的空化作用破坏了控制蛋白聚集体分子间交联的物理力,使得溶解度增加[22]。本研究中,浊度的结果与溶解度相对应,可能是因为具有较小的粒径和较大的绝对Zeta电位[23]。较小的粒径导致蛋白质颗粒之间表面积增大,对溶液的稳定性有积极作用,与Shen等[24]的研究结果蛋白质颗粒尺寸的减小有利于提高乳液的稳定性相类似。
总巯基的减少可以反映蛋白的氧化。本研究表明,处理组的总巯基含量均低于CK组,表明解冻过程导致了蛋白氧化,因为解冻可以加速巯基氧化成二硫键,还会导致MP的解折叠[25],也可能是因为解冻导致肌肉细胞的破裂,释放了氧化酶和过氧化物,加剧了蛋白的氧化[26]。蛋白的氧化还会导致粒径的增加和蛋白的聚集[27],这也解释了KQ和DW组的粒径较大的原因。
拉曼光谱常用来分析蛋白质二级结构的变化。本研究表明,处理组α-螺旋的含量均低于CK组,而β-折叠含量都高于CK组,LS组的荧光光谱强度最接近CK组,其他3个处理组则远离CK组。可能是因为α-螺旋转变成了β-折叠,与Sun等[28]和Shao等[29]的研究结果类似。α-螺旋是依靠蛋白质多肽链羰基氧和氨基氢之间的氢键来稳定结构[30],α-螺旋的减少表示肌球蛋白发生解旋,因为蛋白质中α-螺旋主要在肌球蛋白中,解旋的发生会影响蛋白质骨架的稳定性[31]。内源性荧光光谱法常用来跟踪食品加工中蛋白质三级结构的变化。当三级结构遭到破坏时,内源性色氨酸和其他疏水氨基酸残基会脱离蛋白质核心,使得荧光强度降低[22],所以可以通过测定荧光强度和λmax来分析蛋白质三级结构。本研究中,处理组的λmax都出现了红移,可能是由于蛋白质的氧化和聚集引起的[32],也可能是因为色氨酸残基在解冻过程中发生解折叠而变得更加极性,破坏了蛋白质的三级结构[33]。
综上所述,不同解冻方式对鸡胸肉的食用品质、水分分布,肌原纤维蛋白的溶解度、粒径、总巯基含量以及二、三级结构会产生不同程度的影响。流水解冻的鸡胸肉保水性、色泽、嫩度最佳,肌原纤维蛋白的聚集和氧化程度小并且具有相对稳定的二级和三级结构。本研究结果为817肉鸡在生产加工中选择合适的解冻方式提供参考。

