血清ESM-1、miR-498水平变化与肺腺癌患者预后的关系
王丽宁,温婷
宝鸡市人民医院血液肿瘤内科,陕西 宝鸡 721000
肺癌是全球发病率和致死率最高的癌症,每年约新增180万例,死亡人数占癌症的30%[1]。肺腺癌是一种源自于支气管黏膜上皮的肺癌,是肺癌中较为常见的一种[2]。肺腺癌患者初期并无明显症状,少数可出现咳嗽、痰血、低热、气闷等症状,导致确诊时已到达中晚期[2]。目前常采用肺癌根治术进行治疗,治疗效果较好,但复发率也较高,严重影响患者预后[3],因此对肺腺癌患者进行预后评估具有十分重要的临床意义。目前临床上常用的肺腺癌预后预测血清指标有CY211、SCC、CEA等,但特异度和灵敏度均欠佳。血清内皮细胞特异性分子(endothelial cell specific molecules-1,ESM-1)是一种内皮细胞所生成的可溶性蛋白聚糖,有研究发现其水平在肺癌的胸腔积液中具有较高的表达,且对于肺腺癌患者的预后预测具有一定的意义[4]。微小RNA-498(Microrna,miR-498)属于抑癌miRNA,可对肺癌相关的抑癌基因和蛋白进行控制,进而起到抑癌的效果,有研究认为miR-498 在肺癌的发生和发展中发挥着重要的作用[5]。ESM-1和miR-498 在国外已被大量运用于患者预后预测中,但在国内研究仍较少。本研究旨在探讨血清ESM-1、miR-498水平变化与肺腺癌患者预后的关系。
1 资料与方法
1.1 一般资料 选取宝鸡市人民医院2017 年5月至2020 年1 月收治的94 例肺腺癌患者作为研究对象。纳入标准:(1)符合《临床肺癌学》[6]中肺腺癌诊断标准;(2)经病理学检查确诊为肺腺癌;(3)精神状态良好可配合治疗者;(4)初次治疗者。排除标准:(1)患者出现脑、脊髓癌细胞转移;(2)患者合并其他类型肿瘤;(3)患者存在严重肝肾功能异常;(4)患者临床资料不完整。患者出院后随访一年,如出现转移、复发、死亡则列入预后较差组,反之则列入预后良好组,其中预后良好组57例,男性30例,女性27例;年龄40~78岁,平均(59.65±5.43)岁;TNM 肿瘤分期:Ⅰ期18 例,Ⅱ期22 例,Ⅲ期17 例;有淋巴结转移31 例,无淋巴结转移26 例。预后较差组37 例,男性19 例,女性18 例;年龄41~79 岁,平均(59.42±5.38)岁;TNM 肿瘤分期:Ⅰ期11例,ⅡI 期13 例,Ⅲ期13 例;有淋巴结转移21 例,无淋巴结转移16 例。两组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性。本研究经我院伦理学委员会审核并通过,患者及其家属知情并签署知情同意书。
1.2 检测方法 两组患者均接受相同的治疗方案,在患者治疗前和治疗结束后抽取患者空腹静脉血2.5 mL,高速离心,分离血清送至检验科。血清ESM-1选取上海信裕生物科技有限公司生产的血清ESM-1试剂盒,使用时首先用50 μL 去离子水稀释标准品,将盖子盖好后静置10 min,随后反复摇晃均匀,此时标准品浓度为200 ng/mL,分别稀释至200 ng/mL、100 ng/mL、50 ng/mL、25 ng/mL、12.5 ng/mL、6.25 ng/mL、3.125 ng/mL。将试剂盒内的50 mL 洗涤浓缩液与去离子水混合为500 mL 洗涤液。向抗体原液内加入4 mL抗体稀释液,随后再将抗体稀释液配置为10 mL 抗体工作液,震荡摇匀。配置空白孔、标准孔和待测样品孔,向空白孔加入100 μl 去离子水,剩余孔则加入100 μL标准品,期间避免气泡产生,将样品加入酶标板孔的底部,不与孔壁接触,震荡摇匀,将封板膜覆于酶标板,震荡2 h。轻轻揭掉封板膜,舍弃液体,甩干,连续洗板5 次并拍干,每个孔内滴加100 uL 抗体工作液,并振荡孵育2 h。再轻轻揭掉封板膜,舍弃液体,甩干,连续洗板5 次并拍干,孔内加入100 μL 上海源叶生物有限公司的辣根过氧化物酶对亲和素工作液进行标记,常温震荡45 min。将100 μL 底物显示液加入孔内,并振荡摇匀15 min,将50 μL终止溶液加入孔内后,采用德朗医疗设备有限公司的DR-200Βc 酶标仪进行检测,在450 nm 波长下对每个孔的光密度进行测量。MiRⅡ498 采用实时荧光定量聚合酶链反应进行检测。
1.3 观察指标 比较两组患者治疗前和治疗3个月后的血清ESM-1、miR-498水平;分析患者不同临床特征(性别、年龄、TNM类型、是否存在淋巴结转)与血清ESM-1、miR-498水平关系。
1.4 统计学方法 应用SPSS20.0 统计软件进行数据统计分析。计量资料符合正态分布,以均数±标准差(±s)表示,组间比较采用独立样本t检验,组内比较采用配对样本t 检验;计数资料组间比较采用χ2检验,多因素分析采用Logistic 回归分析检验,绘制受试者工作特征曲线(receiver operating characteristic,ROC)分析血清ESM-1、miR-498对患者预后的预测价值。以P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者治疗前后的血清ESM-1、miR-498水平比较 治疗前,两组患者的血清ESM-1、miR-498水平比较差异均无统计学意义(P<0.05);两组患者治疗后的血清ESM-1、miR-498 水平明显低于治疗前,差异均有统计学意义(P<0.05);治疗后,预后较差组患者的血清ESM-1 水平明显高于预后良好组,miR-498水平明显低于预后良好组,差异均具有统计学意义(P<0.05),见表1。
表1 两组患者治疗前后的血清ESM-1、miR-498水平比较(±s)
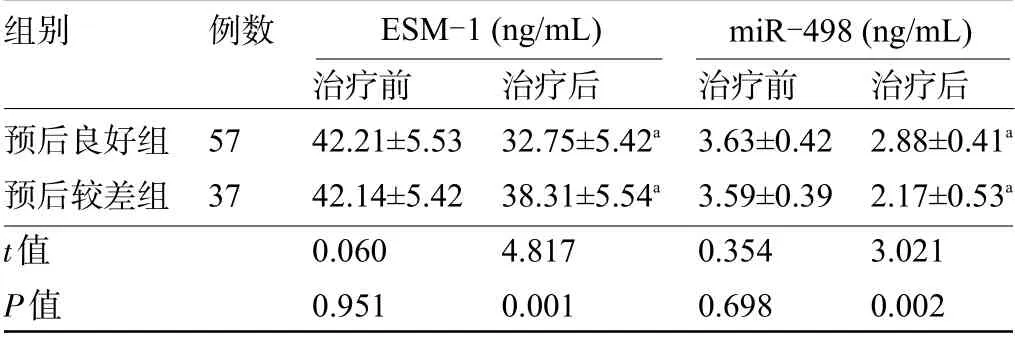
表1 两组患者治疗前后的血清ESM-1、miR-498水平比较(±s)
注:与本组治疗前比较,aP<0.05。
组别预后良好组预后较差组t值P值例数57 37治疗前42.21±5.53 42.14±5.42 0.060 0.951治疗后32.75±5.42a 38.31±5.54a 4.817 0.001治疗前3.63±0.42 3.59±0.39 0.354 0.698治疗后2.88±0.41a 2.17±0.53a 3.021 0.002 ESM-1(ng/mL) miR-498(ng/mL)
2.2 不同临床特征患者的血清ESM-1 水平比较 不同年龄、性别患者的血清ESM-1水平比较差异均无统计学意义(P>0.05);TNM 分期>Ⅱ期患者的血清ESM-Ⅰ水平明显高于≤Ⅱ期患者,有淋巴结转移患者的血清ESM-Ⅰ水平明显高于无淋巴结转移患者,差异均具有统计学意义(P<0.05),见表2。
表2 不同临床特征患者的血清ESM-1水平比较(±s,ng/mL)

表2 不同临床特征患者的血清ESM-1水平比较(±s,ng/mL)
临床特征年龄(岁)>65≤65性别男女TNM>Ⅱ≤Ⅱ是否存在淋巴结转移是否例数52 42 49 45 31 63 42 52血清ESM-1 34.95±5.46 34.92±5.48 34.89±5.49 34.99±5.41 40.99±5.48 31.96±5.47 39.84±5.42 30.98±5.56 t值0.026 0.189 7.520 7.768 P值0.979 0.568 0.001 0.001
2.3 不同临床特征患者的血清miR-498 水平比较 不同年龄、性别患者的血清miR-498 水平比较差异均无统计学意义(P>0.05);TNM 分期>Ⅱ期患者的血清miR-498 水平明显低于≤Ⅱ期患者,有淋巴结转移患者的血清miR-498 水平明显低于无淋巴结转移患者,差异均有统计学意义(P<0.05),见表3。
表3 不同临床特征患者的血清miR-498水平比较(±s,ng/mL)

表3 不同临床特征患者的血清miR-498水平比较(±s,ng/mL)
临床特征年龄(岁)>65≤65性别男女TNM>Ⅱ≤Ⅱ是否存在淋巴结转移是否例数52 42 49 45 31 63 42 52血清miR-498 2.64±0.45 2.56±0.40 2.63±0.42 2.57±0.44 2.46±0.47 2.67±0.41 2.38±0.48 2.78±0.38 t值0.900 0.676 2.224 4.510 P值0.370 0.501 0.029 0.001
2.4 影响患者预后的因素 经多因素Logistic回归分析结果显示,血清ESM-1和miR-498是影响患者预后的独立危险因素(P<0.05),见表4。

表4 影响患者预后因素的多因素logistic回归分析
2.5 血清ESM-1、miR-498对肺腺癌患者预后的预测价值 经ROC分析结果显示,血清ESM-1 对肺腺癌患者预后的预测灵敏度、特异度、阳性预测值以及阴性预测值明显优于miR-498,而血清ESM-1 与miR-498联合检测对患者预后的预测灵敏度、特异度、阳性预测值以及阴性预测值明显优于各项指标单独检测,差异均有统计学意义(P<0.05),见表5和图1。

表5 血清ESM-1、miR-498对肺腺癌患者预后的预测价值

图1 血清ESM-1、miR-498对肺腺癌患者预后的预测ROC曲线图
3 讨论
肺腺癌具有恶性程度高、转移性高和侵袭能力强的特点[7-9]。随着人们医学技术的进步,对于肺腺癌的治疗方法也变得多样化,包括肺癌根治术、靶向治疗、放化疗等,疗效得到明显提高,同时有效降低患者不良反应[10-11]。但术后复发和转移的患者仍较多,中远期预后效果不佳,所以治疗后早期对于患者预后效果预测较为重要[12-13]。近些年来,血清生物学在肺癌的预后预测中研究颇多,为此展开研究,为临床的诊治提供理论基础。
血清ESM-1 是一种位于人体第5 号染色体上的可溶性蛋白聚糖[14]。其主要分布于肝、肾等组织的血管内皮细胞内,是任意血管内皮细胞功能异常以及细胞增生的特异性标志物。ESM-1 在肿瘤的发生和发展中能够对肿瘤内部血管进行调控,进而影响体内的炎性反应。有研究发现,ESM-1参与到肿瘤细胞的黏附中,同时在晚期患者患者中明显增高[15]。本研究发现,治疗后,预后较差组患者的血清ESM-1 水平明显高于预后良好组,与上述研究结论相一致。ESM-1对于细胞黏附的调节和炎性反应的控制都是促进肿瘤进展的关键,同时能够和胰岛素样生长因子起到共同效果,对细胞的生长和发育起到重要的作用[16]。本研究发现,TNM分期>Ⅱ期患者血清ESM-1显著高于≤Ⅱ期患者,存在淋巴结转移患者血清ESM-1显著高于不存在淋巴结转移患者,这可能是因为,TNM分期>Ⅱ期以及淋巴结转移的患者往往肿瘤已经发展至中晚期,血清ESM-1 水平明显升高[17]。本研究发现,血清ESM-1是影响肺腺癌患者预后的独立危险因素,说明血清ESM-1 能够作为肺腺癌患者预后的预测指标。MiRNAs是一种具有高度保守化的小分子非编码单链RNA。miR-498 作为其中一种,能够对部分与肿瘤发生、发展及转移相连的蛋白和抑癌基因进行调控,在癌症的发生和发展中发挥着重要的作用[18-19]。本研究显示,治疗后miR-498 水平明显低于预后良好组,国外有学者认为,miRNA-498水平与肺癌患者分期和淋巴结转移存在明显的相关性[20],这与本研究结果一致。血清miRNA-498 是影响肺腺癌患者预后的独立危险因素,说明血清miRNA-498可作为肺腺癌患者预后的预测指标。本研究发现,血清ESM-1与miR-498联合检测对于患者预后的预测灵敏度、特异度、阳性预测值以及阴性预测值明显优于各项指标单独检测(P<0.05)。说明两种指标的联合检测能够弥补各指标检测的不足之处,提高预测价值。但本次研究可能因为研究病例较少,导致实验存在一定偏差,以后扩大病例的收集以弥补此不足。
综上所述,血清ESM-1以及miR-498的水平变化与肺腺癌患者预后存在明显的相关性,两种指标联合检测对肺腺癌患者预后具有较好的评估价值,可有效运用于临床诊治中。

