QuEChERS 结合气相色谱-质谱法同时测定果脯中16 种多环芳烃
苏 满,卢 劼,劳敏军,邓尚贵,祝世军,吴益春,周 勇,胡 艺,于 瑾
(1.浙江海洋大学食品与药学学院,浙江舟山 316022;2.浙江省农都农产品有限公司,浙江杭州 310004;3.浙江兴业集团有限公司,浙江舟山 316120;4.舟山市食品药品检验检测研究院,浙江舟山 316000;5.浙江恒和食品有限公司,浙江舟山 316000;6.龙游县养殖业发展中心,浙江龙游 324000)
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是指含2 个或2 个以上苯环的芳烃,是一种持久性有机污染物,由于分子结构稳定,不容易被降解,这类化合物广泛存在于水、空气和土壤等环境中,且具有毒性、诱变性、致畸性和致癌性,APARNA,et al[1]发现苯并[a]芘在0.2 mg·L-1浓度水平会对斑马鱼Danio rerio 的神经系统造成伤害,导致学习和记忆的缺陷;LI Fang,et al[2]研究发现多环芳烃会导致小鼠肝细胞膜损伤,肝系统的炎症和紊乱。目前研究显示多环芳烃可以通过食物链传递至人体,对人类构成极大的健康风险[3]。
多环芳烃在土壤[4]和水环境[5-6]中的研究较多,蔬菜[7]、茶叶[8]、烟熏制品[9-10]、烧烤制品[11-12]中也被发现有多环芳烃的检出。不同样品有不同的基质和杂质,因此多环芳烃的检测方法并不互相适用。目前对于多环芳烃的检测主要分为前处理和检测分析两个部分,前处理又分为提取和净化两个部分。多环芳烃的前处理方法较多,QuEChERS 是近年来最新发展起来的一种前处理方法,该方法可灵活选用提取方式和净化方式,具有操作简单、方便快捷、高效绿色等特点[13],在农残的检测中被广泛应用[14-15]。食品中对多环芳烃的检测方法有高效液相色谱[16-18]、液相色谱-质谱联用[19]、气相色谱[20]、气相色谱-质谱联用等方法[21-22]。果脯蜜饯广受欢迎,现在对于果脯中的多环芳烃残留问题和形成原因研究较少。本研究以果脯为研究对象,采用QuEChERS 作为前处理方法,优化前处理条件,结合气相色谱-质谱法,建立一种同时测定果脯中16 种多环芳烃的方法,为果脯中污染物的残留和形成原因提供基础支撑。
1 材料与方法
1.1 材料与试剂
5 种常见果脯共40 份(市售);16 种多环芳烃混合标准品:萘(NAP)、苊烯(ACY)、苊(ACE)、芴(FL)、菲(PHE)、蒽(ANT)、荧蒽(FLV)、芘(PYR)、苯并(a)蒽(BaA)(CHR)、苯并(b)荧蒽(BbF)、苯并(k)荧蒽(BkF)、苯并(a)芘(BaP)、茚(123-cd)芘(IND)、二苯并(ah)蒽(DBA)、苯并(ghi)苝(BghiP)(2 000 μg·mL-1,溶解于二氯甲烷,美国Accustandard 公司);正己烷、乙腈、二氯甲烷、三氯甲烷(均为色谱纯国药集团);30%过氧化氢、无水硫酸钠(均为分析纯国药集团);2%硫酸钠溶液、经Milli-Q 净化的超纯水(实验室自制)。
1.2 仪器与设备
GM200 型粉碎研磨机(德国莱驰公司);IKA/MS3 basic 型漩涡振荡器(德国IKA 公司);HP-5MS 弹性石英毛细管柱(30 m×0.25 mm,0.25 μm);7000D 气相色谱-三重四极杆质谱联用仪(美国安捷伦公司);KQ-600DV 数控超声波清洗仪(昆山市超声仪器有限公司);Multi Reax 型多孔位振荡混合器(德国Heidolph 公司);5804R 多功能冷冻离心机(德国Eppendorf 公司);11155 型氮吹仪(美国Organomation)。
1.3 方法
1.3.1 样品前处理
提取:准确称取研磨打碎好的样品5 g 置于50 mL 离心管中,加入500 ng·mL-1的16 种多环芳烃标准品,加入2.5 mL 2%硫酸钠溶液、1 mL 30% H2O2和10 mL 乙腈,添加1 粒陶瓷均质子,再加入QuEChERs盐包(6 g MgSO4和1.5 g NaOAc),振荡提取3 min,超声提取30 min,4 ℃8 000 r·min-1离心5 min,取上清液待净化。
净化:将待净化液转移至15 mL QuEChERs 净化管(1 200 mg MgSO4和400 mg PSA)中,漩涡振荡1 min,加入2 g 无水硫酸钠,4 ℃8 000 r·min-1离心5 min,取上清液氮吹至尽干,用混合溶液(乙腈:正己烷=1:1)定容至1 mL,过0.22 μm 滤膜,上机待测。
1.3.2 标准溶液的配制
溶液标准曲线的配制:用移液枪准确吸取16 种PAHs 混合标准溶液0.1 mL,用二氯甲烷定容至10 mL,得到20 μg·mL-1的混合标准溶液;再用逐级稀释的方法,得到1、10、50、100、500、1 000 ng·mL-1的标准溶液,现用现配。
1.4 前处理条件的优化
影响多环芳烃提取效率的因素有提取溶剂、提取方式、提取时间及提取温度。
1.4.1 提取溶剂的选择
多环芳烃极性较弱,易溶于有机试剂,故此实验选取常用的有机试剂。考察正己烷、乙腈、二氯甲烷、三氯甲烷作为提取溶剂对果脯中16 种PAHs 回收率的影响,以确定最佳的提取试剂。按照1.3.1 方法进行样品前处理,按照1.5 方法进行测定。
1.4.2 提取方式的选择
常用的提取方式有漩涡提取、振荡提取、超声提取,使用1.4.1 确定的最佳提取试剂提取,考察漩涡提取、振荡提取、超声提取以及漩涡-超声提取对16 种多环芳烃回收率的影响,以确定最佳的提取方式。按照1.3.1方法进行样品前处理,按照1.5 方法进行测定。
1.4.3 提取时间的选择
以1.4.1、1.4.2 中确定的最佳提取条件,考察振荡3 min,超声10、20、30 和40 min 条件下对16 种PAHs回收率的影响,确定最佳的超声时间。按照1.3.1 方法进行样品前处理,按照1.5 方法进行测定。
1.4.4 提取温度的选择
以1.4.1、1.4.2、1.4.3 中确定的最佳提取条件,分别考察10、20、30 和40 ℃溶剂体积下对16 种PAHs回收率的影响,以确定的最佳提取温度。按照1.3.1 方法进行样品前处理,按照1.5 方法进行测定。
1.5 色谱质谱条件
1.5.1 色谱条件
色谱柱:HP-5MS(30 m×0.25 mm,0.25 μm),反吹管:0.7 m×150 μm×0,色谱柱与反吹管连接,传输线温度280 ℃;进样量:1 μL;进样模式:不分流进样;色谱柱载气(He)流速:1.6 mL·min-1,恒定压力:135.1 kPa,到分流出口的吹气流量80 mL·min-1,吹扫0.75 min;升温程序:初始温度60 ℃保持1 min,以15 ℃·min-1升至110 ℃,保持1 min,以20 ℃·min-1升温至180 ℃,以2 ℃·min-1升温至203 ℃,以5 ℃·min-1升温至250 ℃,再以2 ℃·min-1升温至283 ℃,然后以20 ℃·min-1升温至310 ℃,保持3 min;反吹管载气(He)流速:3.3 mL·min-1,恒定压力:20.7 kPa。
1.5.2 质谱条件
离子源:电子轰击源,70 eV,离子源温度280 ℃,碰撞气(N2)流速:1.5 mL·min-1,淬灭气(He)2.25 mL·min-1,MRM 模式,16 种PAHs 离子对及碰撞能量见表1,色谱图如图1。
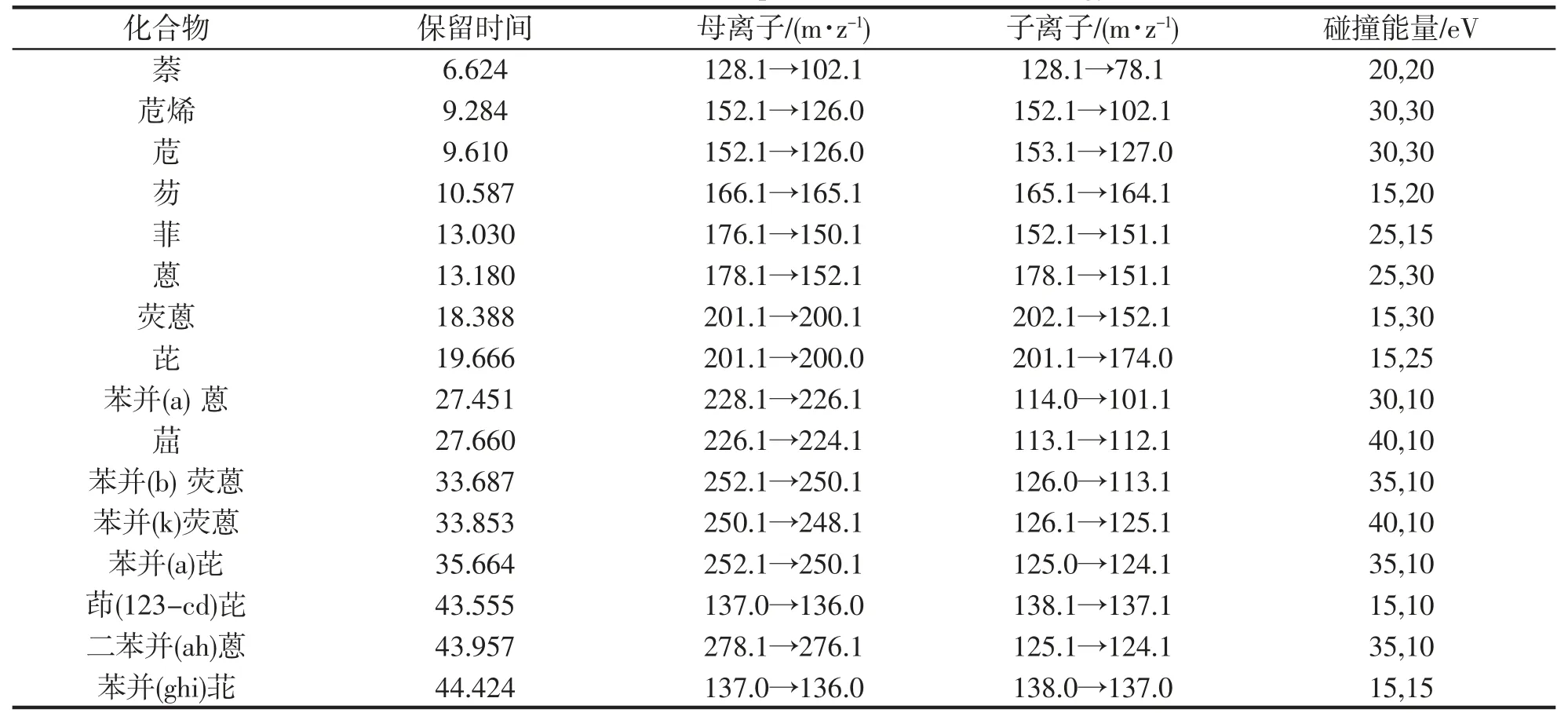
表1 16 种PAHs 离子对及能量Tab.1 16 PAHs ion pairs and collision energy

图1 16 种多环芳烃色谱图Fig.1 Chromatograms of 16 polycyclic aromatic hydrocarbons
2 结果与分析
2.1 提取条件的优化
2.1.1 提取溶剂的优化
由于多环芳烃的极性弱,化学性质比较稳定,常用有机试剂来提取,不同有机试剂提取效果不同。因此,本实验对比了乙腈、正己烷、二氯甲烷、三氯甲烷4 种有机试剂对果脯中16 种PAHs 的提取效果。实验表明,4 种试剂均能提取PAHs,正己烷的平均回收率为79.1%,乙腈的回收率为86.9%,二氯甲烷的回收率为64.8%,三氯甲烷的回收率为71.5%。果脯在工业加工后仍含有部分水,乙腈与水互溶,能与均浆后的样品充分反应,且提取效率好于正己烷;二氯甲烷、三氯甲烷毒性较大,极易挥发,综合考虑,本实验选用乙腈作为萃取溶剂。
2.1.2 提取方式的选择
常见的前处理提取方式有漩涡、振荡、超声等,本实验考察了这3 种提取方式与振荡-超声结合提取对PAHs 回收率的影响如图3,平均回收率分别为42.4%、49.8%、79.3%和86.2%。结果表明,漩涡振荡-超声提取效果最好。振荡可使溶剂与基质充分混合,超声会促使果肉细胞组织的破壁或变形,使提取更加充分,且超声适用性强,提取条件简单,因此本实验选择振荡-超声法提取多环芳烃。
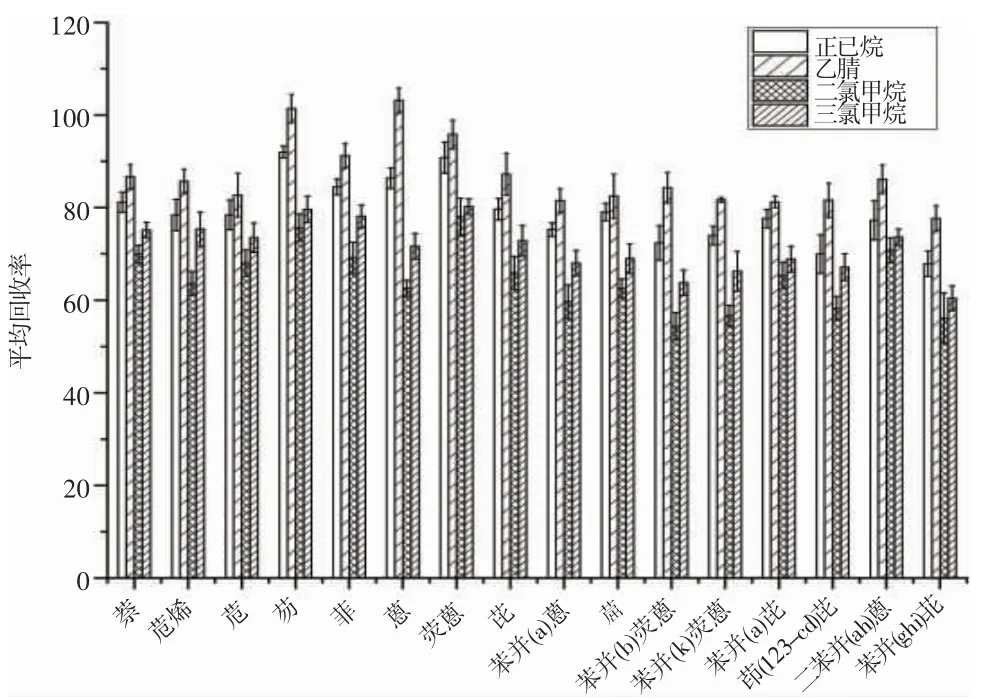
图2 不同溶剂提取下PAHs 的平均回收率Fig.2 Average recovery rate of PAHs under different solvent extraction

图3 不同提取方式下PAHs 的平均回收率Fig.3 Average recovery rate of PAHs under different extraction methods
2.1.3 提取时间的选择
不同超声时间提取对多环芳烃的平均回收率如图4 所示,本实验对比了10、20、30 和40 min 超声时间提取下,平均回收率分别为77.1%、82.2%、86.7%和84.7%。结果表明,超声提取时间为30 min 时提取效果最好。随着超声时间的增加,平均回收率呈现出先上升后下降的趋势,可能是超声时间过长,使样品杂质流出,影响提取效率。因此,本研究选用超声30 min 作为最佳超声时间。
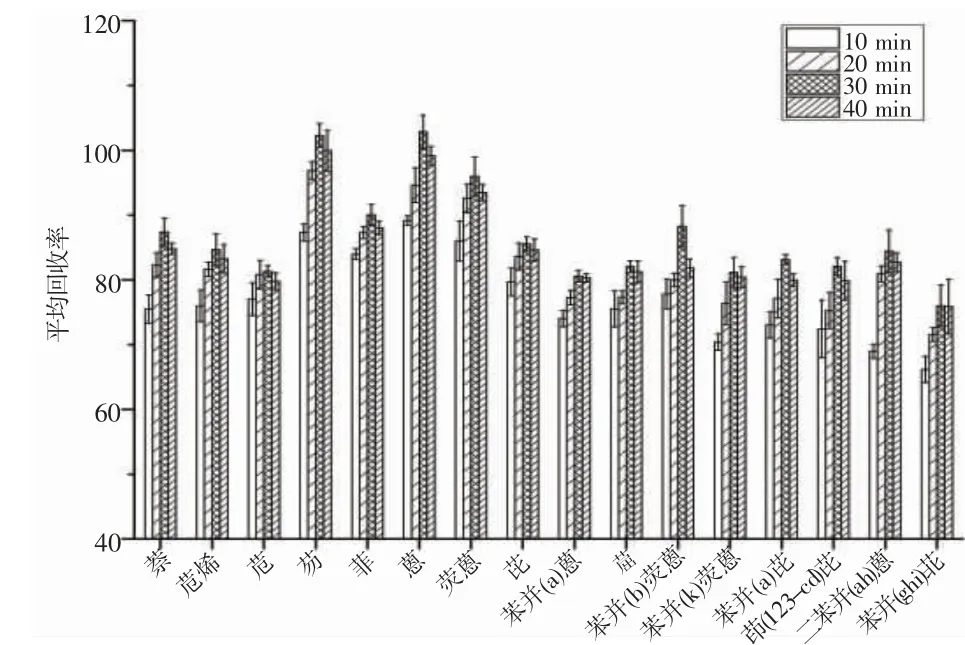
图4 不同超声时间提取下PAHs 的平均回收率Fig.4 Average recovery rate of PAHs under different ultrasonic time extraction
2.1.4 提取温度的选择
本研究对比了4 个超声提取温度对PAHs 的平均回收率如图5 所示,实验结果表明,在10 ℃时,平均回收率为81.9%;20 ℃时回收率为86.4%,30 ℃时回收率为85.8%,40 ℃时回收率为83.6%;20、30 ℃时回收率相差不大,10 ℃时回收率略低可能是因为温度较低影响了对基质的超声效果,40 ℃时,回收率下降可能是温度升高,部分目标物在提取过程中转移到空气中[23]。

图5 不同超声温度提取下PAHs 的平均回收率Fig.5 Average recovery rate of PAHs under different ultrasonic temperature extraction
2.2 方法的线性范围与检出限
溶液标准曲线的配制:用移液枪准确吸取16 种PAHs 混合标准溶液0.1 mL,用二氯甲烷定容至10 mL,得到20 μg·mL-1的混合标准溶液;再用逐级稀释的方法,得到1、10、50、100、500、1 000 ng·mL-1的标准溶液,现用现配。
按照1.3.2 方法分别配制浓度为1、10、50、100、500、1 000 ng·mL-1的标准溶液,以目标物对应的质量浓度为横坐标,以目标物对应的离子峰面积为纵坐标,建立线性回归方程并分析。按样品5 g,定容1 mL,以信噪比(S/N)为3 计算出检出限(LOD),以信噪比(S/N)为7 计算出限定(LOQ),结果表明16 种目标化合物多环芳烃在1~1 000 ng·mL-1范围内均呈现出良好的线性关系,相关系数(r)在0.998 0~0.999 9 范围内,检出限为0.43 ng·mL-1,定量限为1 ng·mL-1(表2)。该方法适用于果脯中16 种多环芳烃的同时检测。
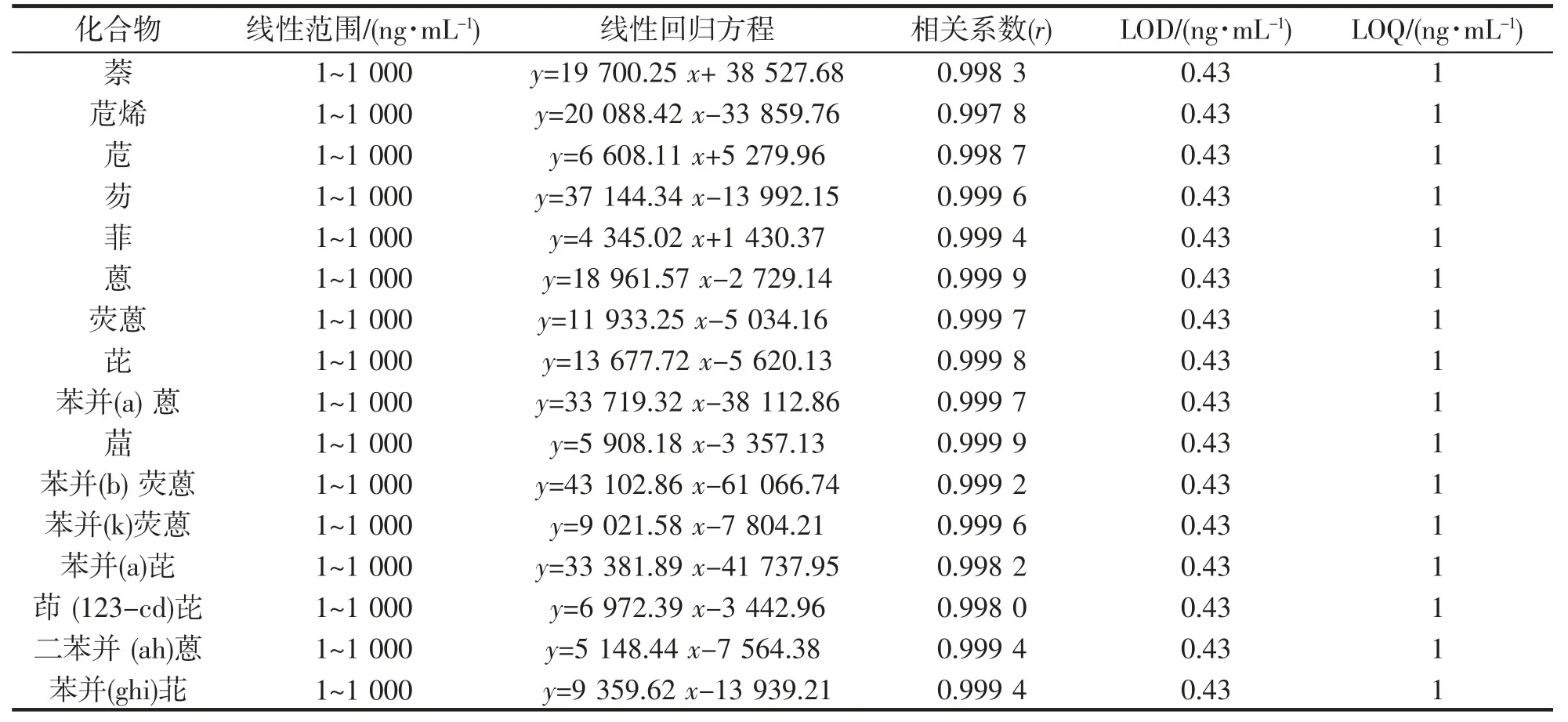
表2 16 种PAHs 线性方程及检出限、定量限Tab.2 16 kinds of PAHs linear equations and detection limit,quantification limit
2.3 方法的回收率与精密度
对果干样品进行加标回收实验,样品在1、10、200 μg·kg-13 个水平的加标回收率分别为79.8%~104.1%、78.3%~103.6%、80.1%~104.3%,相对标准偏差RSD 分别为1.9%~6.4%、1.5%~4.9%、1.4%~4.2%,结果表明方法的准确度和精密度符合污染物残留的分析检测要求(表3)。
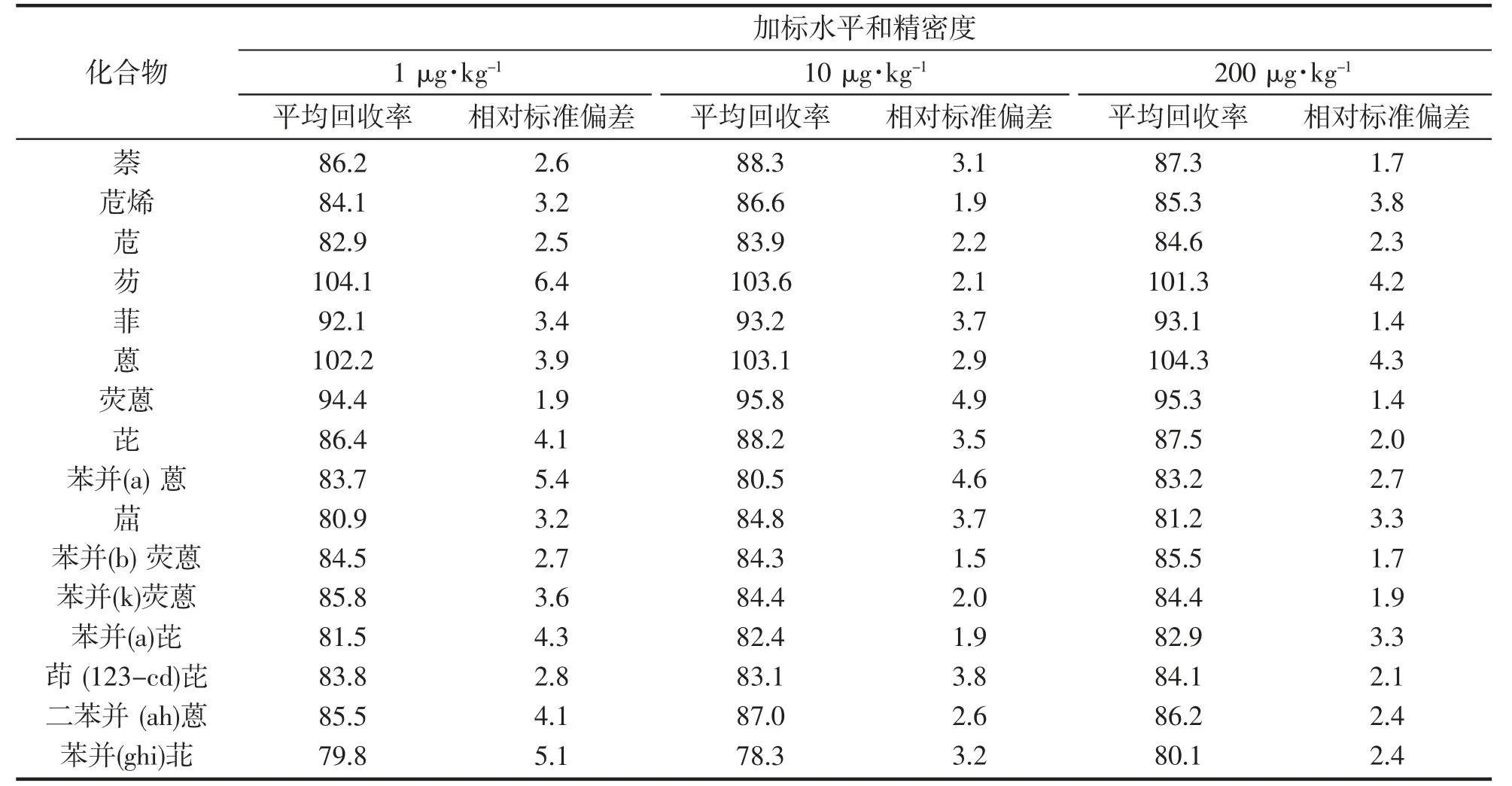
表3 16 种PAHs 平均加标回收率及相对标准偏差Tab.3 The average recovery rate and relative standard deviation of 16 PAHs
2.4 实际样品检测
采用本实验建立的方法,对市售40 份果脯样品进行检测,其中萘、苊、菲、荧蒽、芘、苯并(a)蒽、苯并(ghi)苝有检出;苊烯、芴、蒽、、苯并(b)荧蒽、苯并(k)荧蒽、苯并(a)芘、茚(123-cd)芘、二苯并(ah)蒽、苯并(ghi)苝未有检出。
如表4 所示,其中PAHs 总量超过15 μg·kg-1的有5 个样品,5 个样品中苊的平均检出量为16.13 μg·kg-1,应当引起重视。图6~10 分别为样品A、B、C、D、E 为色谱图。
图6 样品A 中多环芳烃色谱图Fig.6 Chromatogram of PAHs in sample A
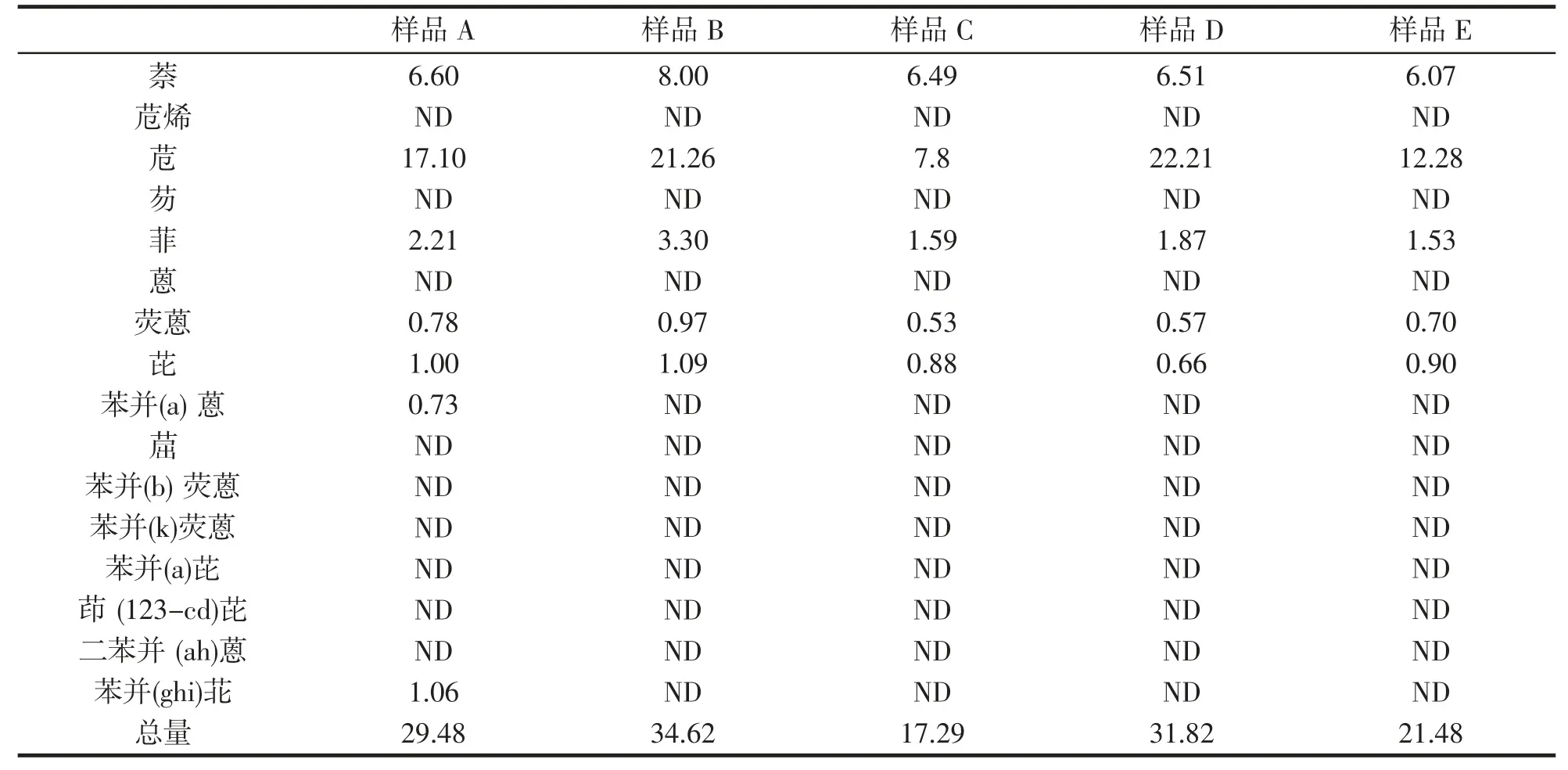
表4 PAHs 检出量过高样品(μg·kg-1)Tab.4 Samples with too high PAHs detection
图7 样品B 中多环芳烃色谱图Fig.7 Chromatogram of PAHs in sample B
图8 样品C 中多环芳烃色谱图Fig.8 Chromatogram of PAHs in sample C

图9 样品D 中多环芳烃色谱图Fig.9 Chromatogram of PAHs in sample D
图10 样品E 中多环芳烃色谱图Fig.10 Chromatogram of PAHs in sample E
3 结论
本文采用QuEChERS 法结合气相色谱-质谱法建立了同时测定果脯中16 种PAHs 的方法,通过对前处理条件的优化,实现了果脯中16 种PAHs 的精准定量和分析,能够较好得在实际样品检测中应用。该方法中16 种PAHs 浓度在1~1 000 μg·kg-1之间线性关系良好,3 个浓度水平加标回收率为78.3%~104.3%,相对标准偏差为1.4%~6.4%之间(n=6),方法的检出限为0.43 ng·mL-1,定量限为1 ng·mL-1,该方法操作简单、灵敏度高,能够满足日常检测分析要求,适合大批量样品处理。

