MRI技术在术前无创预测肾透明细胞癌WHO/ISUP核分级中的应用价值
孙 玮 李 杰 翟冬枝
肾透明细胞癌为肾细胞癌常见亚型,其患病率占70%~75%[1]。早期局限性肾透明细胞癌主要给予手术治疗,但患者预后存在较大差异。为此,评估肿瘤生物学行为在制定治疗方案和判断预后中发挥重要作用。2016年版世界卫生组织/国际泌尿病理学会(WHO/ISUP)是目前最新的病理核分级系统,且已证实在肾细胞癌中有较高的使用价值[2]。该分级系统共分4级,不同分级与手术治疗方案的选择与预后有紧密联系。磁共振成像(MRI)在肾细胞癌的诊断与肿瘤分期的鉴别中有较高的准确度与灵敏度,是诊断疾病的常用手段。为此,本研究采用MRI技术于肾透明细胞癌患者术前预测WHO/ISUP核分级情况,分析其应用价值,旨在为临床无创诊断及治疗方案选择、预后评估提供新方法。
1 资料与方法
1.1 一般资料
采用回顾性研究方法,选择2018年3月至2019年11月于我院病理证实的肾透明细胞癌293例患者(共298个肿瘤),其中男性212例、女性81例,平均年龄(58.65±11.54)岁,吸烟史94例,高血压118例。纳入标准:①经病理学确诊;②MRI图像清晰完整;③WHO/ISUP核分级;④病灶最大径超过1 cm。排除标准:①病灶直径低于1 cm;②有既往肾癌术后史者;③术前行穿刺活检、抗肿瘤、干预治疗者。
1.2 检查方法
嘱患者扫描前禁食禁饮8 h。使用沈阳东软 NeuMR 3.0T MRI仪和8通道相控阵列体部线圈。扫描范围:全肾脏。扫描序列与参数:冠状面自由呼吸HASTE序列,TE 91 ms,TR 1400 ms,FOV 340 mm×340 mm,矩阵 224×320,层间距1 mm,层厚5 mm;横断面T2WI用呼吸门控脂肪抑制快速自旋回波序列,TE 78 ms,TR 1900 ms,FOV 280 mm×370 mm,矩阵 224×320,层间距0.9 mm,层厚4 mm;横断面DWI,TE 72 ms,TR 6000 ms,FOV 280 mm×370 mm,矩阵 224×320,层间距0.9 mm,层厚4 mm,b值50、800 s/mm2;横断面T1WI,用脂肪抑制三维容积内插体序列,TE 1.38 ms,TR 3.90 ms,FOV 260 mm×380 mm,矩阵 224×320,层间距0.5 mm,层厚3 mm;增强扫描,采用Bayer Schering Pharma AG的马根维显造影剂(国药准字J20080065),0.2 ml/kg注射剂量,经肘静脉注射2 ml/s流率。静脉注射造影剂后(45.0±0.5)s后采集皮髓质期图像,(90.0±10.0)s采集实质期图像,180 s后采集延迟期图像。
1.3 图像分析
由2名腹部MRI仪操作经验丰富的影像学医师在不知患者临床资料、WHO/ISUP核分级等信息情况下评价患者MRI图像特征,包括肿瘤大小、形状、边缘、受累及远处转移等。WHO/ISUP核分级标准参考诊断病理学杂志(2018)《透明细胞肾细胞癌:WHO/ISUP分级验证》[3]。
1.4 统计学方法
采用SPSS 22.0软件包行统计学分析,符合正态分布的计量资料用独立样本t检验比较,计数资料用χ2检验。对2组差异有统计学意义(P<0.05)的指标进行二元Logistic回归分析,评估MRI技术无创预测肾透明细胞癌WHO/ISUP核分级的效能,并绘制ROC曲线图。检验结果以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料
WHO/ISUP分级结果:低级别组173例,其中Ⅰ级52例(T1期46例,T2期6例),Ⅱ级121例,(T1期114例,T2期7例);高级别组120例,其中Ⅲ级110例(T1期94例,T2期16例),Ⅳ级10例(T1期10例)。高级别组患者肿瘤最大径高于低级别组患者(P<0.05),其余无显著差异(P>0.05)。见表1。
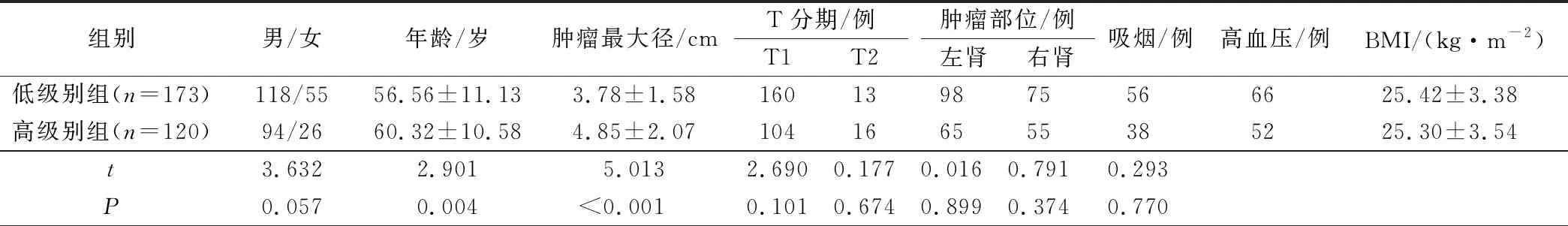
表1 低级别组与高级别组患者临床资料比较
2.2 MRI图像特征
低级别组与高级别组患者在形状、边界、假包膜、皮髓质期强化程度、静脉瘤栓、淋巴结肿大、坏死、肾周受累、伴远处转移、DWI信号强度方面的差异有统计学意义(P<0.05);其余MRI图像特征无显著差异(P>0.05)。见表2。
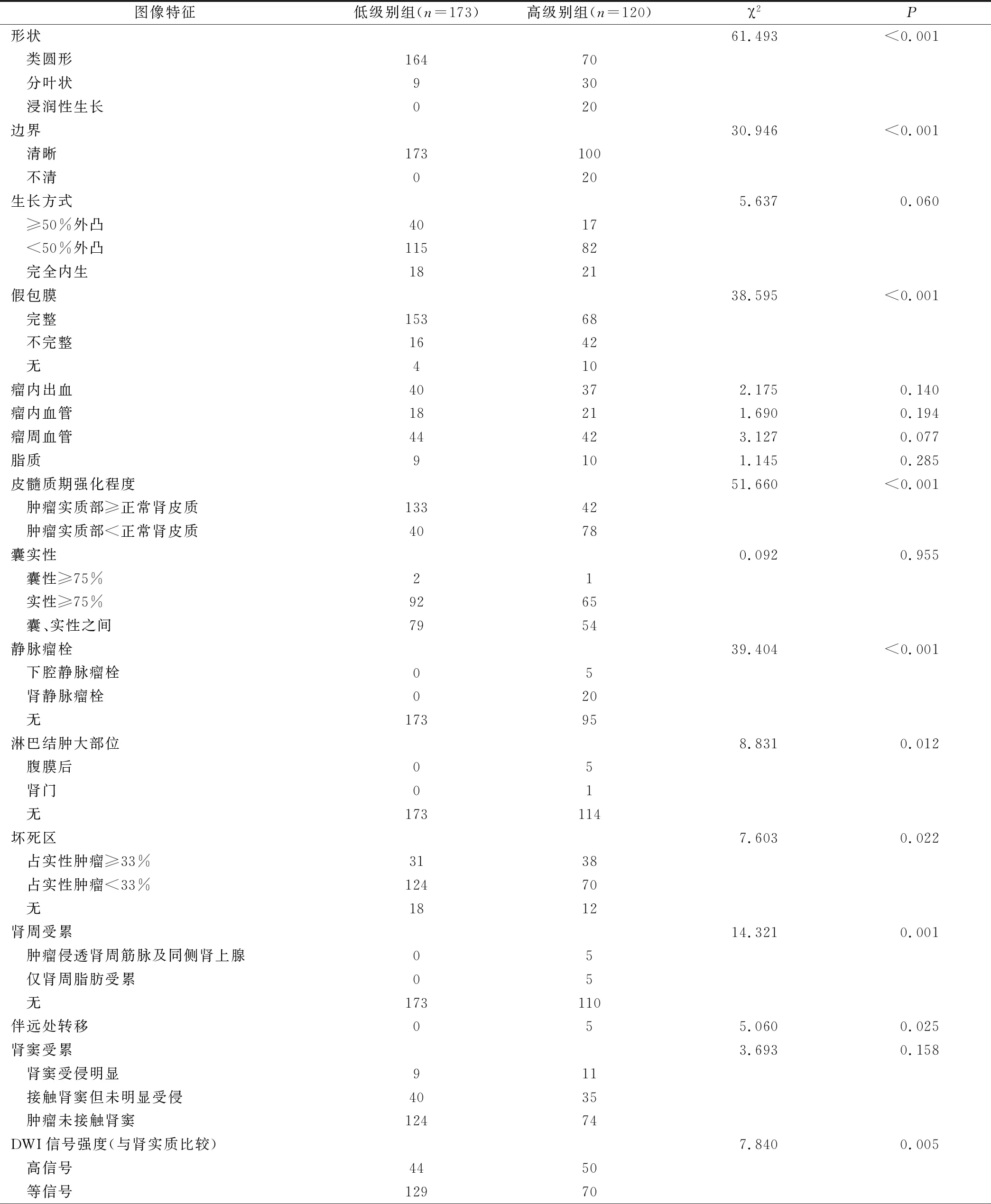
表2 MRI图像特征
2.3 预测肾透明细胞癌核分级的独立因素
二分类Logistic多元回归方程分析显示,形状、边缘、皮髓质期强化程度及DWI信号强度、远处转移是预测肾透明细胞癌核分级的独立因素(P<0.05)。见表3。
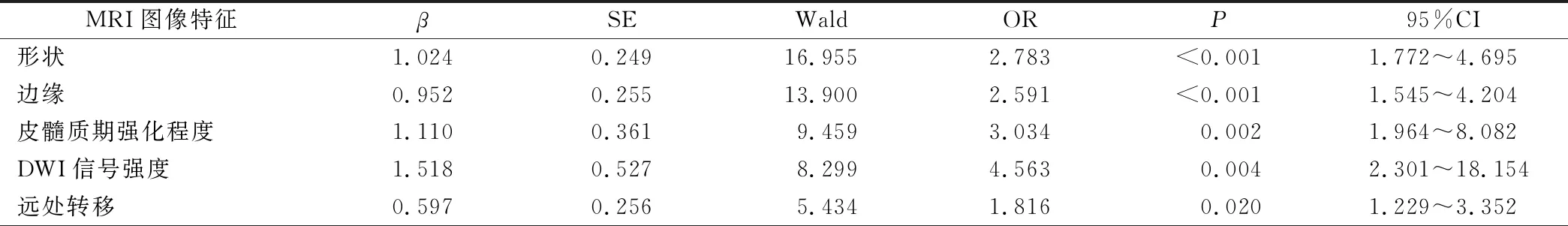
表3 预测肾透明细胞癌核分级的独立因素
2.4 MRI预测效能评价
模型的ROC曲线AUC值为0.806(95%CI 0.722~0.861),其判断WHO/ISUP分级高级别肾透明细胞癌灵敏度为88.3%,特异度为56.8%,准确度为72.3%。见图1。
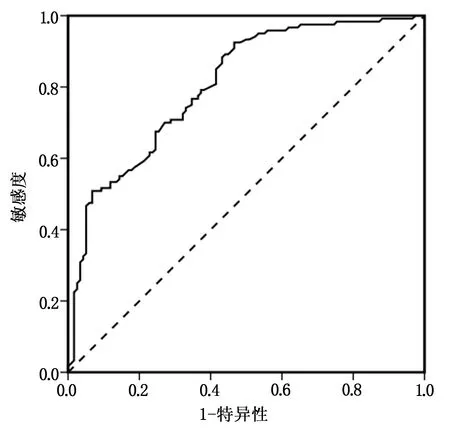
图1 基于MRI图像特征预测模型诊断WHO/ISUP核分级高级别肾透明细胞癌的ROC曲线图
3 讨论
大量研究表明,术前明确肾透明细胞癌分级有助于预后判断、治疗方案选择、靶向药物治疗指导[4]。WHO/ISUP核分级系统是根据核仁显著程度将肾细胞癌分级。Shu等[5]报道,MRI图像特征能预测肾透明细胞癌分级。本文二元Logistic回归分析结果示形状、边缘、皮髓质期强化程度及DWI信号强度、远处转移是预测肾透明细胞癌核分级的独立因素。有研究明确指出,较肾透明细胞癌WHO/ISUP核低级别者,高级别的皮髓质期强化程度明显更高[6]。有学者表明,肾透明细胞癌高级别者的肿瘤组织中的微小病灶多于低级别者,还指出较多的肉眼不能见的微小病灶可能是导致肿瘤强化程度增加重要因素[7]。Han等[8]也表明,肾透明细胞癌的皮髓质期强化程度是导致高级癌变的预测危险因素。大量研究指出,MRI图像的皮髓质期肿瘤实质部强化程度高于或与正常肾皮质相近可认为低级别肾透明细胞癌,相反则为高级别肾透明细胞癌[9],这点与本文研究发现一致。本文单因素研究中,高级别组皮髓质期肿瘤实质部强化程度低于正常肾皮质发生率明显高于低级别者。有学者报道,超过75%低级别肾透明肿瘤经MRI扫描肿瘤形态呈规则;有超过70%高级别肾透明癌肿瘤形态不规则[10]。有研究报道,低级别肾透明细胞癌肿瘤边界清晰超过93%,高级别肿瘤边界不清超过14%[11]。Dwivedi等[12]指出,低级别肾透明细胞癌肿瘤形状主要呈类圆形及小部分分叶状,而高级别肿瘤形状有超过13%呈浸润性生长。本研究中,低级别组病灶类圆形,边界清晰占94.80%,明显高于高级别组,高级别组病灶浸润性生长,边界不清超过16%;与上述研究相符。张钰等[13]研究报道,高级别组肿瘤在MRI DWI序列多呈高信号表现,低级别多呈等信号表现。本研究中,低级别组肿瘤等信号超过70%,高级别组高信号超过40%。
有研究认为,远处转移是肾透明细胞癌WHO/ISUP核分级的影响因素,但并非独立因素[14]。本研究发现,肿瘤伴远处转移提示为高级别肾透明细胞癌,肿瘤无远处转移提示为低级别肾透明细胞癌。金莹莹等[15]认为,MRI表现的间接征象中肾周伴远处转移与WHO/ISUP核分级有关,且高级别肾透明细胞癌MRI间接征象的出现率明显高于低级别组。与高级别肾透明细胞癌恶性程度相应高,其恶性生物学行为更明显,其征象表现为周围转移倾向强更符合。为此,远处转移也是预测肾透明细胞癌核分级的独立因素。本文MRI图像特征预测模型诊断WHO/ISUP核分级高级别肾透明细胞癌的AUC值、灵敏度、准确度均较高,提示MRI影像学模型有较好的预测性能。本文有一定局限性,本研究未行相关病理推测,需后期结合病理组织学证实;本研究未进行预后相关影像学征象分析,是为呈现仅基于MRI技术对术前无创预测肾透明细胞癌WHO/ISUP核分级中的应用价值,两者的关联性需深入探讨。
MRI技术对术前肾透明细胞癌WHO/ISUP核分级有较高的无创预测价值,可指导靶向药物治疗及治疗方案选择,值得临床广泛使用。
———占旭刚4

