以硬膜下血肿为首发表现的Rosai-Dorfman病一例
王娟
病例资料患者,男,32岁,头部外伤出血1月余。患者1月前晨起摔倒,后脑部着地,被发现后意识障碍约2 h,醒后持续头痛无缓解,当地医院急查头部CT提示右侧额颞顶部硬膜下出血。入院后查体示四肢腱反射减弱,余无特殊。实验室检查:血沉升高(38 mm/H),血白细胞计数升高(9.55×109/L),脑脊液总蛋白(1321 mg/L)及白蛋白(528 mg/L)均升高,余无特殊。头颅CT平扫:右侧额顶颞部硬膜下/外出血,邻近脑组织水肿,伴右侧颞顶部颅骨骨质硬化及内板局灶性骨质破坏(图1a、b)。入院后51天内多次头颅CT复查示病变范围及密度较首次头颅CT检查变化不明显。头颅MRI平扫及增强扫描:右侧额顶颞骨内板下新月形占位,考虑肿瘤性病变,慢性期血肿机化不完全除外,伴邻近骨质受累及脑组织水肿(图1c~1e)。头颈部CTA检查未见明显异常。BRAF V600E基因突变检测阴性,脑脊液流式免疫分型检测阴性。患者行经全麻开颅病灶切除术,术中可见右侧额顶颞颅板下白色鱼肉状组织,血供一般,与硬脑膜无明显分界;肿瘤沿脑表面广泛分布、蔓延性生长,侵入皮层约0.5 cm;并见局部颅骨内板被瘤体侵蚀。术后病理诊断:脑膜发生的结外Rosai-Dorfman病(图1f)。
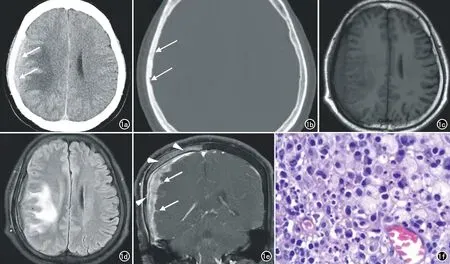
图1 Rosai-Dorfman病患者,男,32岁。a) 头颅轴面CT平扫脑窗示右侧额顶部颅板下弧形稍高密度病灶(箭),伴局部皮层下白质区片状低密度影; b) 头颅轴面CT平扫骨窗示右侧额顶骨骨质密度增高,并见颅骨内板局灶性溶骨性骨质缺损、边界清晰(箭);c) 轴面T1WI示右侧额顶部硬膜区弧形等低信号灶,伴右侧额顶骨板障高信号消失; d) 轴面脂肪抑制T2 FLAIR序列示右侧额顶部硬膜区弧形等低信号灶,伴邻近额顶叶皮层下白质片状高信号; e) 冠状面脂肪抑制T1WI增强扫描示右侧额顶颞部硬膜区病灶明显强化并呈指样/线样突起伸入邻近脑沟或脑实质(箭),局部硬脑膜完整并见增厚强化的“脑膜尾”,病变累及邻近软脑膜并与脑组织粘连,伴邻近颅骨板障及内板小灶性骨质破坏区强化(箭头),局部骨膜增厚强化; f) 镜下示增生的纤维结缔组织间杂淋巴细胞、浆细胞及少量中性粒细胞浸润,可见小片组织细胞浸润,偶见伸入现象(×400,HE)。
回顾性分析:该病例有后脑部着地受伤史,受伤部位与头颅CT检查提示的颅内病变位置不符,并未发现明显的颅骨骨折、头皮软组织及脑实质挫伤等外伤所致改变;且就血肿形成时间判断此例硬膜下血肿已处于慢性期,而CT检查病变密度偏高,后续多次CT复查病灶密度及范围较前变化不明显。头颈部CTA检查阴性不支持脑动脉性疾病。患者上述病史、影像表现及其演变特点提示并非外伤导致的单纯硬膜下血肿,而可能是颅内原发病变引发的外伤进而导致早期误诊。MRI检查所见颅内病变的信号特点及强化方式也进一步提示病变并非单纯的硬膜下血肿。脑脊液流式免疫分型检测结论不支持中枢神经系统淋巴瘤。BRAF V600E基因突变检测阴性不支持朗格汉斯组织细胞增多症(Langerhans cell histiocytosis,LCH)及Erdheim-Chester病(Erdheim-Chester disease,ECD)的诊断[1]。最终的术中所见排除硬膜下血肿的诊断。结合病理结果及影像学表现,笔者判断此例属于发生于硬脑膜的结外Rosai-Dorfman病并累及邻近颅骨,在文献报道的病例中较为少见[2]。
讨论Rosai-Dorfman病(Rosai-Dorfman-Destombes,RDD)也称窦组织细胞增生症伴广泛性淋巴结肿大(Sinus histiocytosis with massive lymphadenopathy,SHML),是一种罕见的以组织细胞和/或吞噬细胞异常增殖为特征的特发性良性疾病。该病可发生于各个年龄段,男性多发[3]。病因尚不明确,可能与病毒感染及机体免疫调节紊乱相关[4],据文献报道部分病例存在相关基因突变[5-7]。该病最常累及淋巴结窦以及结外淋巴组织,发生于颅内和脊柱的病例约占5%[3]。中枢神经系统RDD患者可仅表现为与病变位置相关的临床症状如发热、头痛、癫痫及局灶性神经功能缺损等[3,8]。实验室检查可见血沉增高、血白细胞升高、血球蛋白增多及贫血等非特异性改变[4]。RDD的病理学特征为组织细胞浸润,周围散在分布慢性炎症细胞。组织细胞具有典型的“吞噬现象”或“伸入运动”,镜下可见其胞质内含有数个至数十个小淋巴细胞,免疫组织化学染色表现为S-100强阳性、CD68阳性及CD1a因子阴性[6,8]。
影像学表现:中枢神经系统RDD为罕见疾病,其中颅内的RDD最常表现为硬脑膜型,影像学检查常被误诊为更为常见的脑膜瘤[9],但邻近颅骨受累少见[2]。其他类型如脑实质及脑室型极为罕见[1,3]。CT检查RDD表现为均匀稍高密度肿块,一般无钙化,可伴邻近颅骨硬化性骨质破坏或溶骨性骨质吸收[2,3,5,8]。MRI检查RDD表现为T1WI等信号与邻近脑实质相似;T2WI上呈不均匀低信号类似于邻近硬脑膜,具有特征性,可能与病灶内自由基的存在有关[3,6,10],周围脑组织可见中重度血管源性水肿,增强后多呈显著均匀强化,脑膜尾征可见[8]。本例硬脑膜型RDD符合上述影像学表现,但伴邻近颅骨受累较为少见,本例还可见强化的病变呈指样/线样突起向邻近脑沟或脑实质延伸,可能与灶周水肿甚至其预后相关[2,10]。DTI检查RDD表现为高FA值[11];DWI上显示无或轻度扩散受限[2,11]。磁敏感加权成像(susceptibility-weighted imaging,SWI)检查RDD表现为低信号,可能是由慢性炎症引发的自由基或矿物质沉积所致[11]。灌注加权成像(perfusion-weighted imaging,PWI)显示RDD病变灌注减低[2,11],该特征对于RDD的鉴别诊断非常重要,脑膜瘤通常表现为显著高灌注,但有研究发现RDD亦可表现为高灌注,可能与其CD31及CD34抗体的高表达有关[12]。
鉴别诊断:硬膜下血肿多有明确外伤史,其中慢性期硬膜下血肿CT表现为均匀或不均匀等低密度,当血肿机化时可见增厚并钙化的包膜,MRI平扫表现为典型的T1WI等低信号、T2WI低信号,增强扫描血肿包膜及分隔强化;脑膜瘤好发于中老年女性,典型影像表现为高密度硬脑膜的占位,可伴坏死、囊变、钙化及邻近骨质增生硬化改变[10],增强后呈明显均匀强化,脑膜尾征多见,PWI显示病变灌注增高;脑膜淋巴瘤CT表现为等低密度,累及颅骨时呈溶骨性改变,MRI表现为T1WI等低信号、T2WI等高信号,增强后常表现为较明显均匀强化,可见明显增厚、边缘欠光整的脑膜尾;肥厚性硬脑膜炎多发生于大脑镰、小脑幕及邻近硬脑膜,MRI平扫呈T2WI低信号,增强后不同程度强化[13]。其它组织细胞疾病如LCH及ECD等依赖活检病理及免疫组织学检查鉴别。
颅内孤立的RDD病变影像学检查常被误诊,确诊需依靠病理。大多数RDD属于良性自限性或长期稳定性疾病[2],治疗首选手术切除,部分次全切病例需术后辅助治疗如局部低剂量照射、化疗及激素治疗等,预后大多良好[5]。

