GnRH拮抗剂方案促排卵过程中平均LH水平对妊娠结局的影响
刘姗,马帅,李媛
(首都医科大学附属北京朝阳医院生殖医学中心,北京 100020)
近几十年来,体外受精-胚胎移植(IVF-ET)在全世界范围内得到了广泛应用,是治疗不孕症的重要手段。控制性促排卵(COH)是IVF治疗过程中的核心环节。GnRH拮抗剂方案(拮抗剂方案)因为其妊娠率稳定、卵巢过度刺激综合征(OHSS)风险低等优势,逐渐成为主流促排卵方案。拮抗剂使用的目的是抑制早发黄体生成素(LH)峰及提前排卵,但在部分患者中会带来LH过度抑制[1]。LH在性激素合成、卵泡发育、卵子成熟、排卵、黄体形成和维持方面均有重要作用[2-3]。越来越多的临床研究证实,卵泡发育存在“LH阈值窗”。一方面,过高的LH在自然周期及促排卵周期中均对妊娠结局不利;另一方面,过低的LH与妊娠丢失有关[2,4]。但既往文献中对促排卵过程中LH和妊娠结局相关性的报道大多为某固定时间节点监测LH水平,且结论不一。事实上,单一时间节点的LH难以体现整个卵泡发育阶段的LH水平。也有研究者做了其它尝试,如Chen等[4]在卵泡期平均间隔2~3 d测定LH水平,得出低LH的曲线下面积和界值,进而评估其对妊娠结局的影响,其结果显示低LH水平的患者早期妊娠丢失率明显增加。拮抗剂方案促排卵过程大致需要8~10 d,期间需要患者复诊3~5次,临床医生常规监测卵泡发育和激素变化情况,适时调整促排卵药物剂量及组合。本研究中,我们记录了促排卵过程中所有激素检测节点的LH值,由此计算得出促排卵过程中的平均LH值,认为其可以最大程度上体现卵泡发育过程中的LH水平。本研究的目的即为评估这一指标对新鲜周期移植妊娠结局和每取卵周期累积妊娠结局的影响。
资料与方法
一、研究对象
回顾性分析2018年6月至2020年6月于北京朝阳医院生殖医学中心行IVF-ET治疗的330例不孕症患者资料。
纳入标准:(1)不孕时间≥1年;(2)23岁≤年龄≤38岁;(3)18 kg/m2≤体质量指数(BMI)≤28 kg/m2;(4)基础FSH≤10 U/L;(5)基础窦卵泡计数(AFC)8~20枚;(6)拮抗剂方案促排卵;(7)月经周期21~35 d。
排除标准:(1)多囊卵巢综合征(PCOS);(2)子宫内膜病变(包括子宫内膜炎、子宫内膜息肉、宫腔粘连);(3)子宫内膜异位症(EMs)(中重度)及子宫腺肌症;(4)子宫畸形(单角子宫、双角子宫、双子宫、纵隔子宫);(5)自然流产3次及以上。
二、诊疗回顾
1.拮抗剂灵活方案促排卵:月经第2天开始,使用重组FSH(rFSH,果纳芬,默克雪兰诺,瑞士)150~225 U启动促排卵,启动剂量参考患者年龄、BMI、基础内分泌及AFC。促排卵过程中常规行B超监测卵泡发育情况,结合激素检查结果适时调整促性腺激素(Gn)用量。当卵泡直径达14 mm或雌激素达1 100 pmol/L时加用GnRH拮抗剂(思则凯,默克雪兰诺,瑞士)0.25 mg/d,持续至HCG日。当有3个以上的卵泡平均直径达到18 mm时给予GnRH激动剂(达必佳,辉凌,德国)0.2 mg加人绒毛膜促性腺激素(HCG,珠海丽珠)1 000~3 000 U促进卵泡最终成熟。36 h后行超声引导下经阴道后穹隆穿刺取卵术。
2.IVF、胚胎培养及胚胎移植策略:根据患者不孕病史及男方精液情况,选择常规IVF或卵胞浆内单精子注射(ICSI)授精。取卵后第3天(D3)挑选2个优质胚胎行胚胎移植,剩余胚胎继续培养囊胚。如存在不适合新鲜周期移植因素如促排卵过程中孕酮(P)提前升高、内膜厚度及形态较差、OHSS高风险等,D3冷冻2个优质胚胎,剩余胚胎行囊胚培养,优质囊胚冷冻保存,择期行冻融胚胎移植(FET)。
3.ET、黄体支持及妊娠结局随访:(1)新鲜周期移植2枚优质D3卵裂期胚胎,采用雪诺同阴道凝胶(默克雪兰诺,瑞士)90 mg qd及地屈孕酮(达芙通,雅培,美国)10 mg bid进行黄体支持。(2)FET周期采用自然周期或人工周期准备内膜。自然周期自排卵日开始,用地屈孕酮10 mg bid行黄体支持;人工周期自月经第3天开始,口服补佳乐(拜耳,德国)6 mg qd,10~14 d后当内膜厚度达7 mm以上时,开始用雪诺同阴道凝胶90 mg qd及地屈孕酮10 mg bid进行内膜转化。根据冷冻胚胎级别,分别于内膜转化第4天行D3卵裂期胚胎移植、第6天行囊胚移植。
胚胎移植后10~14 d,抽血测β-HCG水平,阳性者20 d后B超检查判断是否临床妊娠,之后常规随访至活产。如妊娠,新鲜周期移植者黄体支持持续至孕12周;自然周期FET者,黄体支持持续至孕7周;人工周期FET者,补佳乐自孕7周逐渐减量至孕9周左右停用,阴道凝胶及地屈孕酮用至孕10~12周。
三、分组
本研究为回顾性研究。患者促排卵过程中常规进行激素水平测定,至少包括以下4个时间点:启动日、Gn启动后第5~6天、Gn启动后第7~8天、扳机日。抽血时间固定在上午8点至9点间,抽血前未注射任何促排卵药物。
根据以上多个时间点测得的LH水平,求和后除以检测次数,计算得出该患者促排卵过程中平均LH水平;并据此将研究人群分为3组:低LH组(小于纳入人群促排卵过程中平均LH水平的第33位百分位数,n=110)、中LH组(处于纳入人群平均LH水平的第33~67位百分位数,n=109)和高LH组(大于纳入人群促排卵过程中平均LH水平的第67位百分位数,n=111)。
四、观察指标及定义
比较各组患者的基本临床特征(年龄、BMI、AFC、不孕年限/不孕原因、基础激素水平)、促排卵过程中的临床和实验室指标(Gn使用时间/剂量、扳机日内膜厚度、扳机日激素水平、卵巢反应指标、受精情况及胚胎培养情况等)、新鲜移植周期、全胚胎冷冻患者首个解冻移植周期的妊娠结局及每取卵周期的累积妊娠结局。
β-HCG阳性:胚胎移植后12~14 d血β-HCG>10 U/L;临床妊娠:胚胎移植后35 d行B超检查显示宫内孕囊;卵泡输出率(follicular output rate,FORT):HCG日卵泡数(PFC)/AFC×100%;卵泡/卵母细胞指数(Follicle-oocyte-index,FOI):获卵数/AFC;卵巢敏感指数(ovarian sensitivity index,OSI):(获卵数/Gn总量)×1 000。
五、统计分析
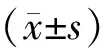
结 果
一、不同LH水平各组患者基线特征比较
根据促排卵过程中平均LH水平这一指标将研究对象进行分组,分为低LH、中LH和高LH组。3组间不孕年限和不孕原因构成有统计学差异(P<0.05),其他指标均无统计学差异(P>0.05)(表1)。
二、不同LH水平各组患者促排卵过程中临床和实验室指标比较
3组间平均LH水平、Gn启动剂量、Gn天数、Gn总量、扳机日LH水平均有统计学差异(P<0.05),其中高LH组Gn启动剂量最低、刺激天数最短、Gn总量最少,而扳机日LH水平最高。评估卵巢反应性的指标FORT、FOI及OSI在3组间均无统计学差异(P>0.05)。促排卵过程中rLH药物添加剂量在3组间有统计学差异(P<0.05),其中低LH组rLH添加量最多。3组间获卵数无统计学差异(P>0.05),受精数、2PN数及 D3优质胚胎数亦无统计学差异(P>0.05)(表2)。
表1 各组患者基本临床资料比较[(-±s),n(%)]
表2 各组患者临床及实验室指标比较(-±s)
三、不同LH水平各组患者妊娠结局比较
1.新鲜周期妊娠结局:3组患者中,分别有16、27和19个周期进行了新鲜周期胚胎移植。组间β-HCG阳性率有统计学差异(P<0.05),其中高LH组最低,而中LH组最高。中LH组临床妊娠率、继续妊娠率、活产率也相对较高,但3组间无统计学差异(P>0.05)(表3)。
2.全胚胎冷冻患者首个FET周期妊娠结局:3组患者中,分别有94、82和92个周期进行了全胚胎冷冻保存。本研究进而对首个FET周期的妊娠结局进行了比较。结果发现,3组间的β-HCG阳性率、临床妊娠率、继续妊娠率及活产率均无统计学差异(P>0.05)(表4)。
3.每取卵周期累积妊娠结局:3组患者间每取卵周期累积妊娠结局的各个指标均无统计学差异(P>0.05)(表5)。高LH组有4个周期晚期流产。
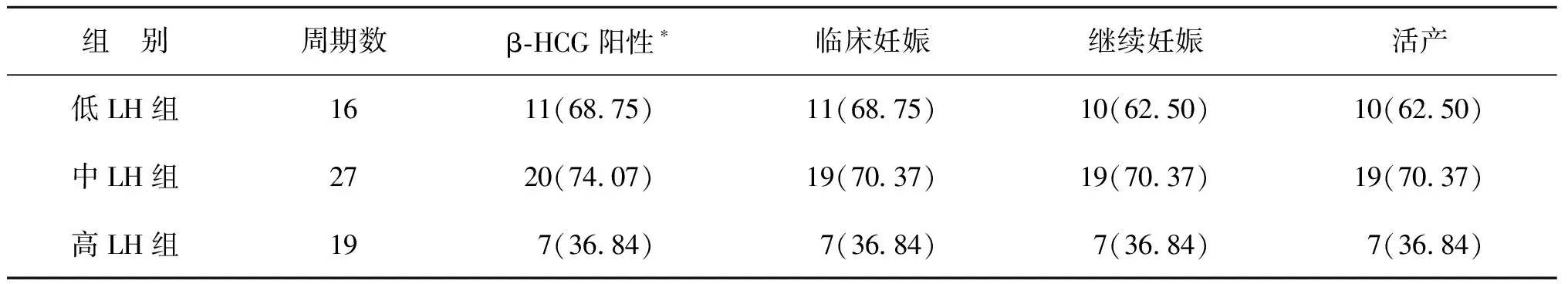
表3 各组患者新鲜移植周期妊娠结局比较[n(%)]
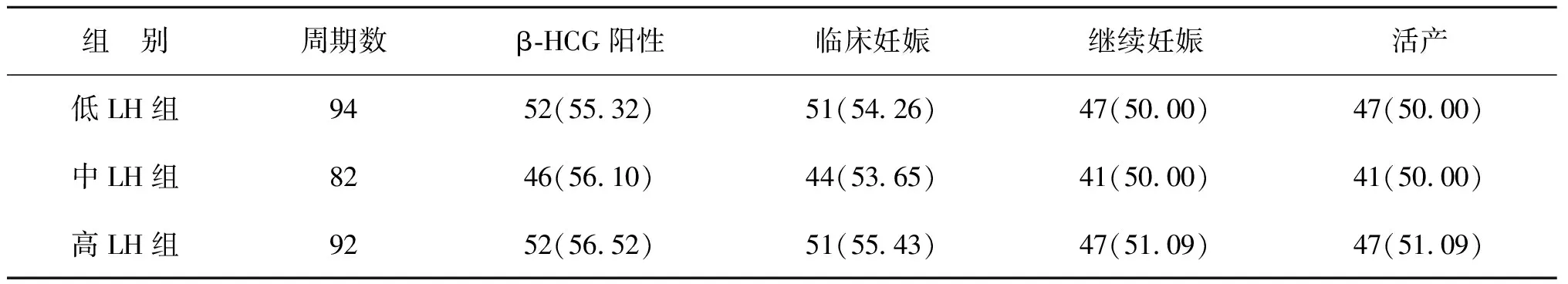
表4 各组患者首个FET周期妊娠结局比较[n(%)]

表5 各组患者每取卵周期累积妊娠结局比较[n(%)]
四、每取卵周期累积活产的影响因素
本研究对影响每取卵周期累积活产率的因素进行Logistic回归分析。结果显示,年龄和获卵数与每取卵周期累积活产率正相关(P<0.05),BMI和不孕年限与累积活产率无明显相关(P>0.05)。将促排卵过程中平均LH水平进行分层,以中LH组作为参照,低LH组和高LH组每取卵周期累积活产率分别是其0.91和0.93倍(P>0.05)(表6);虽然没有统计学差异,但可以看出保持促排卵过程中平均LH水平在合理范围,对提高每取卵周期累积活产率有利。

表6 每取卵周期累积活产的影响因素
讨 论
GnRH拮抗剂可以竞争性地与垂体促性腺激素受体结合,并快速抑制促性腺激素尤其是LH的分泌。现有的临床证据表明,卵泡发育和卵母细胞成熟需要LH维持在合适的水平,即LH阈值窗。早发LH峰可以导致早排卵、周期取消;过低的LH水平则与妊娠结局较差和早期妊娠丢失相关。既往有大量研究探讨了促排卵不同时间节点的LH水平与卵巢反应性及妊娠结局的相关性,相关结论并不完全一致。例如Benmachiche等[5]的研究提示扳机日低LH水平与继续妊娠率和活产率下降、早期流产率升高相关;扳机日LH水平低于1.6 U/L为妊娠结局较差的界值。其它研究则没有观察到LH水平和妊娠结局之间的相关性[6-7]。季慧等[8]的研究认为,在拮抗剂方案促排卵过程中,晚卵泡期及扳机日低水平的LH可预测较高的获卵数,但LH水平高低并不影响最终的妊娠结局。另有研究者关注了卵泡发育过程中其它时期LH水平与妊娠结局的相关性。如Lahoud等[2]的研究提示卵泡中期LH水平与卵巢反应性密切相关,但与活产率无关;与基础LH水平相比,如卵泡中期LH水平显著下降,则会导致妊娠结局较差。除此之外,有研究提示基础LH水平较低(≤3 U/L)者,促排卵过程中卵巢反应性无特殊,但与LH >3 U/L者相比妊娠结局较差[9]。
由此可见,众多关于促排卵过程中LH水平和卵巢反应性及妊娠结局相关性的研究,得出的结论并不一致。原因可能有以下方面:其一,LH分泌具有脉冲性,且促排卵过程中无法做到每天抽血进行激素检测,单一时间点的LH水平难以体现整个卵泡发育阶段的LH水平;其二,LH水平与LH活性并不完全等同。众所周知,LH需要与其受体(LHCGR)结合后才能发挥相应的生物学作用,而LHCGR多态性可以影响促排卵过程中的卵巢反应性和IVF妊娠结局[10-11]。除此之外,LHβ亚单位的点突变可以产生异构体vβ-LH,其半衰期缩短,对外源性FSH刺激的敏感性下降,与不孕症关系密切[12]。现有条件下,临床医生无法在促排卵前常规对患者的FSH受体(FSHR)、LHCGR及性激素合成关键酶进行基因多态性检测,进而进行个体化调整。
除检测LH的时间点(如卵泡发育早期、中期、扳机日)、所用促排卵方案(激动剂方案、拮抗剂方案)不同外,目前界定促排卵过程中LH水平的标准也不统一。我们既往的回顾性研究中,以促排卵过程中LH水平最高值是否低于4 U/L将患者分为两组,比较了新鲜周期移植和每取卵周期的累积妊娠结局,结果发现LH过低者新鲜周期移植活产率较低,而全胚胎冷冻周期的累积妊娠率不受影响[13]。但相关机制尚需进一步研究。既往有研究认为LH在胚胎植入过程中起重要作用,过低的LH水平对子宫内膜容受性不利[14]。促排卵过程中LH超过10 U/L称为早发LH峰。Geng等[15]的研究提示早发LH峰患者的2PN率下降、优质胚胎数减少、临床妊娠率下降、周期取消率升高。上述研究均提示促排卵过程中保持LH水平在合理的范围对妊娠结局至关重要。本研究中对LH水平偏低或卵泡发育较慢的患者常规进行了LH活性药物的添加,可以部分弥补LH低水平的影响。我们的研究结果也显示,低LH组中rLH的添加剂量远高于其它两组。Fábregues等[16]研究认为,高龄人群中添加LH并不能增加卵巢反应性和胚胎种植率。但另有研究认为LH添加对治疗结局有益[17-18]。故对LH活性药物添加的受益人群尚需进一步研究证实。
本研究选取了促排卵过程中所有激素检测时间的LH值得到其平均值,并利用平均LH水平这一指标评估其对新鲜周期移植、全胚胎冷冻周期第1次解冻移植、每取卵周期累积妊娠结局的影响。多个时间点检测LH水平,可以更准确地反映整个促排卵过程中的LH水平。另外,抽血时间相对固定,并在当日的促排卵药物及拮抗剂应用之前进行,可最大程度降低LH脉冲分泌及药物对LH水平的影响。统计分析结果显示,该指标不影响每取卵周期累积妊娠结局及全胚胎冷冻患者首个解冻移植周期的妊娠结局;但在新鲜移植周期中,LH水平居中者HCG阳性率最高(P<0.05),尽管临床妊娠、继续妊娠及活产率在3组间无显著性差异(P>0.05),但也可以看到LH水平居中者上述指标均相对较高。提示促排卵过程中保持LH在合理的水平对新鲜周期移植的妊娠结局非常重要,有助于选择适合进行新鲜胚胎移植的周期,并为全胚胎冷冻提供参考。
但本研究尚存在以下局限性:其一,本研究是回顾性研究,新鲜周期移植例数较少,未能得出最有利于新鲜周期妊娠结局的平均LH范围,尚需大样本研究以得出有更有说服力的结论;其二,促排卵过程中平均LH水平这一指标影响新鲜周期妊娠结局的具体机制尚需进一步探讨。

