DEHP对青春期雄性小鼠生殖毒性及铁死亡影响的相关机制
孙镠佳,陈田,丁慧敏,项雨,葛红山
(1.南京中医药大学,南京 210000;2.泰州市人民医院,泰州 225300)
邻苯二甲酸(2-乙基己基)二酯[di(2-ethylhexyl)phthalate,DEHP]作为一种常见的增塑剂,能有效提高塑料制品的延展性和柔韧度,因而被广泛应用于工业、农业、医疗、食品、玩具、建筑等各个领域[1-2]。由于它通常以不牢固的氢键与范德华力与塑料基底相连接,在高温或与疏水材料接触时极易扩散至大气、土壤和水体等环境介质,因此极易导致人群广泛暴露,最终经多种途径蓄积在生物体内[3-4]。随着环境检出率和人群暴露水平的不断增高,DEHP带来的生态环境污染和人类健康问题日益受到世界各国的广泛重视。现有研究显示,DEHP及其相关代谢物可引起生殖和发育毒性[5-6]、神经毒性[7]、肝毒性[8]、肾毒性[9]、肺毒性[10]、致癌性[11]等多种机体损伤。其中,DEHP对生殖系统的影响,尤其是对雄性生殖的损伤备受关注。目前,已有大量体内外研究对DEHP暴露所致雄性生殖损伤的机制进行探索,主要观点包括通过干扰下丘脑-垂体-性腺(HPT)轴影响性激素的分泌和调控[12],破坏机体氧化和抗氧化系统诱导氧化应激[13]等,但结论尚未明确。有研究表明,铁过载[14]、氧化应激[15]均为诱导雄性生殖损伤的重要机制,而铁代谢紊乱、脂质过氧化、谷胱甘肽代谢异常又是铁死亡的主要分子调控机制[16]。基于此,本研究通过不同剂量 DEHP对青春期雄性小鼠进行染毒,观察其对雄性生殖系统的影响,并进一步探究铁死亡与DEHP诱导的雄性生殖损伤之间是否存在相关性。
材料与方法
一、实验动物和材料
1.实验动物:健康普通级4周龄ICR雄性小鼠24只,购自扬州大学动物实验中心,动物许可证号为SCXK(苏)2017-0007。动物实验室保持温度(25±1)℃,湿度(60±10)%,光照与黑暗时长比为12 h∶12 h,自由饮水和摄食。
2.主要试剂与仪器:DEHP(上海麦克林生化),组织铁测定试剂盒(南京建成生物),BCA蛋白浓度测定试剂盒(上海碧云天生物)。β-actin兔单克隆抗体(4970,Cell Signaling Technology,美国),转铁蛋白(Tf)兔单克隆抗体(T55396,上海艾比玛特),转铁蛋白受体1(TfR1)兔单克隆抗体(T56618,上海艾比玛特),铁蛋白重链1(FTH1)兔单克隆抗体(T55648,上海艾比玛特),核因子E2相关因子(Nrf2)兔单克隆抗体(ab62352,Abcam,美国),谷胱甘肽过氧化物酶4(GPX4)兔单克隆抗体(ab125066,Abcam,美国),溶质载体家族7成员11(SLC7A11)兔多克隆抗体(ab37185,Abcam,美国),辣根过氧化物酶(HRP)标记山羊抗兔二抗(武汉爱博泰克)。全波段多功能酶标仪(BioTek,美国),低温超速离心机(Thermo,美国),XD-202倒置生物显微镜(南京江南永新光学),超声破碎仪(Newtown CT,美国)。
二、实验方法
1.动物分组及染毒:24只雄性ICR小鼠经适应性喂养1周后,按体重随机分为4组,每组6只。参照之前文献方法[17],以玉米油为溶剂,分别对各实验组小鼠给予0.5、50、500 mg/kg的DEHP灌胃染毒(分别为0.5 mg/kg组、50 mg/kg组和500 mg/kg组),对照组以同剂量玉米油灌胃,1次/d,连续35 d。每天观察小鼠一般状态,每周记录体重1次。于最后一次灌胃24 h后处死小鼠,记录终体重。

3.精子数量及活力测定:处死小鼠后解剖得到双侧附睾,快速称重后置于37℃预热的1 ml生理盐水中剪碎,继续37℃水浴5 min,吸管吹打30次制成精子悬液,将滤液滴入精子计数板进行计数。每个样本观察3个视野,评估每只小鼠的附睾精子活力。参照文献方法[18]将精子活动力分为4级:Ⅰ级呈快速直线向前运动,表示精子活动极好;Ⅱ级直线向前运动,表示精子活动较好;Ⅲ级只向前曲线运动,表示精子活动力一般;Ⅳ级只在原地蠕动,表示精子活动能力差。
4.石蜡组织切片及HE染色:新鲜睾丸组织用4%多聚甲醛固定24 h,经常规脱水、透明、浸蜡、包埋后制成组织切片。HE染色后于光镜下观察各组睾丸组织形态学改变。
5.睾丸组织铁含量测定:准确称取睾丸组织重量,按重量(g)∶体积(ml)=1∶9的比例加入生理盐水,冰水浴条件下进行机械匀浆,4℃温度下2 500 r/min离心10 min后取上清液。按组织铁测定试剂盒说明书操作后用酶标仪于波长520 nm下测定样品OD值,计算各组睾丸组织的铁含量。
6. 蛋白免疫印迹法(WB)测定铁代谢相关蛋白及铁死亡相关蛋白的表达水平:取各组睾丸组织,用蛋白裂解液(RIPA∶PMSF=100∶1)裂解后进行超声匀浆及低温离心,提取总蛋白。用BCA蛋白浓度测定试剂盒测定各组蛋白浓度,以40 μg蛋白上样量进行SDS-PAGE电泳(浓缩胶浓度为5%,分离胶浓度为12%),将目的蛋白分离并转至PVDF膜(Millipore,美国)。室温下用快速封闭液(苏州新赛美生物)封闭10 min,分别加入一抗(Tf、TfR1、FTH1、Nrf2、GPX4、SLC7A11、β-actin),4℃摇床孵育过夜。次日回收一抗,洗膜3次后加入HRP标记的山羊抗兔IgG二抗,室温摇床孵育2 h,洗膜3次后通过特超敏ECL化学发光试剂盒(上海碧云天生物)曝光显影。以目的蛋白和内参β-actin条带灰度值的比值与对照组比较表示目的蛋白的相对表达水平。
三、统计学分析
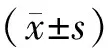
结 果
一、DEHP对小鼠体重、睾丸重量及脏器系数的影响
DEHP 染毒后,各组小鼠一般情况尚可,均未见明显异常症状。随着染毒剂量增加,小鼠的染毒后体重及增重量均呈下降趋势,其中50 mg/kg组的增重量、500 mg/kg 组的染毒后体重及增重量均显著低于对照组(P均<0.01);睾丸湿重随着DEHP染毒剂量增加亦呈下降趋势,其中500 mg/kg组显著低于对照组(P<0.01);各组睾丸脏器系数与对照组比较均无显著性差异(P>0.05)(表1)。
表1 DEHP暴露对小鼠体重、睾丸湿重及脏器系数的影响[(-±s),% ]
二、DEHP对小鼠精子数量及质量的影响
与对照组比较,0.5 mg/kg组、50 mg/kg组小鼠附睾精子数量及活力均呈下降趋势,但尚无统计学意义(P均>0.05);500 mg/kg组小鼠附睾精子数量及精子活力等级均显著下降(P<0.05)(表2)。
三、DEHP对小鼠睾丸组织形态学的影响
光镜下可见对照组睾丸精曲小管排列整齐,层次清楚,结构正常,生精上皮基膜外侧可见梭形肌样细胞精原细胞分布,近腔侧可见各级生精细胞依次排列,腔内可见成熟精子(图1 A);0.5 mg/kg组睾丸精曲小管排列规则,多层生精细胞正常分布,与对照组未见明显差别(图1 B);50 mg/kg组睾丸精曲小管外形尚规则,但见生精上皮层次减少,排列紊乱,部分生精细胞有脱落现象(图1 C);500 mg/kg组睾丸曲精小管形状不规则,生精上皮严重损伤,层次明显减少,生精细胞排列疏松紊乱,部分细胞脱落游离于管腔(图1 D)。提示DEHP导致了小鼠睾丸组织的损伤。
表2 DEHP暴露对小鼠精子数量及质量的影响[(-±s),n(%)]
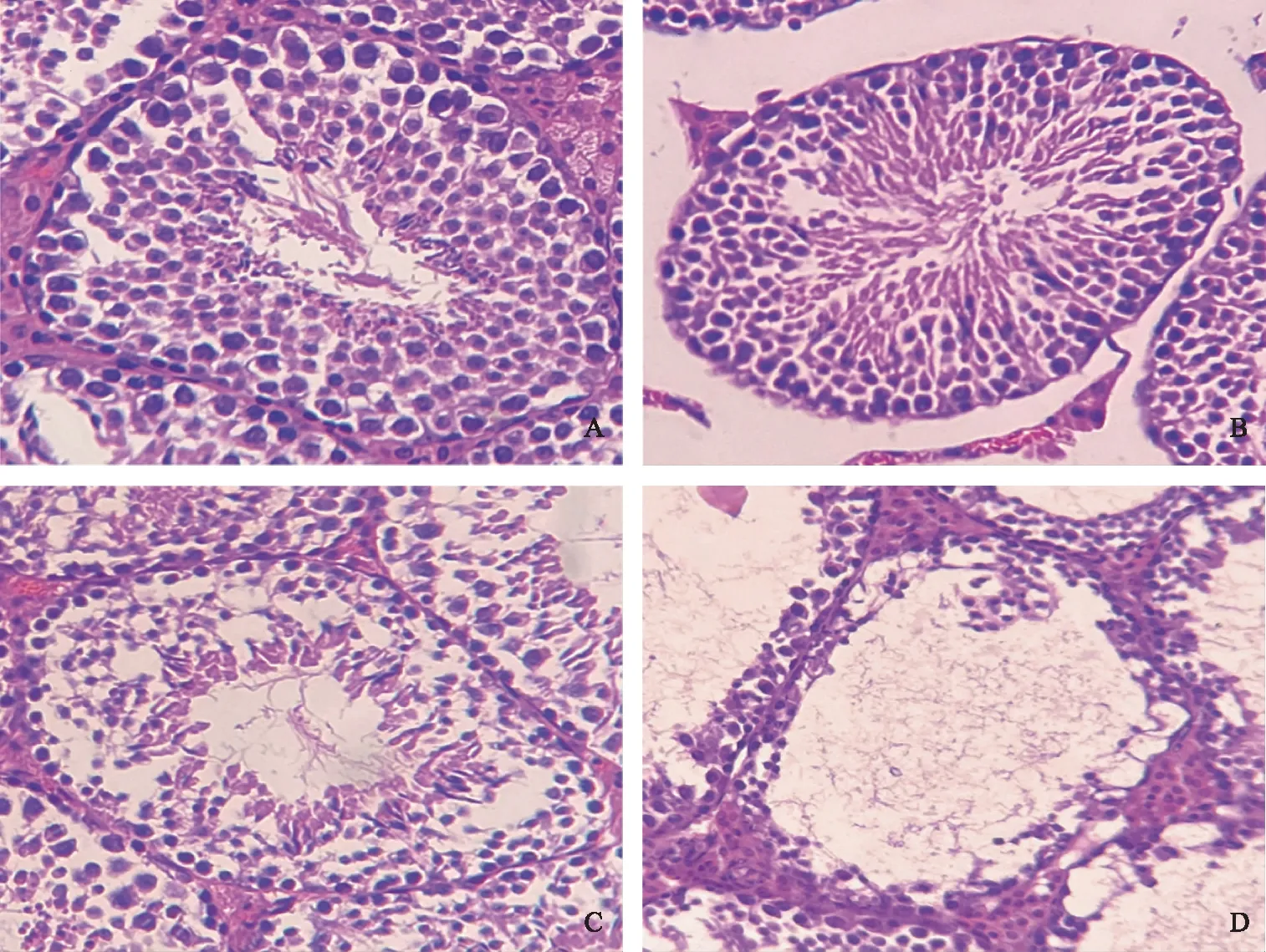
A:对照组;B:0.5 mg/kg组;C:50 mg/kg组;D:500 mg/kg组。图1 各组小鼠睾丸的形态学观察(HE染色,×400)
四、DEHP对小鼠睾丸组织铁含量的影响
与对照组比较,0.5 mg/kg组、50 mg/kg组小鼠睾丸匀浆中铁含量均未见明显差异(P均>0.05),而500 mg/kg组小鼠睾丸组织铁含量显著增加(P<0.05)(图2)。
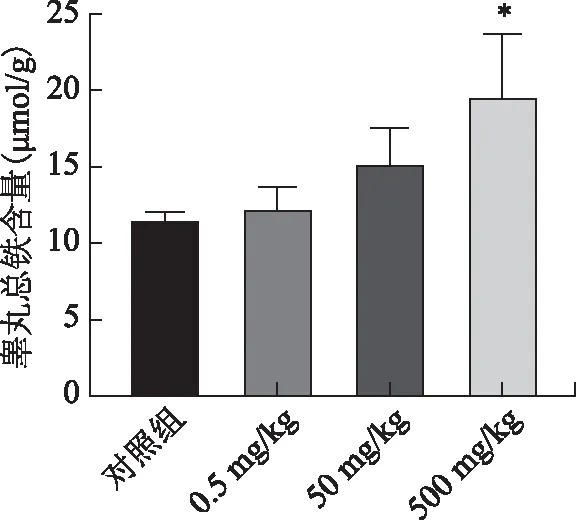
注:与对照组比较,*P<0.05。图2 各组小鼠睾丸组织总铁含量比较
五、DEHP对小鼠睾丸铁代谢相关蛋白表达水平的影响
与对照组比较,0.5 mg/kg组、50 mg/kg组小鼠睾丸中的Tf、TfR1及FTH1蛋白表达差异均无统计学意义(P均>0.05),500 mg/kg组小鼠睾丸中Tf、TfR1的蛋白表达水平均显著上调,FTH1的表达水平显著下降(P<0.05)(图3)。
六、DEHP对小鼠睾丸铁死亡相关蛋白表达水平的影响
与对照组比较,0.5 mg/kg组、50 mg/kg组小鼠睾丸中的Nrf2、GPX4及SLC7A11蛋白表达水平均无显著性差异(P均>0.05);而500 mg/kg组小鼠睾丸中Nrf2、GPX4及SLC7A11蛋白表达水平显著下降(P<0.05)(图4)。

A:WB法检测小鼠睾丸铁代谢相关蛋白表达;B:Tf蛋白相对表达量;C:TfR1蛋白相对表达量;D:FTH1蛋白相对表达量。与对照组比较,*P<0.05。图3 小鼠睾丸铁代谢相关蛋白表达水平
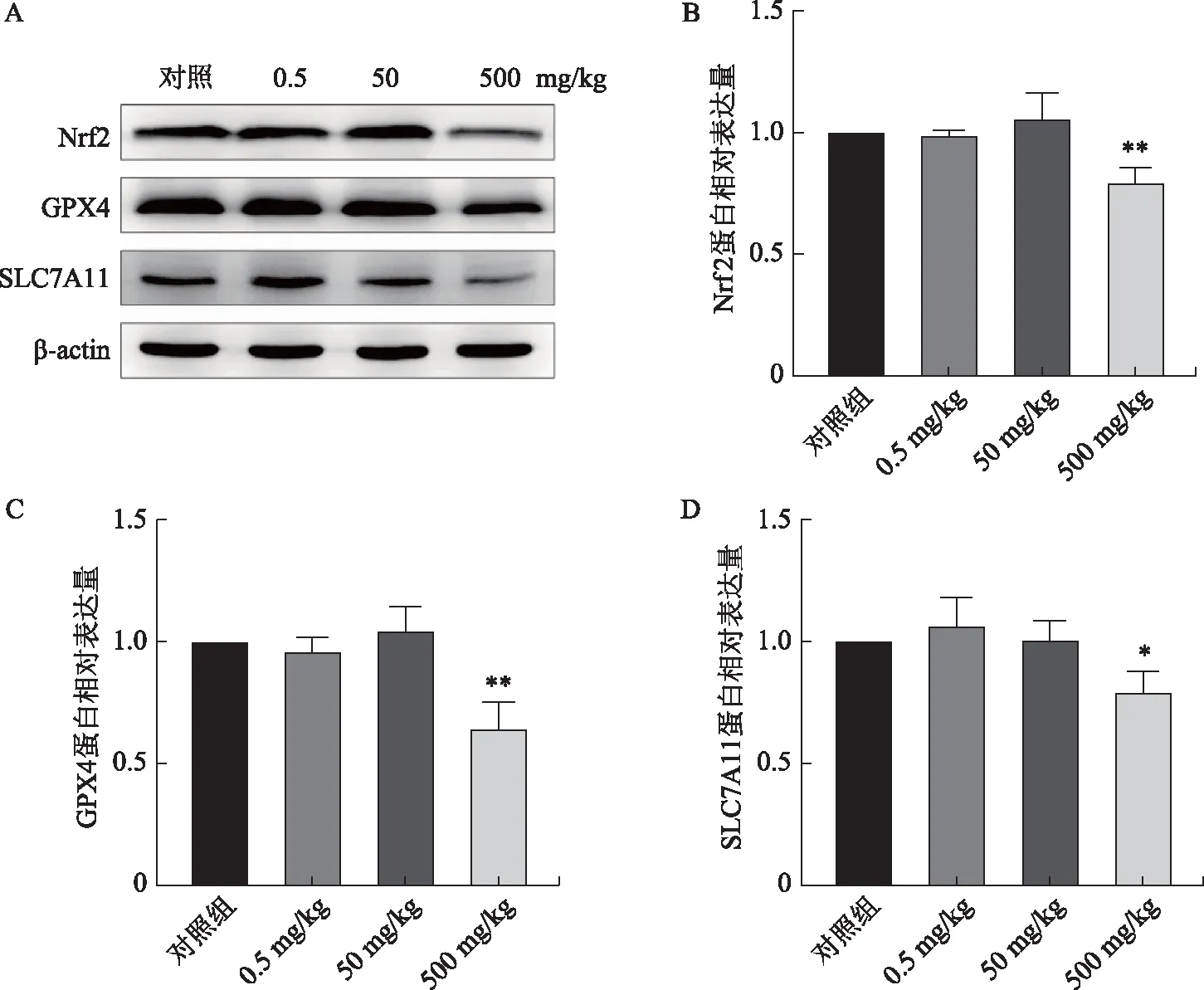
A:WB法检测铁死亡相关蛋白的表达;B:Nrf2蛋白相对表达量;C:GPX4蛋白相对表达量;D:SLC7A11蛋白相对表达量。与对照组比较,*P<0.05,**P<0.01。图4 小鼠睾丸铁死亡相关蛋白表达水平
讨 论
DEHP是目前使用最广泛的邻苯二甲酸酯类增塑剂之一,作为一种环境内分泌干扰物,其对雄性生殖系统的毒性作用日益受到人们关注。研究表明,DEHP诱导的睾丸损伤是其雄性生殖毒性的主要病理学基础[19]。睾丸是雄性生殖系统最重要的器官之一,具有合成雄性激素、产生分泌精子等功能,对维持雄性生殖能力至关重要。有研究显示,母体妊娠期及哺乳期的DEHP暴露可能造成雄性子代附属生殖结构的发育不良、性激素的异常和睾丸质量的下降[20-22],而青春期接触DEHP则可能直接或间接导致雄性大鼠睾丸形态学改变,精子浓度和质量下降以及血清睾丸激素水平的降低[23]。本研究通过给予实验组0.5、50或500 mg/kg剂量的DEHP建立染毒模型,对青春期短期暴露于不同剂量DEHP所导致的雄性生殖损伤进行讨论。本研究结果显示,雄性小鼠经DEHP染毒后体重和睾丸质量出现下降趋势,尤其是高剂量(500 mg/kg)DEHP暴露造成雄性小鼠体重及睾丸重量的明显下降。此外,中、高剂量的DEHP可以诱导小鼠睾丸出现精曲小管结构紊乱、生精上皮变薄等组织病理学改变,精子数量和质量的下降也符合上述结果。然而,对于低剂量(0.5 mg/kg)DEHP组,上述改变均不明显。以上结果表明,DEHP染毒可以造成睾丸结构及功能的损伤,但可能只有当DEHP剂量足够大时,这一毒性作用才比较明显。
铁死亡(Ferroptosis)是一种铁依赖的非凋亡形式的程序性细胞死亡,以脂质过氧化物的铁依赖性积累为特征,最早由Dixon 等[24]于2012年提出。铁是体内一种具有氧化还原活性的必需微量元素,对维持细胞稳态具有重要作用。循环中的铁主要以三价铁离子形式存在,并通过与Tf结合经TfR1进入细胞。进入细胞内的铁离子还原为二价铁离子后释放到细胞质的铁池发挥作用,过量的铁则储存在铁蛋白(FTL、FTH1)中[25]。据研究表明,铁积累是铁死亡发生的必要条件[26],铁死亡过程可能伴随Tf、TfR的升高和铁蛋白的异常改变。本研究中,高剂量(500 mg/kg)DEHP染毒诱导睾丸组织铁含量上升,表明DEHP对睾丸铁稳态产生了影响。进一步对铁代谢相关蛋白进行检测,发现500 mg/kg剂量DEHP染毒上调了睾丸组织中Tf、TfR1的蛋白表达水平,而下调了FTH1的表达,通过增加铁摄入、减少铁储存使游离Fe2+在细胞内蓄积。以上结果说明,DEHP染毒可能通过调节睾丸铁代谢蛋白引起铁代谢异常。
GPX4途径是铁死亡调控的另一重要途径。GPX4是细胞内最重要的抗脂质过氧化酶,已被证实是铁死亡的一种负调控因子[27]。GPX4在还原型谷胱甘肽(GSH)的协同作用下将脂质过氧化物转化为无毒醇类[28],因此,GSH的耗竭会导致GPX4失活,从而增加细胞内脂质过氧化作用,导致铁死亡的发生。此外,合成GSH的原料胱氨酸和谷氨酸通过以SLC7A11为主要组成的System Xc-从胞外摄取[29-30],而Nrf2对SLC7A11水平具有调节作用[31]。因此,System Xc-系统抑制、GPX4活性抑制,均为细胞铁死亡的重要条件。本研究结果显示,500 mg/kg组Nrf2及SLC7A11蛋白表达水平均显著下降,说明System Xc-系统可能被抑制,GSH合成受阻;同时,GPX4蛋白表达水平亦显著下降,脂质过氧化物清除过程被抑制,可能协同诱导铁死亡的发生。
综上所述,本研究就DEHP对雄性生殖毒性及其可能机制进行了初步研究及阐述,结果表明,青春期DEHP暴露能够导致小鼠出现睾丸组织损伤、生精功能障碍。高剂量染毒小鼠的睾丸组织细胞出现铁死亡的相关变化:铁代谢异常及铁死亡调控基因的异常表达等,提示铁死亡可能参与了DEHP暴露诱导雄性生殖损伤的病理过程,为DEHP的生殖毒性机制研究开拓了新思路。但本研究各项指标仅限于睾丸水平,缺乏线粒体水平数据;且实验仅涉及铁死亡部分相关指标,具有一定局限性,对其研究有待进一步深入和完善。

