115例胎儿NT厚度在其分布的95百分位数至2.9 mm之间病例产前遗传学检测结果分析
李萌萌,郝娜,周京,周希亚,蒋宇林,戚庆炜
(中国医学科学院 北京协和医学院 北京协和医院产科中心,国家妇产疾病临床医学研究中心,北京 100730)
胎儿颈后透明层(nuchal translucency,NT)增厚与胎儿染色体异常以及致病性拷贝数变异(pathogenic copy number variants,pCNV)风险增加密切相关[1-3],当NT增厚时应建议孕妇进行包含染色体微阵列分析(chromosomal microarray analysis,CMA)检测在内的产前遗传学检测。目前临床上对于NT增厚切割值的选取尚未取得普遍的共识。国外的大多数研究以3.5 mm作为NT增厚的固定切割值[4-6],但也有少量研究显示当NT在3.0~3.4 mm之间时,胎儿pCNV风险增加,建议应对其进行包含CMA检测在内的遗传学检测[7-8]。国内的研究基本以3.0 mm作为NT增厚的切割值。但国内外对于NT厚度位于其分布的第95百分位数(P95)至2.9 mm之间时胎儿染色体异常和pCNV的风险评估则基本缺乏。本研究通过对115例胎儿NT厚度在其分布的P95至2.9 mm之间患者的产前遗传学检测结果进行回顾性分析,探讨是否可将NT厚度在其分布的P95作为产前遗传学检测的切割值。
资料和方法
一、研究对象
选取2017年1月1日至2021年8月31日在北京协和医院就诊、妊娠11~13+6周行超声检查提示胎儿NT厚度介于其分布的P95至2.9 mm之间的孕妇共115例,包括在本院产检的孕妇以及外院高危转诊的孕妇。根据当时或中孕期的超声检查是否同时合并其他异常,将病例分为孤立性NT增厚和非孤立性NT增厚两组。孤立性NT增厚指在妊娠11~13+6周的超声以及之后的超声检查中均未发现其他异常;反之则为非孤立性NT增厚。所有患者均接受产前遗传学咨询,以及产前染色体核型分析和CMA检测,并根据检测后咨询决定是否继续妊娠。
二、研究方法
1.G显带染色体核型分析:胎儿的绒毛、羊水标本均于本院产前诊断中心实验室分拣处理,进行原位法细胞培养。绒毛标本经酶解后于37℃水浴,离心后加入培养液,在37℃、 5%CO2培养箱中培养,至细胞贴壁并形成多个集落后收获。羊水经离心后加入培养液,取 0.5 ml细胞悬液接种,在37℃、5%CO2培养箱中培养后收获。制片后行G显带染色和染色体核型分析,染色体显带水平为400条带。每例计数20个核型,分析5个核型。
2.CMA检测:绒毛、羊水基因组DNA通过Qiagen DNA Mini试剂盒(Valencia,美国)提取,DNA样本浓度经NanoDrop 2000仪(Thermo Fisher Scientific Inc,美国)进行测定,取吸光度A 260/280 nm在1.8~2.1之间的样本,转移至-20℃冰箱保存以进行后续实验。CMA检测使用CytoScan 750K芯片(Affymetrix Inc,美国),数据分析使用ChAS 4.2(chromosome analysis suit)版本。
拷贝数变异(CNV)的分类解析参考国际公共数据库及发表文献,包括OMIM数据库(Online Mendelian Inheritance in Man,http://www.omim.org/)、DECIPHER数据库(Database of Chromosomal Imbalance and Phenotype in Humans using Ensembl Resources,https://decipher.sanger.ac.uk/)、ClinVar数据库(https://www.ncbi.nlm.nih.gov/clinvar/)、ClinGen剂量敏感数据库(ClinGen Dosage Sensitivity Map,https://www.clinicalgenome.org)、UCSC(http://genome.ucsc.edu/)及Pubmed。按照美国医学遗传学与基因组学(American College of Medical Genetics,ACMG)的相关指南对CNV进行分类。
3.病例资料收集:回顾性分析患者的临床资料,包括年龄、孕产次、孕中期胎儿超声检查、产前遗传学诊断结果等。
三、统计学分析
结 果
一、临床特点
115例患者平均年龄为(32.3±3.9)岁,其中高龄孕妇30例,占26.1%。孤立性NT增厚99例,占86.1%(99/115);非孤立性NT增厚16例,占13.9%(16/115),其中2例合并侧脑室增宽,6例合并颈背皮肤褶皱增厚,5例合并心脏异常,1例合并鼻骨发育不良,2例合并胎儿水肿。
二、介入性产前诊断情况
115例NT增厚患者均行产前诊断,其中绒毛活检(chorionic villus sampling,CVS)17例,羊膜腔穿刺98例。
三、产前遗传性诊断结果
1.孤立性NT增厚胎儿产前遗传学检测结果:在99例孤立性NT增厚胎儿中,有89例染色体核型分析及CMA检测结果均未见异常。对孕妇及其家属进行相应遗传咨询后,所有孕妇均选择继续妊娠,后续产前检查未见异常。
3例染色体核型分析和CMA检测结果均异常,占孤立性NT增厚病例的3.03%(3/99),其中2例21三体,对孕妇及其家属进行相应遗传咨询后,孕妇选择终止妊娠;另有1例47,XXX,对孕妇及其家属进行相应遗传咨询后,孕妇选择继续妊娠,后续产前检查未见异常。
7例染色体核型分析结果正常,但CMA检出临床意义不明确的CNV,占孤立性NT增厚病例的7.07%(7/99)。对孕妇及其家属进行相应遗传咨询后,孕妇选择继续妊娠,后续产前检查未见异常。
2.非孤立性NT增厚胎儿产前诊断结果:16例非孤立性NT增厚胎儿中,3例染色体核型分析与CMA检测结果均异常,均为18三体,对孕妇及其家属进行相应遗传咨询后,孕妇选择终止妊娠。1例CMA检测结果为arr[hg19]18p11.32p11.21(136,227_12,441,861)×1,18q22.2q23(68,292,152_78,013,728)×1,提示胎儿在18p11.32p11.21区段存在12.3 Mb片段的缺失,在18q22.2q23区段存在9.7 Mb片段的缺失,均为pCNV;根据CMA结果回顾染色体核型,考虑胎儿核型为46,XN,r(18)(p11.31→q21);对孕妇及其家属进行遗传咨询后,孕妇及其家属决定终止妊娠,遂于孕27周引产;对引产胎儿进行尸检发现胎儿眼距宽、人中短、全腭裂、左耳耳道闭锁、隐性脊柱裂、右足内翻和脑室部分狭窄,进一步病理检查提示双侧大脑神经元分布紊乱。其他12例病例染色体核型分析与CMA检测结果均正常。在非孤立性NT增厚患者中,共检出4例pCNV,占25.00%(4/16),其中仅通过CMA检测发现的pCNV有1例,占6.25%(1/16);此例虽然通过核型分析可以判断为18号的环状染色体,但其断裂点的判断依然需要通过CMA来确认,因此将其划分为仅通过CMA才能检出的pCNV。
对于胎儿NT厚度在其分布的P95到2.9 mm之间的病例通过CMA检出pCNV情况见表1。
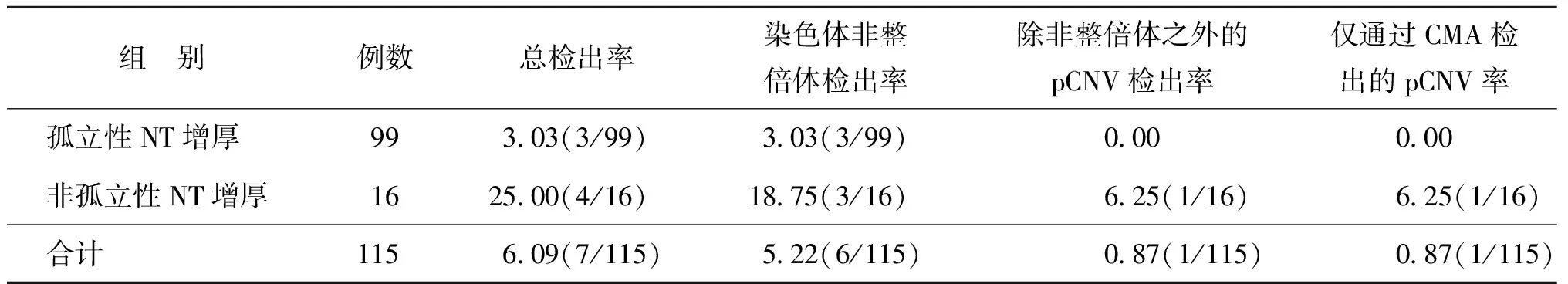
表1 胎儿NT厚度在其分布的P95到2.9 mm之间时CMA检出pCNV情况(%)
讨 论
一、NT增厚与胎儿染色体异常和pCNV的关系
早孕期超声测量NT厚度已被广泛用于筛查胎儿染色体异常、pCNV、胎儿结构异常(主要是胎儿先天性心脏异常)[1,9-11]。约20%的NT增厚胎儿存在染色体异常[12],文献报道,当NT厚度在其分布的P95以上时,胎儿罹患染色体异常的几率为20%~30%[12-13],其发生率随NT厚度的增加而增加;NT厚度在其分布的P95和P99之间时,胎儿染色体异常的发生率为7%;NT厚度在3.5~4.4 mm时,胎儿染色体异常的发生率为20%;NT厚度在5.5~6.4 mm时,胎儿染色体异常的发生率为50%;NT厚度在8.5 mm以上时,胎儿染色体异常的发生率为75%[12]。Yang等[14]对296例NT>3 mm的病例进行核型分析,发现19.9%(59/296)的病例存在染色体异常。Scott等[15]对120例NT>6.5 mm的胎儿进行研究,发现74%的胎儿存在染色体异常。
大量研究证明NT的增厚也与胎儿pCNV有关[1-3,9,16-20]。Grande等[2]对NT增厚、胎儿染色体核型正常病例进行CMA检测的文献进行系统回顾和荟萃分析,结果显示有额外5%的病例可通过CMA检测获得遗传学诊断(95%CI:2.0-8.0);对于孤立性NT增厚的病例,有额外4%的病例可通过CMA检测获得遗传学诊断(95%CI:2.0-7.0);对于非孤立性NT增厚的病例,则有额外7%的病例可通过CMA检测获得遗传学诊断(95%CI:2.0-12)。最常见的pCNV是22q11.2缺失、22q11.2重复、10q26.3缺失和12q21q22缺失。Bornstein等[3]对3 314例染色体核型正常胎儿的高危指标进行评估,这些高危指标包括:(1)NT异常(>3 mm);(2)有主要结构畸形;(3)超声软指标异常,研究发现当NT超过3 mm时pCNV的发生率为4.3%。上述研究结果提示,应对NT增厚胎儿进行产前染色体核型分析和CMA检测,并给予相应遗传咨询。
二、不同NT增厚切割值的胎儿染色体异常和pCNV检出情况
NT是指胎儿颈后的皮下液体积聚,通常在妊娠11~13+6周时可经超声观察到。NT的厚度受孕周影响,这也是胎儿正常发育的一部分。仅当NT的厚度超过一定切割值时才考虑其为异常[21]。以往的文献中对于NT增厚的定义存在很多不同的意见,也有多种关于NT增厚切割值的定义。究竟是以单一的切割值(如3 mm或3.5 mm),还是以NT分布的P95或P99作为切割值,仍然存在较多争论。对于NT的分布而言,胎儿不同头臀长(crown-rump length,CRL)所对应的NT值的分布范围是不同的。研究表明,当胎儿CRL为45 mm时,其NT分布的P95对应的厚度为2.1~2.2 mm,NT分布的P99对应的厚度为2.8 mm;当胎儿CRL为84 mm时,其NT分布的P95对应的厚度为2.7~2.8 mm,NT分布的P99对应的厚度为3.4 mm[6]。
国外绝大多数研究都以3.5 mm作为固定的切割值,即当胎儿CRL在45~84 mm之间时,如果NT厚度≥3.5 mm,需要对胎儿进行产前遗传学检测[20,22-25];而针对3.5 mm以下NT厚度病例的研究则很少。Petersen等[8]对丹麦中央区和荷兰鹿特丹地区胎儿NT厚度在3.0~3.4 mm之间的两个队列的病例进行回顾性研究,一共有552例病例被纳入研究。结果显示,胎儿染色体异常的风险为1∶7.4(13.5%,95%CI:8.2%-21.5%),其中69.1%的病例为胎儿13、18、21三体,可以通过无创产前检测(non-invasive prenatal testing,NIPT)被筛查出来;但有16.2%的病例为性染色体异常或>10 Mb的染色体不平衡性重排,有14.7%的病例只能通过CMA被检出CNV(其中90%为pCNV),这些病例是无法通过NIPT被筛查出来的。作者提出,对于NT厚度在3.0~3.4 mm之间时,胎儿染色体异常的风险大于1∶10。按照目前国际妇产科超声协会(ISUOG)关于NIPT的共识意见,对于染色体异常风险大于1∶10的高风险孕妇,不应对其进行NIPT检测,应对这部分病例进行包含CMA检测在内的产前遗传学检测[26]。
对于胎儿NT厚度在其分布的P95到2.9 mm之间的病例则鲜有研究。Maya等[7]对2011年11月到2015年11月期间以色列的数个医学中心对孤立性NT增厚病例的产前遗传学检测结果进行回顾性分析,其研究目的是评估NT厚度在3.0~3.4 mm之间是否可以作为产前CMA检测的适应证。一共有770例病例被纳入研究,作者将其分为3组:A组为NT≤2.9 mm的病例,作为正常对照组,共462例;B组为NT厚度在3.0~3.4 mm之间的病例,共170例;C组为NT≥3.5 mm的病例,共138例。所有病例均进行产前染色体核型分析和CMA检测,3组中pCNV的检出率分别为1.7%、6.5%和13.8%。在这项研究中,作者是将所有NT≤2.9 mm的病例作为正常对照组,其pCNV的检出率为1.7%,和其他文献[27]报道的超声正常胎儿的pCNV检出率相似,但作者并没有针对NT厚度在其分布的P95到2.9 mm之间的病例进行分析。
本研究对115例NT厚度在其分布的P95到2.9 mm之间的病例进行包含CMA检测在内的产前遗传学检测。在孤立性NT增厚的99例病例中,共检出3例异常病例,均为染色体非整倍体,其中2例为21三体,1例为47,XXX,胎儿染色体非整倍体的发生率为3.03%(3/99),高于背景人群发生率[28]。结果显示在该组人群中,胎儿染色体非整倍体风险增加,但仅通过CMA才可以检测到的pCNV风险并不增加。在非孤立性NT增厚的16例病例中,共检出4例异常病例,其中3例为18三体,通过染色体核型分析和CMA均可检出;1例pCNV仅通过CMA检出,胎儿在18p11.32p11.21区段存在12.3 Mb片段的缺失,在18q22.2q23区段存在9.7 Mb片段的缺失,均为pCNV,最终根据CMA结果回顾染色体核型,考虑胎儿核型为46,XN,r(18)(p11.31→q21)。此例虽然通过核型分析可以判断为18号的环状染色体,但其断裂点的判断依然需要通过CMA检测来确认,因此将其划分为仅通过CMA检测才能检出的pCNV。在非孤立性NT增厚的病例中,染色体异常总体发生率为25%,而仅通过CMA检测检出的pCNV发生率为6.25%,提示在非孤立性NT增厚的病例中,胎儿染色体非整倍体和pCNV的风险均增加。
有研究表明胎儿pCNV的发生率与孕妇年龄无关,为1/270[29-30]。在Wapner等[27]的前瞻性研究中,不合并超声异常的胎儿pCNV发生率为1.7%。Callaway等[31]对12 362例产前CMA检测的病例进行回顾性分析,对于不合并超声异常的病例,包括孕妇高龄、血清学筛查高风险人群中或者是孕妇焦虑要求进行产前CMA检测群体中,pCNV发生率分别为1.0%和1.1%。综合以上研究,不合并超声异常的胎儿pCNV的发生率在1.0%到1.7%之间。本研究中非孤立性NT增厚组的pCNV检出率明显高于不合并超声异常的胎儿pCNV的发生率。
本研究结果显示,对于NT厚度在其分布的P95到2.9 mm之间的病例,孤立性NT增厚时胎儿染色体非整倍体风险增加,而在非孤立性NT增厚病例中,胎儿染色体非整倍体和pCNV的风险均增加。建议以NT厚度在其分布的P95作为NT增厚的切割值,对胎儿进行产前遗传学检测,尤其是对于非孤立性NT增厚的病例,建议进行包含CMA检测在内的产前遗传学检测。而对于孤立性NT增厚的病例,胎儿染色体非整倍体风险增加,但非整倍体类型除了21三体之外,也包括性染色体异常,因此不宜采用NIPT进行筛查,建议对其进行产前遗传学检测,至少进行染色体核型分析,是否需要对此类病例进行产前CMA检测,尚需进一步积累病例进行研究。
三、本研究的不足之处
本研究的数据来源于单个产前诊断中心,且其中部分病例来自于外院高危转诊。一方面由于病例样本数较少;另一方面,涉及的人群较为混杂,不是背景人群,因此本研究并没有计算NT厚度在其分布的P95到2.9 mm之间的发生率。
虽然病例数有限,但研究结果显示,当NT厚度在其分布的P95到2.9 mm之间时,胎儿染色体异常风险增加,建议将NT厚度在其分布的P95作为NT增厚的切割值,对胎儿进行产前遗传学检测。当NT增厚为非孤立性表现时,胎儿染色体非整倍体及pCNV风险均升高,产前遗传学检测的方案应包含CMA检测;当NT增厚为孤立性表现时,胎儿染色体非整倍体异常风险增加,但pCNV风险并不增加,产前遗传学检测方案至少应包含产前染色体核型分析,是否需要进行CMA检测尚需进一步积累病例进行研究。

