高通量血液透析与低通量血液透析在尿毒症患者中的应用效果
余彬,暴小方,张新庄,张艳梅,郭永新
(1.延津县人民医院 肾内科,河南 新乡 453200;2.新乡医学院第三附属医院 血液净化室,河南 新乡 453000)
尿毒症是终末期肾衰竭的症状之一,主要与尿毒症毒素的毒性作用有关。肾功能损伤时,患者体液内一些毒素水平升高,而这类物质可造成患者出现异常临床症状或代谢紊乱[1]。与正常人群相比,尿毒症患者体液内的尿毒症毒素水平升高,并极易引起患者身体内水、酸碱失衡,电解质及糖类、蛋白质、脂类等代谢紊乱,诱发骨骼病变及呼吸系统、心血管系统、消化系统、神经肌肉系统及血液系统等多个系统的病变。目前,根据分子量大小可将尿毒症毒素分为小分子、中分子及大分子物质毒素。近年来,治疗尿毒症有效且常用的方法是维持性血液透析,主要采用低通量和高通量两种透析器进行透析,低通量血液透析清除小分子毒素物质的效果较好,但对中分子和大分子毒素物质的清除作用不理想[2]。高通量透析器具有较大的透析膜孔径、较高的超滤系数,可有效清除中分子和大分子毒素物质,改善尿毒症患者的预后[3]。研究指出,尿毒症患者表现出低钙、高磷、高甲状旁腺素,导致心血管发生转移性钙化,易发生心血管事件[4]。而微炎症、胰岛素抵抗等可能共同参与尿毒症患者心血管疾病的发生过程[5]。本研究选取2017年2月至2019年6月在延津县人民医院接受治疗的78例尿毒症患者,探讨低通量和高通量血液透析治疗尿毒症患者的临床效果,及对患者胰岛素抵抗、炎症因子、心功能指标、心肌损伤标志物等的影响。
1 资料与方法
1.1 一般资料回顾性选取2017年2月至2019年6月在延津县人民医院接受治疗的78例尿毒症患者。根据选择的透析治疗方案分为低通量组(n=39)和高通量组(n=39)。低通量组:女15例,男24例;年龄41~76(55.63±6.87)岁;病程:1~6(3.48±1.15)a;原发病慢性肾炎18例,糖尿病肾脏疾病13例,慢性肾盂肾炎4例,其他4例。高通量组:女14例,男25例;年龄:40~78(56.35±7.16)岁;病程1~6(3.62±1.20)a;原发病慢性肾炎20例,糖尿病肾脏疾病12例,慢性肾盂肾炎5例,其他2例。两组患者一般资料均衡可比(P>0.05)。本研究经延津县人民医院医学伦理委员会审核批准。
1.2 纳入与排除标准
1.2.1纳入标准 (1)尿毒症血液透析患者;(2)血管通路良好;(3)患者及家属同意透析方案,并签署知情同意书。
1.2.2排除标准 (1)肝功能异常;(2)严重出血倾向;(3)正在使用免疫抑制剂或激素;(4)1个月内发生感染、心脑血管事件;(5)严重心血管事件。
1.3 治疗方法低通量组接受低通量血液透析治疗,透析器超滤系数9.8 mL·h-1·mmHg-1(1 mmHg=0.133 kPa),透析器表面积1.5 m2,每周透析2次,每次4 h,每次脱水量3 000~6 000 mL,碳酸氢盐透析液流量500 mL·min-1,血流量250~300 mL·min-1。高通量组接受高通量血液透析治疗,透析器超滤系数50 mL·h-1·mmHg-1,其他参数同低通量组。
1.4 观察指标
1.4.1临床疗效 治疗6个月后评估临床疗效:显效,即恶心、呕吐、头痛、疲乏、心律失常及腹痛等临床症状和体征彻底或基本消失,患者肾功能各项指标改善>60%;有效,即恶心、呕吐、头痛、疲乏、心律失常及腹痛等临床症状和体征明显减轻,肾功能各项指标改善30%~60%;无效,即临床症状未减轻,肾功能各项指标改善<30%,或病情加重。总有效率为显效率与有效率之和。
1.4.2 肾功能 治疗前、治疗6个月,采用日本日立7600-120全自动生化分析仪测定肾功能指标,主要包括血清肌酐(serum creatinine,Scr)和β2-微球蛋白(β2-microglobulin,β2-MG)。
1.4.3 胰岛素情况 治疗前、治疗6个月,检测血浆空腹胰岛素(fasting insulin,FINS)水平和稳态模型胰岛素抵抗指数(homeostasis model assessment-insulin resistance index,HOMA-IR)。采用放射免疫法测定FINS水平。
1.4.4 炎症因子 分别于治疗前、治疗6个月,空腹取静脉血5 mL,离心,取上层血清,采用酶联免疫吸附试验测定患者的血清炎症因子水平。主要包括白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和高敏C反应蛋白(high sensitivity C-reactive protein,hs-CRP)水平。
1.4.5 心功能指标 分别于治疗前、治疗6个月,采用Nemio SSA-550A TOSHIBA超声显像系统测定心功能指标,主要包括每分心输出量(cardiac output,CO)和左室射血分数(left ventricular ejection fraction,LVEF)。
1.4.6 心肌损伤标志物 分别于治疗前、治疗6个月检测血清心肌损伤标志物水平。采用酶联免疫吸附试验测定心肌肌钙蛋白T(cardiac troponin T,cTnT)水平,采用荧光层析法测定肌酸激酶同工酶(creatine kinase-MB,CK-MB)水平,均使用北京邦定生物医学公司试剂盒。
1.5 统计学方法采用SPSS 23.0统计软件处理本文数据。计量资料,如Scr、β2-MG、FINS、HOMAIR、IL-6、hs-CRP、TNF-α、CO、LVEF、cTnT以及CK-MB水平以均数±标准差(±s)表示,组内治疗前后比较,采用配对t检验,组间两两比较,采用独立样本t检验;计数资料,如临床疗效以例数(%)表示,组间比较,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效高通量组患者的临床总有效率高于低通量组(P<0.05)。见表1。

表1 低通量组和高通量组患者的临床疗效对比
2.2 肾功能治疗前,低通量组和高通量组患者的Scr和β2-MG水平比较,差异无统计学意义(P>0.05);治疗6个月,低通量组和高通量组患者的Scr和β2-MG水平低于治疗前(P<0.05);治疗6个月,高通量组患者的Scr和β2-MG水平低于低通量组(P<0.05)。见表2。
表2 低通量组和高通量组患者治疗前后肾功能指标比较(±s)
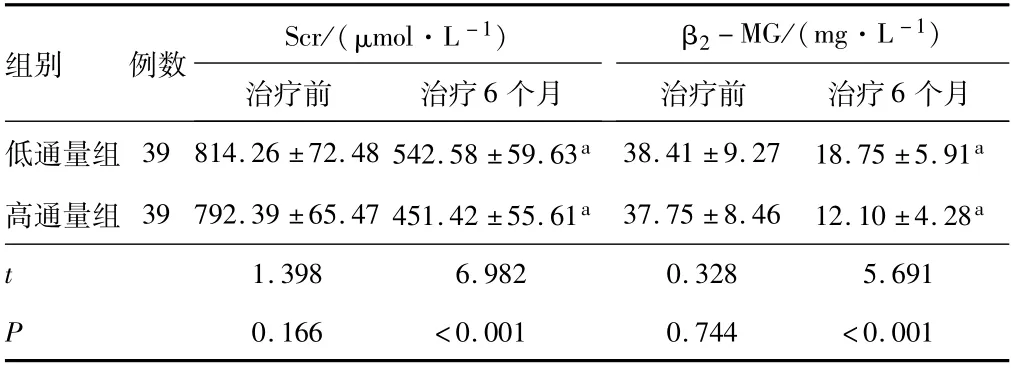
表2 低通量组和高通量组患者治疗前后肾功能指标比较(±s)
注:与同组治疗前相比,a P<0.05;Scr为血清肌酐;β2-MG为β2-微球蛋白。
组别 例数 Scr/(μmol·L-1)β2-MG/(mg·L-1)个月低通量组 39 814.26±72.48 542.58±59.63a 38.41±9.27 18.75±5.91治疗前 治疗6个月治疗前 治疗6 a高通量组 39 792.39±65.47 451.42±55.61a 37.75±8.46 12.10±4.28a t 1.398 6.982 0.328 5.691 P 0.166 <0.001 0.744 <0.001
2.3 FINS、HOMA-IR治疗前,低通量组和高通量组患者的FINS和HOMA-IR指数比较,差异无统计学意义(P>0.05);治疗6个月,低通量组和高通量组患者的FINS和HOMA-IR指数低于治疗前P<0.05);治疗6个月,高通量组患者的FINS和HOMAIR指数低于低通量组(P<0.05)。见表3。
表3 低通量组和高通量组患者治疗前后FINS水平和HOMA-IR指数对比(±s)
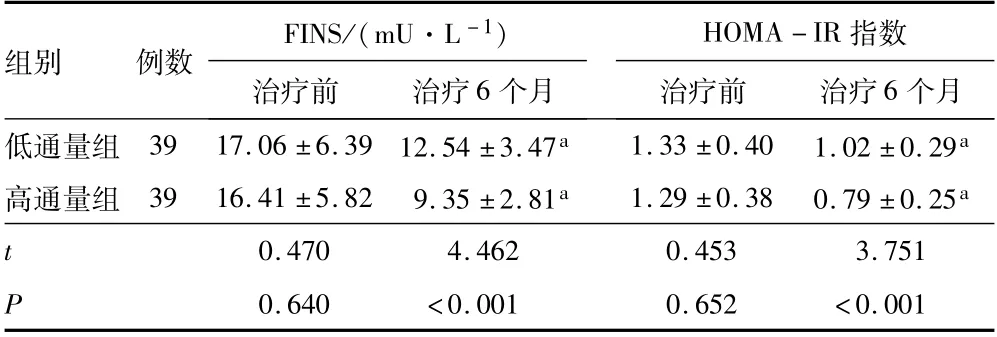
表3 低通量组和高通量组患者治疗前后FINS水平和HOMA-IR指数对比(±s)
注:与同组治疗前相比,a P<0.05;FINS为空腹胰岛素;HOMA-IR为稳态模型胰岛素抵抗指数。
组别 例数 FINS/(mU·L-1)HOMA-IR个月低通量组 39 17.06±6.39 12.54±3.47a 1.33±0.40 1.02±0.29治疗前 治疗6个月指数治疗前 治疗6 a高通量组 39 16.41±5.82 9.35±2.81a 1.29±0.38 0.79±0.25a t 0.470 4.462 0.453 3.751 P 0.640 <0.001 0.652 <0.001
2.4 炎症因子治疗前,低通量组和高通量组患者的IL-6、hs-CRP和TNF-α水平比较,差异无统计学意义(P>0.05);治疗6个月,低通量组和高通量组患者的IL-6、hs-CRP和TNF-α水平低于治疗前(P<0.05);治疗6个月,高通量组患者的IL-6、hs-CRP和TNF-α水平低于低通量组(P<0.05)。见表4。
表4 低通量组和高通量组患者治疗前后血清炎症因子比较(±s)
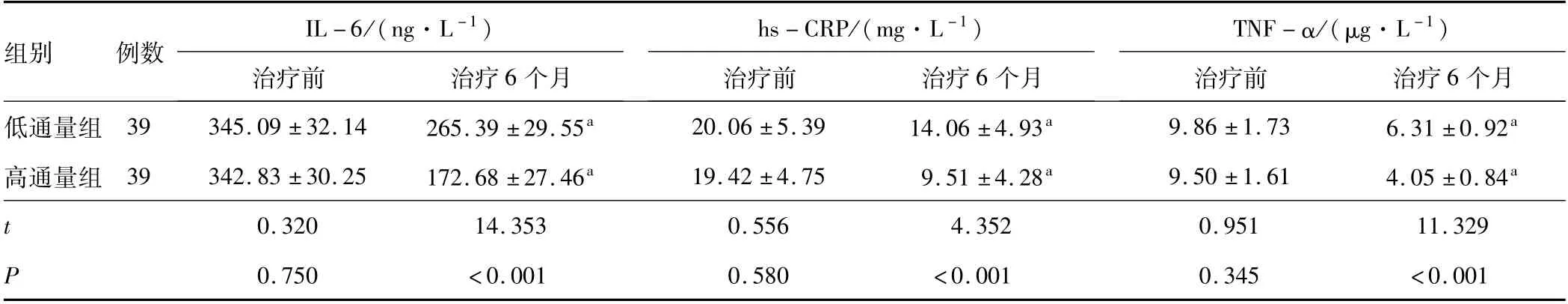
表4 低通量组和高通量组患者治疗前后血清炎症因子比较(±s)
注:与同组治疗前相比,a P<0.05;IL-6为白细胞介素-6;TNF-α为肿瘤坏死因子-α;hs-CRP为高敏C反应蛋白。
组别 例数 IL-6/(ng·L-1)hs-CRP/(mg·L-1)TNF-α/(μg·L-1)个月低通量组 39 345.09±32.14 265.39±29.55a 20.06±5.39 14.06±4.93a 9.86±1.73 6.31±0.92治疗前 治疗6个月治疗前 治疗6个月治疗前 治疗6 a高通量组 39 342.83±30.25 172.68±27.46a 19.42±4.75 9.51±4.28a 9.50±1.61 4.05±0.84a t 0.320 14.353 0.556 4.352 0.951 11.329 P 0.750 <0.001 0.580 <0.001 0.345 <0.001
2.5 心功能指标治疗前,低通量组和高通量组患者的LVEF和CO比较,差异无统计学意义(P>0.05);治疗6个月,低通量组和高通量组患者的LVEF和CO高于治疗前(P<0.05);治疗6个月,高通量组患者的LVEF和CO高于低通量组(P<0.05)。见表5。
表5 低通量组和高通量组患者的治疗前后心功能指标比较(±s)
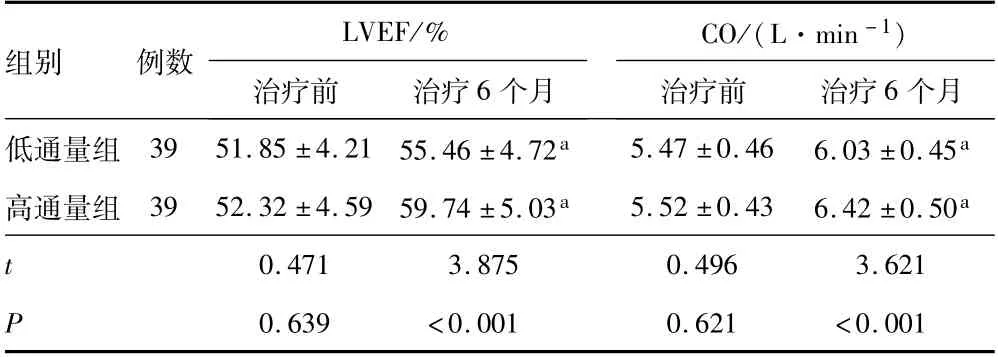
表5 低通量组和高通量组患者的治疗前后心功能指标比较(±s)
注:与同组治疗前相比,a P<0.05;LVEF为左室射血分数;CO为心输出量。
组别 例数LVEF/%治疗前 治疗6个月CO/(L·min-1)个月低通量组 39 51.85±4.21 55.46±4.72a 5.47±0.46 6.03±0.45治疗前 治疗6 a高通量组 39 52.32±4.59 59.74±5.03a 5.52±0.43 6.42±0.50a t 0.471 3.875 0.496 3.621 P 0.639 <0.001 0.621 <0.001
2.6 心肌损伤标志物治疗前,低通量组和高通量组患者的血清cTnT和CK-MB水平比较,差异无统计学意义(P>0.05);治疗6个月,低通量组和高通量组患者的血清cTnT和CK-MB水平低于治疗前(P<0.05);治疗6个月,高通量组患者的血清cTnT和CK-MB水平低于低通量组(P<0.05)。见表6。
表6 低通量组和高通量组治疗前后心肌损伤标志物对比(±s)

表6 低通量组和高通量组治疗前后心肌损伤标志物对比(±s)
注:与同组治疗前相比,a P<0.05;cTnT为心肌肌钙蛋白T;CK-MB为肌酸激酶同工酶。
组别 例数 cTnT/(ng·L-1)CK-MB/(mmol·L-1)个月低通量组 39 32.06±5.83 26.08±5.14a 52.16±9.18 36.09±12.16治疗前 治疗6个月治疗前 治疗6 a高通量组 39 31.58±5.47 20.75±4.26a 51.49±8.64 24.75±10.13a t 0.375 4.986 0.332 4.475 P 0.709 <0.001 0.741 <0.001
3 讨论
现阶段,尿毒症临床治疗目标是清除体内毒素、改善肾功能和微炎症状态[6]。治疗尿毒症有效且常用的方法是维持性血液透析[7-8]。临床常根据分子量大小将尿毒症毒素分为小分子、中分子、大分子三大类。低通量血液透析由于透析膜孔径较小,对中分子和大分子毒素物质的清除作用较弱,而高通量透析具有较大的透析膜孔径、较高的超滤系数,可有效清除机体内中分子和大分子毒素物质,改善尿毒症患者的预后[9-10]。鉴于此,本研究对血液透析高通量和低通量进行分组分析,结果显示,高通量组总有效率高于低通量组。由此可见,与常规低通量血液透析相比,高通量血液透析的疗效更好。
近年来,随着医疗资源的快速发展,目前血液净化技术已成为治疗尿毒症及其他终末期肾病患者的有效方法之一。通过血液净化,患者生存期得以延长,临床症状减轻,生活质量得到改善。中大分子物质或毒素在体内积聚或清除不充分均可使慢性肾衰竭尿毒症患者发生远期并发症,难以改善肾功能,减轻炎症反应。本研究数据显示,治疗6个月,高通量组HOMA-IR指数、Scr、β2-MG、FINS及 血 清IL-6、hs-CRP、TNF-α水平均低于低通量组。这表明高通量血液透析应用于尿毒症患者,可减轻炎症,改善胰岛素抵抗及肾功能,与既往研究结果[11-12]一致。研究结果提示,高通量透析可能是通过改善患者微炎症状态来实现胰岛素抵抗的改善,但二者之间是否直接相互影响尚未清楚,有待后续研究进一步证实。
研究证实,微炎症反应和胰岛素抵抗是尿毒症患者发生心血管疾病的高危因素[13]。代偿性胰岛素抵抗本身作用及胰岛素抵抗抑制心肌细胞蛋白分解、促使心肌细胞内高钙、促进去甲肾上腺素生成等均可诱发左心室肥厚,增加心血管疾病的发生风险[14-15]。cTnT和CK-MB是常用的心肌损伤标志物,与心肌是否损伤及损伤程度有关[16]。本研究结果显示,治疗6个月,高通量组血清cTnT和CK-MB水平低于低通量组,LVEF和CO高于低通量组。提示高通量血液透析应用于尿毒症患者,可降低血清心肌损伤标志物水平,改善心功能。考虑这与高通量血液透析有效清除炎症因子、中分子和大分子毒素以及改善胰岛素抵抗有关。
综上可知,与低通量血液透析相比,将高通量血液透析应用于尿毒症患者的疗效显著,可降低血清心肌损伤标志物水平,减轻微炎症状态及胰岛素抵抗,改善肾功能及心功能。

