乙状结肠癌并发恶性肠梗阻处理的临床决策讨论
刘华 张小田
恶性肠梗阻是指由于恶性肿瘤或肿瘤相关治疗手段导致的肠内容物通过障碍,是晚期恶性消化道肿瘤的常见并发症,主要表现为恶心、呕吐、腹痛、进食障碍[1]。
恶性肿瘤相关肠梗阻依据部位、程度、病因等进行分类,部位包括小肠、结肠和直肠;程度包括部分粪便可以通过的不全性肠梗阻和粪便完全不能通过的完全性肠梗阻,根据病因可分类为机械性肠梗阻和功能性肠梗阻。机械性肠梗阻指肿瘤占位压迫导致,功能性肠梗阻指肠运动功能障碍或肠麻痹导致,机械性肠梗阻更加棘手和顽固。恶性肿瘤相关肠梗阻主要与恶性肿瘤原发灶、腹膜转移、术后黏连、放疗等相关[2]。晚期结肠癌引起大肠梗阻的发生率在10%~29%[3-4]。本研究对北京大学肿瘤医院收治的1 例乙状结肠癌合并肠梗阻的临床资料进行分析和讨论,结合文献探讨患者治疗中的临床决策,以期为临床实践提供思路。
1 病例摘要
患者男性,67 岁,于2012年因肺癌于北京大学肿瘤医院行“左肺上叶切除+部分下叶切除术”及辅助放化疗,后定期行包括胸部增强CT、腹部超声、头颅MRI 在内的影像学检查复查至2020年11月,未见疾病复发,并定期于中西医门诊就诊服用中药汤剂。期间2020年6月开始间断出现大便次数增多,排稀便5~6 次/d,未予重视。2020年11月门诊再次行常规复查,腹部超声发现肝内多发结节,考虑转移。基于患者肺癌病史,考虑肺癌肝转移不除外。2020年11月超声引导行肝占位穿刺,病理显示形态及免疫组织化学结果符合肠型腺癌肝转移,考虑结直肠来源可能,其次考虑肺肠型腺癌肝转移。基因检测未检测到表皮生长因子受体(epidermal growth factor receptor,EGFR)、KRAS、NRAS、BRAF、人类表皮生长因子受体(human epidermal growth factor receptor 2,HER2)、MET、PIC3CA 基因突变。未检测到ALK、ROS1、RET 融合基因表达。2020年12月行腹部增强CT 示肝新增多发占位,考虑转移。脾多发低强化结节较前增多、增大,考虑转移可能大。肝门区、腹膜后多发肿大淋巴结增多、增大,转移可能。2021年1月再次行腹盆部增强CT 检查示降乙交界处结肠壁增厚,考虑恶性可能,建议结合肠镜病理;肝多发转移;肝门区、腹膜后多发肿大淋巴结(图1)。2日后患者肠镜显示降乙交界处环溃疡隆起型肿物,阻塞肠腔,内镜无法通过,不全梗阻(图2)。肠镜降乙交界处活检病理,中分化腺癌,免疫组织化学显示EGFR(2+),HER2(0),抗原Ki-67(90%+),DNA 错配修复完整(proficient DNA mismatch repair,pMMR),程序性死亡因子配体1(programmed death-ligand 1,PD-L1)(22C3)(CPS=8)。基因检测RAS、RAF 均为野生型,UGT1A1*28 野生型,*6杂合型。CEA、NSE升高,CA199、CA724、CA125正常(图3)。
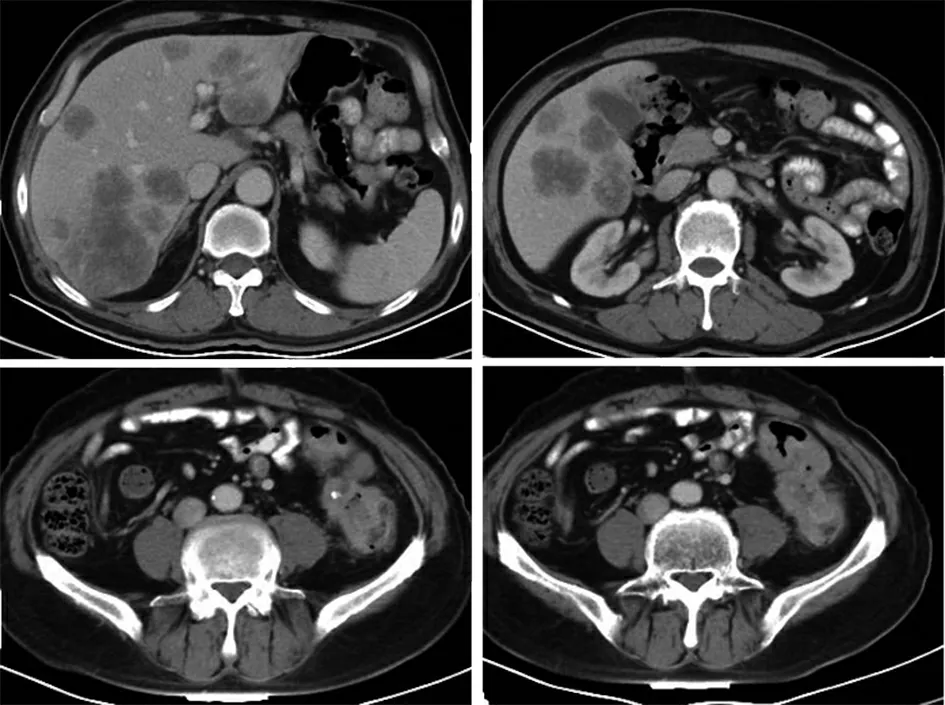
图1 2021年1月20日患者基线腹盆CT 肝多发占位和降乙交界处肠壁增厚
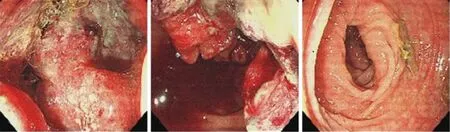
图2 2021年1月22日肠镜下降乙交界肠腔狭窄,肠镜无法通过
考虑患者降乙交界处中分化腺癌肝转移诊断明确,且根据基因检测结果,患者可以从化疗联合西妥昔单抗靶向治疗中获益。患者现一般情况较好,排便排气基本正常,NRS2002 营养筛查评分1 分,无营养风险,膳食情况见表1。从2021年2月开始一线FOLFOX(氟尿嘧啶+奥沙利铂)+西妥昔单抗方案治疗,具体为奥沙利铂 85 mg/m2160 mg d1,氟尿嘧啶 2.4 g/m24.5 g civ 46 h,西妥昔单抗 500 mg/m2900 mg d1,q14 d。因患者个人时间原因,4 个周期治疗后复查腹盆部CT 检查示:降乙交界处结肠壁增厚加重,近端结肠扩张,肠管内容物增多,肠管内容物增多,肝多发占位缩小,肝门区、腹膜后多发肿大淋巴结部分同前,部分缩小,腹膜局部增厚(图4)。CEA 和NSE 下降(图3)。综合评效为部分缓解(partial remission,PR)(表2)。

图3 患者治疗过程中肿瘤标志物的变化

图4 药物治疗前、后CT 对比

表1 患者治疗期间膳食及营养支持方案

表2 患者影像学检查及评效
第5 个周期治疗后患者出现腹部绞痛,脐周明显,且腹痛逐渐加重伴排气排便停止。2021年4月7日腹盆CT 显示降乙交界处结肠壁增厚同前,局部结肠梗阻,另新发小肠梗阻(图5)。考虑患者出现小肠梗阻,予内科保守治疗后症状无明显改善。患者NRS2002营养筛查评分4 分,存在营养风险,禁食水,根据患者体质量、身高、年龄计算患者推荐的每日总能量为2 000~2 400 kal,每日推荐蛋白量110 g 左右。肠外营养支持(parenteral nutrition,PN)提供1 500 kal 和蛋白63 g。内镜中心会诊考虑先尝试置入肠梗阻引流管引流胃肠积液积气,通过肠梗阻导管随肠蠕动下移辅助解除肠梗阻,但可能无法通过梗阻部位。2021年4月胃镜下置入肠梗阻导管。患者夜间腹痛及排便情况无缓解,引流效果不佳,且导管外移,腹平片可以看到明显气液平(图6)。2日后腹部CT 检查发现小肠肠梗阻略减轻,结肠梗阻无变化。
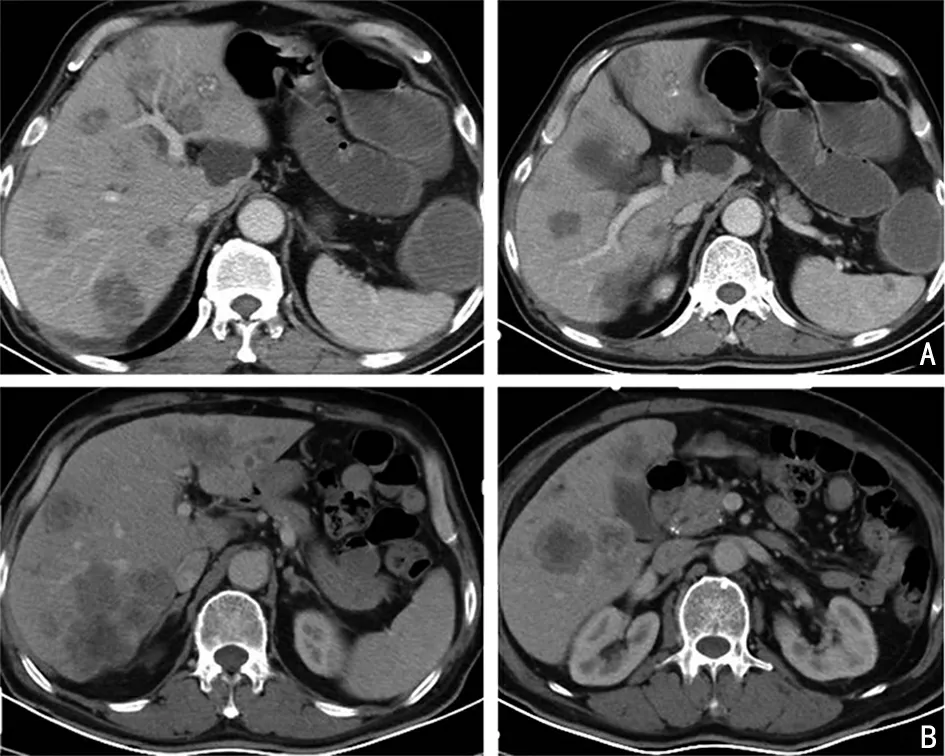
图5 术后继续治疗前CT 评估患者肝脏病灶较前增大
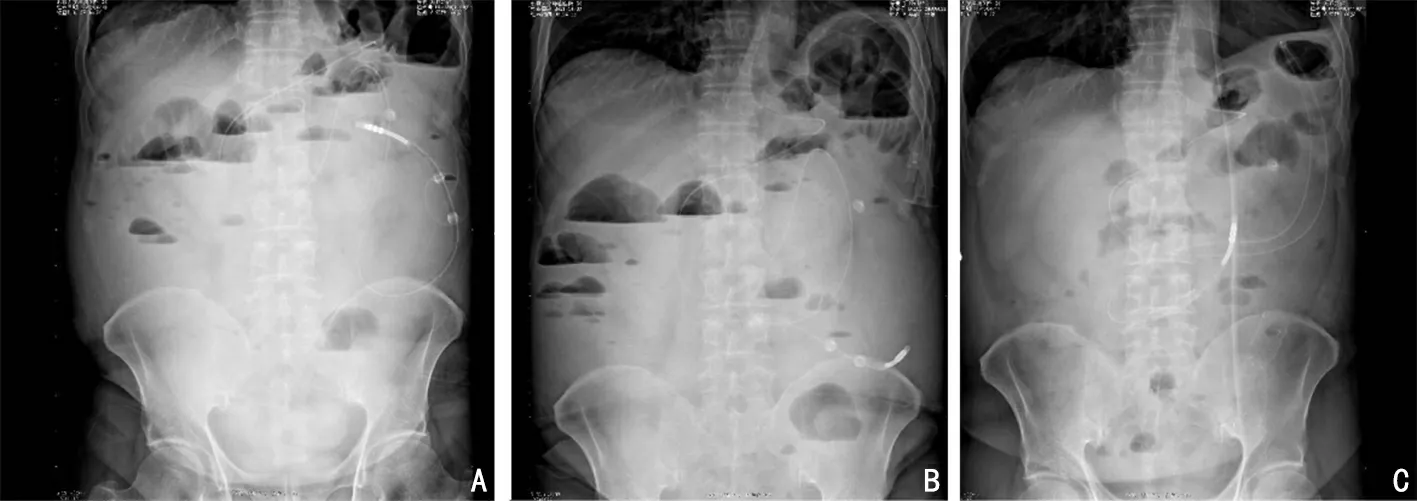
图6 肠梗阻治疗过程中腹平片对比
内镜中心、胃肠外科、肝胆外科会诊讨论保守治疗及肠梗阻引流管控制不佳,患者肿瘤原发灶梗阻,有必要行手术切除,优先予内镜下梗阻部位支架置入桥接,择期手术。如置入困难或术中穿孔,考虑紧急行外科手术干预。2021年4月患者肠镜下见降乙交界肠腔缩窄明显,内镜无法通过,在导丝引导下置入肠道支架后大量肠内容物涌出。后患者恢复自主排便,腹痛缓解,腹平片未见气液平(图6)。逐步过渡为半流食,营养支持以半流食、口服为主,每日营养剂维持在1 800 kal 左右,蛋白80 g 左右(表1)。相比患者刚开始治疗时期,体质量没有明显的波动。
因CT 显示梗阻部位肠壁较薄,存在穿孔风险,2021年4月患者接受腹腔镜下乙状结肠癌姑息性切除术,根据手术要求,患者需禁食。围手术期营养筛查NRS2002 评分为5 分,存在营养风险,患者手术前由口服营养剂补充+配合性肠外营养→全肠外营养→肠内营养为主+配合性肠外营养→口服营养剂补充逐步过渡(表1)。手术期PN 提供每日总能量1 600 kcal,蛋白质63 g。术中探查:肝脏表面可见转移灶,腹盆腔未见种植转移结节。肿物位于降结肠乙状结肠交界部,侵透浆膜,侵犯临近侧腹膜。肠管内可见支架置入。肿瘤近段肠管可见明显水肿并扩张。术中清扫肠系膜下动脉根部及肠系膜下静脉右侧淋巴结、乙状结肠动脉根部淋巴结,并完整切除肿瘤。行降结肠-乙状结肠端端吻合。术后病理:溃疡性中分化腺癌肿瘤退缩分级(tumor regression grading,TRG)2 级,癌侵及肠周纤维脂肪组织;未见脉管癌栓及神经侵犯;近端、远端及环周切缘未见癌;肠周淋巴结可见癌转移(1/10),未见被膜外侵犯;肿瘤病理分期:ypT3N1a。免疫组织化学和RAS、RAF 基本同前。患者术后恢复好,因新冠肺炎疫情未及时返院,至2021年6月复查腹部CT 发现腹腔内肠管积液扩张减轻,原肠内高密度影消失,肝脏转移灶较前增大(图5)。2021年7月至2021年10月继续进行6 个周期(第6~11 个周期)FOLFOX+西妥昔单抗治疗,第8 个周期治疗后评效PR(表2)。后续治疗和随访中,患者后续治疗中体质量未见明显波动。
既往:2012年因肺癌行“左肺上叶切除+部分下叶切除术”,并4 个周期吉西他滨+顺铂方案化疗,右侧髂骨转移灶姑息放疗,后患者定期复查,右侧髂骨病灶好转,胸部CT、头颅MRI、腹部超声、淋巴结超声均未见转移。
2 讨论要点
1)恶性肠梗阻的诊断;2)恶性肠梗阻的支持治疗策略及选择;3)恶性肠梗阻的手术治疗;4)恶性肠梗阻支架植入及抗肿瘤治疗的综合考量。
3 临床讨论
恶性肠梗阻在结肠癌患者人群中有着较高的发病率。由于肠腔内积压大量内容物,肠腔扩张,肠壁水肿,肠壁血运障碍,炎性因子分泌,肠壁通透性增加,感染几率增加,同时面临着常规治疗中断或疾病进展,病情重预后差[5],对于晚期肿瘤患者,缓解梗阻症状是主要目的,并改善生存质量。
《中国恶性肿瘤相关急腹症专家共识》认为恶性肠梗阻的管理需要多学科参与评估,对于可切除的患者,以手术为主,对于潜在可切除的患者,可通过支持手段或造口、短路手术实现可切除,对于晚期转移患者,以支持及姑息治疗手段为主[6]。国外恶性肠梗阻的主要的治疗方法包括也鼻胃管减压、静脉输液和药物治疗,经过选择的患者可以接受胃造口管、支架和外科(切除、搭桥和造口)干预[1]。奥曲肽能有效减少胃肠道分泌物和绞痛,从而减少恶性肠梗阻引起的恶心呕吐,是管理恶性肠梗阻的首选药物。奥氮平或胃复安可有效减轻继发于部分肠梗阻的恶心和呕吐;氟哌啶醇已被常规用作止吐剂,但没有随机对照研究[3]。支持手段可以是经肠梗阻导管引流,也可以置入肠道支架。置入肠梗阻导管可以达到引流肠道内积液、积气,同时通过向下蠕动可以尝试通过肠道狭窄段以控制肠梗阻。内镜下置入腔内支架也可以达到很好的缓解率(64%~100%)[7]。但肠梗阻导管更多地是起到引流的作用,质地较软,对于肠腔占位的机械性完全性肠梗阻,缓解梗阻的作用有限,而且容易出现自发性脱出。但肠梗阻导管可以拔除,对后续手术治疗的影响较小。置入金属支架可以实现梗阻肠腔的再通,但是同时具有肠道穿孔、出血,局部肿瘤占位变形,手术难度增大的风险,尤其是对于接受贝伐珠单抗治疗的患者,肠道穿孔的风险更大[8]。
一项多中心临床研究将患者1∶1 随机分组分别接受结肠支架置入桥接择期手术和急诊手术,2 次连续中期分析发现支架组30 天并发症的发生率高于急诊手术组,因安全问题而中止研究。支架组有6 例出现了穿孔,而手术组为0,有研究认为结肠支架植入在急诊手术中没有决定性的临床优势,它可以作为一种替代治疗,但是考虑到穿孔引起的肿瘤扩散需要谨慎[9-10]。有单中心回顾性研究发现结直肠支架可以有效缓解恶性结直肠梗阻,并发症发生率在可以接受的水平而且2/3 患者可以避免永久性造口,其中73.1%(49/67)恶性肠梗阻患者置入肠梗阻支架桥接择期手术,避免急诊手术并且主要目的是姑息性的,83.7%(41/49)可以成功置入,61.2%(30/49)的患者避免了造瘘,30 天内的并发症发生率为20%,包括穿孔(2/49)、直肠出血(2/49)、支架移动(1/49)等[11]。但是该研究是在英国一家教学医院中进行,可以认为内镜下肠道支架的置入及手术水平相对可及及成熟。一项纳入美国数据库2009年至2016年3 059 例恶性结直肠梗阻患者的回顾性研究表明[12],95.4%选择了急诊切除,142 例选择肠道支架和择期手术。而择期手术相比急诊手术,可以减少造口,提高患者生存质量。尽管存在增加穿孔、出血、肿瘤进展转移等的风险,有研究[13-14]发现支架植入和择期手术与急诊手术比较,3年死亡率无显著差异,而手术时间、造口率下降,Ⅰ期吻合率、腹腔镜手术次数上升,生存质量未发现差异。欧洲胃肠内镜学会(ESGE)[8]和美国胃肠内镜学会(ASGE)[15]推荐肠道支架置入可以作为缓解恶性肠梗阻和姑息治疗的选项。ESGE 建议,结肠支架置入是姑息恶性结肠梗阻的首选治疗方法;在共享的决策过程中,对于潜在可治愈的左半梗阻性结肠癌,支架植入桥接择期手术可以作为急诊手术的一个替代选项,同时需要考虑支架技术的可获得性,支架相关穿孔的风险,较高的复发率,以及支架的技术和临床失败率等各方面;对于支架相关穿孔的患者应考虑紧急切除[8]。但选择适合放置支架的患者需要仔细讨论风险和获益,同时考虑可能的系统性抗肿瘤治疗和预后,支架植入需要考虑多方面因素:当地医疗能力、梗阻部位及长度、并发症风险、手术选择、预后等;肠道支架可以帮助缓解单部位恶性肠梗阻患者的症状,但是并不适用于多水平梗阻的患者;根据适应证对肠梗阻患者置入肠道支架可以增加临床获益、减少住院时间、重症监护时间、化疗时间,但是置入肠道支架比手术具有更高的穿孔、复发转移及再梗阻的风险[1]。梗阻部位、支架长度、支架置入相关穿孔均可影响后续手术的难度及顺利进行。
本例患者接受化疗联合靶向抗肿瘤治疗后,疾病达PR,结肠壁较前增厚。综合患者疾病状态,更考虑肠壁的改变属于治疗后的纤维化改变,小肠梗阻继发于结肠原发灶梗阻。支架置入后患者病情变化及手术切除病理的TRG 分级也予以证实。最初考虑到支架置入对手术难度的影响、穿孔风险,患者存在腹膜转移导致小肠梗阻的可能,首先置入鼻肠梗阻导管,但引流效果不佳,且出现导管活动,因此患者肠梗阻未能缓解。各学科讨论:1)胃肠外科会诊考虑:患者乙状结肠癌肝转移,腹膜后淋巴结转移,化疗后未出现间断腹不绞痛,排气或排便后可缓解,后出现腹痛加重及排气排便停止,CT 检查示低位肠梗阻,予经鼻肠梗阻导管置入,复查CT 示结肠小肠梗阻较前有所减轻。查看患者诉腹痛缓解,未排气排便,腹膨隆,肠鸣音弱,未闻及气过水声,考虑急性单纯性低位完全性肠梗阻,继续禁食水、胃肠减压、肠外营养、抑酸、抑酶支持治疗,可以考虑经肛肠支架或肠梗阻导置入缓解肠梗阻,完善肠道准备,择期手术切除原发灶。2)肝胆外科会诊:考虑患者乙状结肠癌肠梗阻保守治疗无效,拟开腹探查及急诊手术,根据后续是否可能肝转移继续缩小评估肝转移灶处理方式。3)内镜中心会诊:考虑患者肠梗阻保守治疗效果不佳,优先考虑梗阻部位肠道支架置入,如置入困难或术中穿孔,考虑紧急急诊手术干预。最终综合考虑患者肠梗阻病因、急诊手术风险、肠道支架置入及择期手术的可能获益,决定先置入肠道支架,支架置入解决了原发灶肠壁狭窄,缓解了肠梗阻。但同时由于患者常规药物治疗方案及治疗偏心性生长。治疗过程中时刻警惕肠道穿孔及手术急诊干预。支持治疗的顺利,促进了后续降乙结肠原发灶的顺利切除。
30%~80%恶性肿瘤患者存在营养风险[16]。恶性肠梗阻的治疗,营养科的参与非常重要,特别是患者在接受恶性肿瘤、肠根阻、手术等事件的连续打击时。营养支持的目的主要是维持或恢复患者的营养,纠正或预防营养不良。营养筛查主要是通过NRS-2002 量表评定患者的营养风险。≥3 分则存在营养风险并需要制定营养治疗计划,并根据患者一般状况及条件实施营养干预[16]。全PN 在肠梗阻期及手术期是必要的,为患者提供必需的能量,但长时间的PN 对患者不利,在患者梗阻缓解或手术实施后,根据患者一般情况逐步过渡至肠内营养、半流食为主,肠外营养为辅,最后至仅需补充口服营养剂,实现营养支持的全过程[17]。另外补液量对患者尤其是老年患者要适中,过多补液容易造成肠壁水肿及心脏负荷量过重。患者在肠梗阻及手术事件时期,较容易出现低白蛋白,因此需要适当补充蛋白胶体液。肿瘤患者易出现恶液质,影响患者常规治疗决策及获益,患者一般状况较好的情况下,更能够耐受抗肿瘤治疗相关的不良反应。
综上所述,恶性肿瘤肠管肠梗阻发病几率大,严重影响抗肿瘤治疗及患者生存质量,晚期转移患者以姑息支持治疗为主,手术切除需要多学科全面评估可能性及获益。现有临床证据支持肠道支架植入可以作为恶性肠梗阻姑息治疗一线的选择,但综合评估适应症及可行性十分重要。包括解决肠梗阻在内的抗肿瘤治疗全程,营养支持均发挥重要作用。

