和厚朴酚对心肌缺血再灌注损伤小鼠SIRT1/FOXO1通路的影响
马静,路胜昔,景风梅,夏莉
缺血性心脏病是心血管疾病死亡的重要原因,治疗手段目前主要是恢复缺血区心肌的血液供应,冠状动脉(冠脉)复灌后,可能会进一步加重组织损伤,即出现心肌缺血再灌注损伤(I/R)[1-3]。探究心肌I/R损伤的发病机制,探索如何减少心肌 I/R损伤具有重要的临床意义[4]。研究发现,心肌I/R损伤的发病机制涉及氧自由基生成过多、细胞内钙超载、炎性反应等[4]。和厚朴酚(honokiol,HKL)提取自玉兰属植物,HKL通过激活沉默信息调节因子1(SIRT1)/叉头状转录因子1(FOXO1)信号通路,抑制脑组织炎症损伤和凋亡水平[5]。另有研究发现,HKL可改善甚至逆转心肌肥大[6],HKL通过激活SIRT1,缓解糖尿病状态下心肌缺血再灌注损伤[7]。据此推测,HKL可能通过激活SIRT1/FOXO1自噬通路,抑制缺血再灌注损伤心肌细胞的凋亡和炎症发生。研究通过制备心肌缺血再灌注损伤小鼠模型,探究HKL对心肌缺血再灌注损伤小鼠的保护作用,探讨其对SIRT1/FOXO1通路的作用,现报道如下。
1 材料和方法
1.1 实验材料C57BL6小鼠100只,3~6周龄体重20~30 g,北京生命科学研究所动物实验中心提供,合格证号SYXK(京)2015-0002。小鼠均自由摄食饮水,自然光照,恒温25℃,湿度60%,通风良好。本研究经当地动物伦理委员会批准同意。和厚朴酚(天津制药集团有限公司,货号42612);SIRT1 特异性抑制剂(EX527,美国Sigma-Aldrich公司,货号E7034);β-actin抗体(美国Cell Signaling Technology公司,货号:4970);SIRT1抗体(美国Abcam 公司,货号:M1689);小鼠白细胞介素-1β(IL-1β)和肿瘤坏死因子(TNF-α)ELISA检测试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号:20181235);Ac-FOXO1(美国Santa Cruz Biotechnology公司,货号:sc-49437)抗体;HE染色试剂盒(上海碧云天公司,货号:C0105)、RIPA裂解液(上海碧云天公司,货号:P00145)、BCA试剂盒(上海碧云天公司,货号:P0011)。BL-420F生物信号采集与分析系统购自成都泰盟软件有限公司;1659001蛋白电泳仪、Trans-Blot SD半干转膜仪、GelDocEZ凝胶成像系统购自美国Bio-Rad公司。
1.2 方法
1.2.1 动物造模及给药C57BL6小鼠随机分为5组:假手术(Sham)组、模型组(MI/RI)组、和厚朴酚(HKL)组、EX527+和厚朴酚(HKL+EX527)组和EX527组,每组各20只。除假手术组外,其余各组均进行心肌缺血再灌注损伤造模,具体步骤参照文献[8]。小鼠术前禁食12 h,经10%戊氯甲烷(0.1 ml/100 g腹腔注射)麻醉后,仰卧固定,于颈部正中2 cm作切口,分离肌肉制作气管插管,连接呼吸机辅助呼吸,参数设定为潮气量2~3 ml,吸入氧浓度为50%,呼吸频率为60~70次/min。在胸骨正中左侧纵向切口约2 cm,剪断第3~4肋骨,扩胸器迅速撑开胸部,并于左心耳与动脉圆锥交界下方2 mm处活结结扎前降支,当供血区域颜色变暗和ST段抬高时,表明缺血模型制备成功。缺血45 min后,打开活结,关闭胸腔,使心肌再灌注,以ST段逐渐恢复正常作为再灌注模型成功的标志。假手术组仅开胸,于小鼠左前降支根部穿线但不结扎。参照文献[5]给药,MI/RI组以生理盐水腹腔注射给药;HKL组于再灌注前15 min腹腔注射给予HKL 0.2 mg/kg;EX527组于缺血再灌注前20 min腹腔注射EX527 5 mg/mg;HKL+EX527组于再灌注前20 min腹腔同时注射给予HKL 0.2 mg/kg和EX527 5 mg/mg。
1.2.2 心肌组织含水量测定灌注3 h后,每组分别随机选取10只小鼠,麻醉处死后快速摘除小鼠心脏,清除血迹,称量心脏组织湿重,将心脏组织样品在105℃烘箱中干燥48 h,直到心脏组织重量恒定。心脏组织水含水量=[(湿重-干重)/湿重]×100%。
1.2.3 HE染色观察小鼠组织病理学变化灌注3 h后,将各组剩余10只小鼠麻醉处死,快速摘除心脏置于冰上,轻轻按压排出心脏内血液,在距心尖2 mm处沿横向将其切开,部分心脏组织于-80℃保存;其余放入组织固定液(4%多聚甲醛溶液)室温固定72 h。固定后,将组织依次质量分数为100%、95%、85%、75%的乙醇溶液中分别脱水5 min;蒸馏水冲洗后,一部分采用二甲苯透明处理,石蜡包埋后制成组织切片备用,另一部分采用苏木素染色10 min,置于1%盐酸5 s后,蒸馏水冲洗。滴加伊红染液复染5 min,在不同浓度的乙醇溶液中脱水2 min,加入二甲苯进行透明处理,滴加中性树脂封片,置于光学显微镜下进行观察。
1.2.4 ELISA法检测心肌组织细胞中炎性因子IL-1β和TNF-α表达量取1.2.3项下冷冻心肌组织样品,在50 mM Tris缓冲液中匀浆,4℃以12 000 r/min离心10 min,按照试剂盒说明书的要求,使用ELISA试剂盒测定小鼠心肌组织中的炎性细胞因子TNF-α和IL-1β的浓度。
1.2.5 Western blot法检测心肌组织蛋白印迹表达量取1.2.3项下冷冻心肌组织样品,在50 mM Tris缓冲液中匀浆,12 000r/min 4°C离心10 min,使用以牛血清白蛋白为标准品的Micro BCA蛋白测定试剂盒,测定上清液中的蛋白质浓度。将总蛋白(50 μg)进行10%~12%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳,并转移到聚偏二氟乙烯膜上(PVDF),用5%脱脂奶粉对PVDF膜封闭2 h,以稀释后的SIRT1(1∶1000)、Ac-FOXO1(1∶500)一抗4℃孵育过夜,TBST洗膜后二抗室温孵育1.5 h,再用TBST洗膜后按照ECL 试剂盒说明书配置发光液,并将PVDF膜浸入发光液中反应0.5 min,用Bio Rad成像系统检测蛋白灰度信号,以β-actin为内参,用Image J软件定量分析蛋白表达情况。
1.2.6 TUNEL法检测心肌组织中细胞凋亡情况将1.2.3项下制备好的心肌组织石蜡切片,用二甲苯及各梯度酒精脱蜡至水,使用无菌蒸馏水水化5 min后,用0.1 mol/L枸橼酸缓冲液(PH 6.0)中进行热修复,分别经过3%H2O2甲醇液、0.1%Triton X-100、20%牛血清、TUNEL 反应混合液、POD转化剂孵育及PBS冲洗后,DAB溶液显色,并在显微镜下观察,终止后用迈耶苏木精染核,PBS冲洗后,甘油封片剂封片,显微镜下观察并拍摄图像。
1.3 统计学分析数据均采用SPSS 22.0软件进行统计,计量资料以(±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 和厚朴酚对各组小鼠心肌组织含水量影响与Sham组小鼠相比,MI/RI组、EX527+HKL组、EX527组小鼠心肌组织内水含量均明显增加(P<0.05)。与MI/RI组比较,HKL组小鼠心肌组织内水含量明显降低(P<0.05);EX527组小鼠心肌组织内水含量明显增加(P<0.05)。与HKL组比较,EX527组、EX527+HKL组小鼠心肌组织水含量均明显增加(P<0.05)。与EX527组比较,EX527+HKL组心肌组织内水含量明显降低(P<0.05),表1。
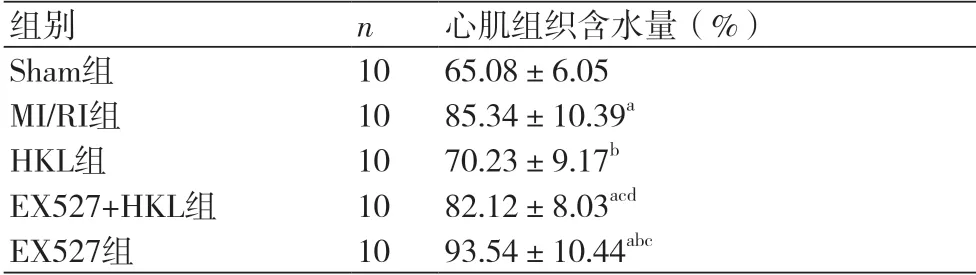
表1 和厚朴酚对缺血再灌注心肌组织中含水量的影响
2.2 和厚朴酚对各组小鼠心肌组织病理变化的影响Sham组小鼠心肌细胞排列整齐,结构完整,无病变特征。与sham组比较,MI/RI、EX527+HKL组、EX527组小鼠心肌细胞排列紊乱,心肌坏死严重,结构损伤严重,且炎症细胞大量浸润。与MI/RI组相比,HKL组小鼠上述病理损伤减轻,EX527组小鼠上述病理损伤加重。与HKL组比较,EX527组及EX527+HKL组上述病理损伤加重。与EX527组比较,EX527+HKL组小鼠心肌组织上述病理损伤减轻(图1)。
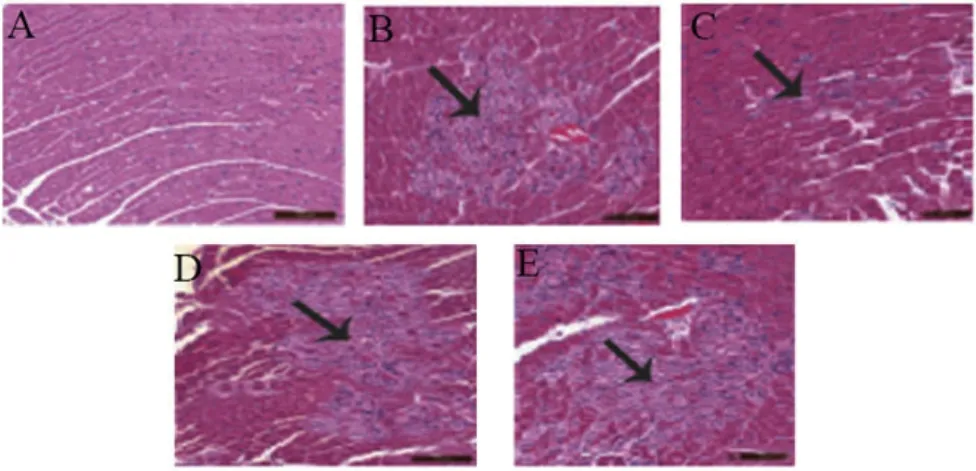
图1 小鼠心肌组织病理变化比较(HE染色,×100)
2.3 和厚朴酚对各组小鼠心肌细胞凋亡的影响与Sham组比较,MI/RI组EX527组、EX527+HKL小鼠心肌细胞凋亡率显著增加(P<0.05)。与MI/RI组比较,HKL组小鼠心肌细胞凋亡率显著减少(P<0.05),Ex527组小鼠心肌细胞凋亡率显著增加(P<0.05)。与HKL组比较,EX527组、EX527+HKL组小鼠心肌细胞凋亡率显著增加(P<0.05)。与EX527组比较,EX527+HKL组小鼠心肌细胞凋亡率减少(P<0.05),见图2,表2。
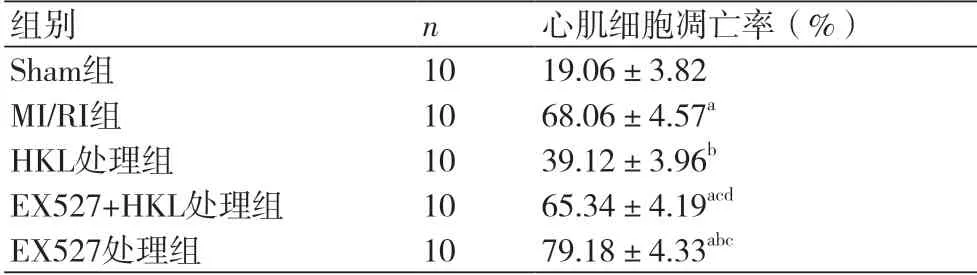
表2 各组小鼠心肌细胞凋亡率比较

图2 各组小鼠心肌细胞凋亡水平比较(TUNEL检测 ×200)
2.4 和厚朴酚对各组小鼠心肌组织中SIRT1/FOXO1蛋白表达的影响与Shame相比,MI/RI组小鼠心肌组织中SIRT1蛋白表达降低(P<0.05),Ac-FOXO1蛋白表达升高(P<0.05)。与MI/RI组相比,HKL组小鼠心肌组织 SIRT1 蛋白表达升高(P<0.05),Ac-FOXO1蛋白表达降低(P<0.05);EX527组小鼠心肌组织SIRT1蛋白表达降低(P<0.05),Ac-FOXO1升高(P<0.05)。与HKL组相比,HKL+EX527组、EX527组小鼠心肌组织SIRT1蛋白表达降低(P<0.05),Ac-FOXO1升高。与EX527组比较,HKL+EX527组小鼠心肌组织SIRT1蛋白表达升高(P<0.05),Ac-FOXO1蛋白表达降低(P<0.05),见图3,表3。

图3 小鼠心肌组织中SIRT1、Ac-FOXO1蛋白表达免疫印迹图
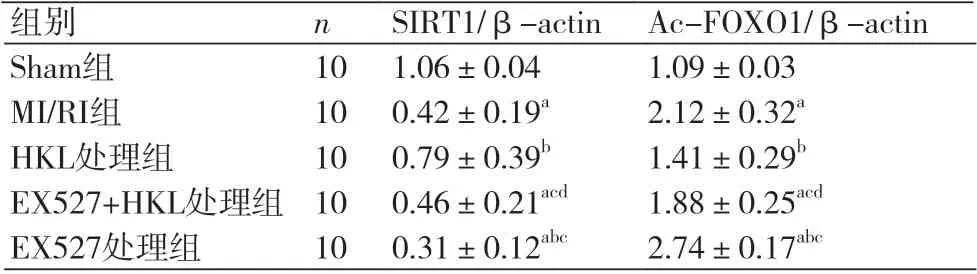
表3 和厚朴酚对各组小鼠心肌组织中 SIRT1 、Ac-FOXO1信号表达的影响
2.5 和厚朴酚对心肌缺血再灌注损伤小鼠心肌组织中IL-1β、TNF-α水平的影响与Sham组比较,MI/RI组小鼠心肌组织中IL-1β、TNF-α水平明显增高(P<0.05)。与MI/RI组比较,HKL组小鼠心肌组织IL-1β、TNF-α水平降低(P<0.05);EX527组小鼠心肌组织 IL-1β、TNF-α水平明显增高(P<0.05)。与HKL组比较,HKL+EX527组、EX527组小鼠心肌组织IL-1β、TNF-α水平明显增加(P<0.05);与EX527组比较,HKL+EX527组小鼠心肌组织IL-1β、TNF-α水平明显降低(P<0.05),表4。

表4 和厚朴酚对缺血再灌注心肌组织中炎症水平表达的影响
3 讨论
心肌缺血再灌注损伤,会导致心肌细胞凋亡、炎症反应加重、心肌坏死加重,探究缺血再灌注损伤分子机制,寻找新的有效的治疗药物是目前的重要任务[9,10]。和厚朴酚是中药材中天然、安全的“靶向”药物[6]。近年动物实验发现和厚朴酚对缺血再灌注损伤组织有保护作用,可减轻心室重构[11,12],本研究建立心肌缺血再灌注损伤小鼠模型,给予和厚朴酚、SIRT1抑制剂EX520处理,探究和厚朴酚减轻缺血再灌注心肌损伤的分子机制。
心肌缺血再灌注与多种炎症因子密切相关,心肌应激刺激心肌细胞和巨噬细胞释放 TNF-α,诱导心肌细胞凋亡和炎症反应,加重再灌注损伤[13];心肌缺血再灌注损伤也与细胞凋亡关系密切,缺血再灌注损伤会加重心肌细胞凋亡,而细胞的凋亡受特定基因调控,冠脉搭桥手术病人中,IL-1β的表达水平增高,将诱导心肌细胞的凋亡,从而加重缺血再灌注损伤[14,15]。本研究发现,小鼠缺血再灌注损伤后,心肌组织细胞损伤严重、凋亡增加、含水量增大、炎性因子水平增多,给予和厚朴酚治疗后,心肌组织细胞损伤缓解、凋亡率、含水量、炎性因子水平均相应减少,表明和厚朴酚可缓解心肌缺血再灌注损伤小鼠心肌细胞的凋亡和炎症损伤。与HKL组相比,HKL+EX527组小鼠心肌细胞损伤加剧、凋亡率、含水量、炎性因子水平均增加,提示抑制SIRT1可阻断HKL对心肌缺血再灌注损伤小鼠的保护作用。
SIRT1具有显著的心肌保护效应[16],其保护作用依赖于其脱乙酰化活性[14],SIRT1活性的抑制,能显著抑制缺血预处理的保护效应[17,18],研究表明,激活SIRT1可抑制炎症、细胞凋亡和氧化应激,减轻脑缺血再灌注损伤[19-23]。SIRT1特异性抑制剂EX527,可增加凋亡细胞的数量[24]。本研究结果显示,与Sham组相比,MI/RI组小鼠心肌组织SIRT1蛋白表达降低,Ac-FOXO1蛋白表达升高。与MI/RI组相比,HKL组小鼠心肌组织 SIRT1蛋白表达升高,Ac-FOXO1蛋白表达降低,提示和厚朴酚可能通过激活SIRT1/FOXO1通路发挥作用。进一步研究发现,与HKL组相比,HKL+EX527组小鼠心肌组织SIRT1蛋白表达降低,Ac-FOXO1升高,表明抑制SIRT1可逆转HKL对SIRT1/FOXO1通路的激活,提示HKL很可能通过激活SIRT1/FOXO1 通路发挥作用。
综上所述,和厚朴酚可通过激活SIRT1/FOXO1通路,缓解心肌缺血再灌注损伤小鼠心肌组织细胞的凋亡和炎症损伤,这可能为其作用机制之一,为临床心肌缺血再灌注损伤治疗提供一定的参考。但本研究未深入研究和厚朴酚激活SIRT1 减轻心肌组织细胞损伤的复杂信号机制,存在一定不足,将在后续深入研究。

