中等剂量糖皮质激素治疗激素敏感肾病综合征复发患儿的前瞻性随机对照研究
涂娟 陈朝英 耿海云 李华荣 夏华 林媛 林甜甜 孙金山
(首都儿科研究所附属儿童医院肾脏内科,北京 100020)
原发性肾病综合征(primary nephrotic syndrome,PNS)是儿童最常见的肾小球疾病。国外报道儿童肾病综合征年发病率约1.15/10万~16.9/10 万[1],我国资料显示,PNS 约占儿科因泌尿系统疾病住院患儿的21%~31%[2]。糖皮质激素(glucocorticoid,GC) 是 治 疗PNS 的 一 线 用 药。80%~90%的初发PNS 患儿经激素治疗可获完全缓解,为激素敏感肾病综合征(steroid sensitive nephrotic syndrome,SSNS)。但复发现象非常普遍,比例高达76%~93%[1,3]。针对SSNS 复发患儿的治疗主要是调整GC用量重新诱导缓解。然而如何选取剂量,既能尽快诱导缓解、减少以后的复发发生,同时又能尽可能地避免不良反应是一个值得重视的问题。目前,国内外的权威指南推荐的治疗方案均主张GC加量至足量水平诱导缓解,其制定依据均来源于欧美国家的小样本临床研究和专家共识[4-6]。国外有研究报道,SSNS复发患儿接受略低剂量的GC治疗,同样可以使蛋白尿转阴,且并未增加6 个月内复发的风险[7-8]。类似的治疗方案是否适用于中国患儿?亟需相应的临床研究进行验证。
1 资料与方法
1.1 研究对象
选取2017 年11 月至2019 年12 月在首都儿科研究所附属儿童医院肾脏内科住院的临床诊断为SSNS 复发患儿为研究对象。纳入标准:(1)SSNS和复发的诊断标准依据2016 年中华医学会儿科学分会肾脏学组制定的儿童激素敏感、复发/依赖肾病综合征诊治循证指南,SSNS:泼尼松足量[2 mg/(kg·d) 或60 mg/(m2·d)]治疗≤4 周尿蛋白转阴者;复发:连续3 d 的24 h 尿蛋白定量≥50 mg/kg,或晨尿的尿蛋白/肌酐(mg/mg)≥2.0,或晨尿蛋白由阴性转为3+~4+[5-6]。(2)复发时泼尼松剂量<0.75 mg/(kg·d),最大量为20 mg/d(即KDIGO 指南推荐的儿童PNS巩固维持治疗阶段的起始GC剂量[4])。(3)签署知情同意书。排除标准:出现以下情况之一:(1)符合频复发或激素依赖标准。(2)存在GC 应用的禁忌证。(3)应用免疫抑制剂,如环磷酰胺、环孢霉素A、他克莫司或吗替麦考酚酯等。样本量计算:参考文献[7-10]报道,设定复发患儿GC 加量治疗后总有效率为95%,允许误差为15%,令α=0.05,计算得每组样本量为32例。
本研究经首都儿科研究所医学伦理委员会批准(SHERLL2017018)。
1.2 研究方法
本研究为单中心、前瞻性临床研究。经纳入排除标准筛选的患儿按入组顺序号查对随机数字表,随机分为2 组,给予不同剂量GC 治疗。中量GC组每日给予泼尼松1 mg/kg晨起顿服(最大剂量≤30 mg/d),至尿蛋白转阴后维持1 周,而后减量至泼尼松1.5 mg/kg隔日晨起顿服,维持4周,以后每2~4周减量至2.5~5 mg/隔日剂量,至停药。足量GC组每日给予泼尼松2 mg/kg晨起顿服(最大剂量≤60 mg/d),至尿蛋白连续转阴3 d后改为1.5 mg/kg隔日晨起顿服,维持4 周,以后每2~4 周减量至2.5~5 mg/隔日剂量,至停药。患儿随访6 个月以上,监测身高、体重及有无Cushing 面容、痤疮、多毛等GC不良反应,并绘制生长曲线[9],以及行尿常规或尿蛋白定量。终点事件包括:(1)调整GC 剂量后14 d,尿蛋白仍为中度以上蛋白尿,即24 h尿蛋白定量>25 mg/(kg·d)或多次监测晨尿蛋白>2+[8,11]。(2)调整GC剂量后4周,尿蛋白仍未转阴。(3)诱导缓解过程中,出现浮肿明显加重或血浆白蛋白水平进行性下降。(4)随访过程中出现复发。
1.3 统计学分析
应用SPSS 15.0统计软件对数据进行分析处理。符合正态分布的计量资料,以均数±标准差(±s)表示,两组间比较采用两样本t检验;不符合正态分布的计量资料,以中位数(四分位数间距)[M(P25,P75)]表示,两组间比较采用秩和检验;计数资料采用百分率(%)表示,两组间比较采用卡方检验或Fisher 确切概率法。应用Kaplan-Meier 生存曲线分析不同GC 治疗方案下尿蛋白持续阴性的情况。应用logistic 回归分析确定随访6 个月内SSNS 复发的危险因素。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料
共纳入SSNS复发患儿67例,其中男49例,女18例,男女比例为2.7∶1;年龄1.5~16.8岁,平均年龄(6±4)岁;PNS病程3~102个月,中位病程20(9,35)个月;随访时间6~23个月。起病时临床分型肾炎型8 例,单纯型59 例,其中肾炎型患儿依据病史、体查和辅助检查,已除外遗传、代谢、风湿性疾病及感染、药物、中毒等继发因素。入组时尿蛋白定量为51.3~216.5 mg/(kg·d),16例患儿伴有浮肿,当时泼尼松口服剂量为0~20 mg/d。所有患儿均无Cushing 貌、多毛、痤疮等GC 不良反应。随机分组后中量GC 组32 例,足量GC 组35例,两组患儿的性别、年龄和相关临床指标比较差异无统计学意义(P>0.05)。见表1。

表1 中量GC组与足量GC组基线资料的比较
2.2 两种治疗方案对蛋白尿诱导缓解的影响
在接受GC 加量治疗4 周内,中量GC 组91%(29/32)转阴,足量GC 组94%(33/35)转阴,两组比较差异无统计学意义(χ2=0.011,P=0.917)。接受两种治疗方案的患儿达到诱导缓解的时间分别为9(4,13)d 和7(6,10)d,两组比较差异无统计学意义(Z=-0.561,P=0.576)。5 例患儿在诱导缓解期出现终点事件退出研究,其中1例为浮肿加重(中量GC组),4例(中量GC组、足量GC组各2例)为14 d内尿蛋白仍明显异常(不伴感染等特殊原因),这5例患儿GC初治时尿蛋白转阴的时间是7~18 d。
2.3 两种治疗方案对尿蛋白维持阴性的影响
对GC加量治疗后获得诱导缓解的62例患儿随访至6 个月,中量GC 组患儿复发比例为41%(12/29),足量GC组患儿复发比例为36%(12/33)。应用Kaplan-Meier生存曲线分析两组尿蛋白维持阴性的情况,log-rank 检验结果显示,两种治疗方案对SSNS 患儿治疗后尿蛋白阴性维持效果的比较差异无统计学意义(χ2=0.005,P=0.942),见图1。
2.4 两种GC治疗方案相关不良反应
对于完成6 个月随访并未出现终点事件的38例患儿分析其GC 相关不良反应出现情况,结果见表2。
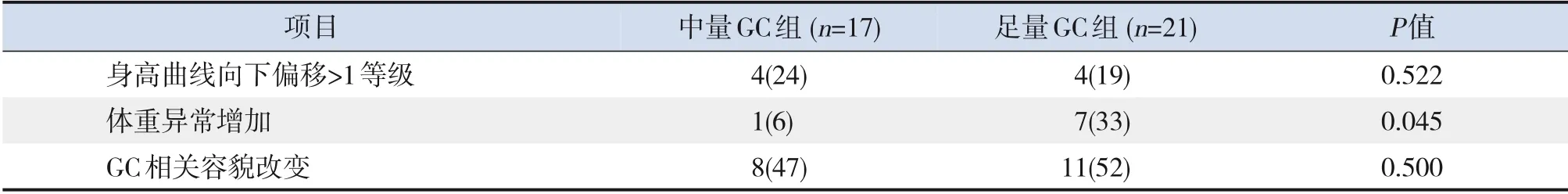
表2 中量GC组与足量GC组出现GC相关不良反应情况比较 [例(%)]
通过动态分析身高生长曲线至随访6个月,中量组24%患儿的身高曲线向下偏移1 个等级以上[12],与足量组(19%)比较,差异无统计学意义(P>0.05)。
监测患儿体重生长曲线,并计算体重指数至随访6 个月,如果患儿体重指数符合超重标准(>同年龄同性别第85百分位数),且体重的生长曲线较前向上偏离1个等级以上,则判定存在体重异常增加[13]。结果显示中量组6%患儿出现体重异常增加,显著低于足量组(33%,P<0.05)。
中量组出现GC 相关容貌改变占47%,与足量组(52%)比较,差异无统计学意义(P>0.05)。
2.5 两种治疗方案GC的6个月累积量比较
对完成6个月随访并未出现终点事件的38例患儿,计算其随访至6 个月时GC 的累积量,结果显示,中量组患儿泼尼松累积量为(87±18)mg/kg,显著低于足量组患儿[(98±16) mg/kg](t=2.145,P=0.039)。
2.6 随访6个月内复发的危险因素
对GC 加量治疗后获得诱导缓解的62 例患儿,以随访6 个月是否复发为因变量,以入组时GC 剂量水平(泼尼松≥10 mg/隔日、泼尼松<10 mg/隔日)、24 h 尿 蛋 白 定 量 水 平[≥100 mg/(kg·d)、<100 mg/(kg·d)]、年龄(≥6 岁、<6 岁)、既往复发情况(复发、未复发)、病初临床分型(单纯型、肾炎型)和治疗分组(中量GC 组、足量GC 组)为自变量,进行logistic 回归分析,结果显示,入组时泼尼松剂量≥10 mg/隔日,是随访6 个月内SSNS患儿复发的危险因素(P=0.018),见表3。

表3 SSNS患儿随访6个月内复发危险因素的logistic分析
3 讨论
从上世纪50 年代开始,GC 用来治疗儿童PNS,到目前为止,GC 一直是治疗PNS 的一线用药。儿童PNS的病死率也因GC的有效应用从最初的40%显著下降至现在的3%[14-15]。然而,GC相关不良反应也逐渐被认识和关注,如生长迟缓、肥胖、皮肤面容改变、继发感染、骨质改变、代谢异常、眼部受累和心理行为异常等。因此,寻找适宜的GC治疗方案,既发挥药物的治疗效应,又减少相关不良反应的发生,一直是临床医生探索的目标。复发在PNS 患儿中十分常见,仅有不到一半的SSNS 患儿可以维持3 年以上的完全缓解,甚至40%在儿童期发病的SSNS 患者其复发可以持续至成人期[16]。对于非频繁复发或激素依赖的肾病综合征复发病例,尤其是GC减量至较小剂量水平时,GC 加量应用仍是主要的治疗手段,如何调整GC用量是治疗的重点和难点。应用中小剂量GC诱导缓解的方案在国内有所报道,但其疗效和安全性与国内外指南推荐的足量方案是否存在差异,需要相关的随机对照临床研究进行验证。
本研究显示,对于GC减量至较小剂量时复发的SSNS 患儿,给予中等剂量GC [泼尼松1 mg/(kg·d)]治疗,其缓解率及缓解所需时间较指南推荐方案[5](足量GC)无显著性差异。目前,业内广泛认可的KDIGO 指南[4]和中华医学会儿科分会肾脏病学组的诊治循证指南[5]均推荐PNS 复发后,每日给予泼尼松2 mg/(kg·d)口服,至尿蛋白转阴后3 d,泼尼松改为1.5 mg/kg 隔日口服,维持4 周,而后用4 周以上的时间将GC 减停。2016 年英国学者提出略低剂量泼尼松治疗PNS复发患儿,该研究观察了50 例PNS 患儿,先后发生87 次复发,复发后均每日给予泼尼松1 mg/(kg·d),口服至尿蛋白转阴,且≥7 d,而后用4周以上的时间将GC减停,结果显示70%患儿于7 d 后尿蛋白转阴,77%患儿于10 d 内转阴[7]。随后,Borovitz 等[8]对30 例GC 停药期间复发的SSNS 患儿进行了随机对照研究,将纳入病例随机分为3组,分别每日给予泼尼松1 mg/(kg·d)、1.5 mg/(kg·d)和2 mg/(kg·d)诱导缓解治疗,而后GC改为隔日口服,逐渐减量8~12周停药;结果发现接受每日泼尼松1 mg/(kg·d)治疗的患儿89% (8/9) 完全缓解,所需时间为(9.0±3.3)d,较其他两组没有显著差异。因此,对于较低剂量GC应用期间出现的复发,中等剂量GC治疗方案诱导缓解的效果是肯定的。
对于SSNS 复发患儿,维持较长时间的尿蛋白阴性也是治疗的重要目标。多项研究表明,初次发病的SSNS 患儿,接受足量、足够疗程的GC 治疗,可以有效减少以后复发的次数。本研究中提到的中量GC 治疗方案,在复发患儿获得缓解后,泼尼松1 mg/(kg·d)的剂量维持1 周时间,再减为1.5 mg/kg 隔日口服4 周,而后再逐渐减停,其6 个月内复发情况与标准的足量治疗方案没有显著差异。Borovitz 等[8]的 数 据 显 示,应 用 泼 尼 松1 mg/(kg·d)起始剂量治疗的患儿,随访3 个月维持缓解的比例为44%。相比之下,本研究中中量组患儿6 个月维持缓解的比例(59%)明显优于文献[8]报道,考虑与本方案GC减量相对平缓,维持时间较长有关。本研究通过logistic 回归分析了通过GC 加量治疗后获得缓解的患儿6 个月内出现复发的危险因素,发现与泼尼松加量治疗前的使用剂量有关,当入组时泼尼松剂量≥10 mg/隔日时,6个月内出现复发的优势比为4.576,与这部分患儿随访至6 个月时GC 减量常常低于既往复发时的剂量水平有关。
随着SSNS预后有了明显改善,GC相关的不良反应越来越受到患儿和家长的关注。尤其是肥胖、矮小和GC相关容貌改变会对患儿的情绪心理带来极大的影响,严重影响患儿身心健康和生活质量[16-17]。研究表明GC相关不良反应与用药剂量和用药时间有关,其与用药剂量的关系可表现为线性,即随剂量增加成比例增加,也可呈现阈值模式,即超过一定阈值后不良反应发生率显著升高。因此大剂量GC 治疗时,相关不良反应更明显[18-19]。本研究显示,中量GC组患儿出现体重异常增加的比例较小,与中量组患儿GC应用的起始剂量和累积量均少于足量组有关。而身高和容貌改变情况在两组患儿中的差异不大,一方面与随访时间短、病例数有限有关,另外也有文献[18]报道,在接受较低剂量的GC治疗时就可发生Cushing貌和矮小。因此,中量GC组也有可能出现相应不良反应。
综上所述,本研究显示对于较低GC剂量复发的PNS 患儿,应用中等剂量GC 治疗方案[1 mg/(kg·d)],其诱导缓解率、6 个月内复发率较标准方案(足量GC)无显著差异,而累积剂量和GC 相关不良反应较小,值得临床探索应用。但本研究病例数较少,仍需较大样本、多中心的数据进一步验证。

