直播稻金粳818成熟胚遗传转化体系的建立
李军玲 张红磊 张融雪 蔡昱萌 汪颖 佟卉 刘燕清 苏京平


摘要 [目的]建立高效的金粳818成熟胚遗传转化体系。[方法]以直播稻品种金粳818成熟胚为外植体,设计4种诱导培养基,筛选适合金粳818的诱导条件;设计5种分化培养基,筛选适合金粳818的分化条件;获得的愈伤组织用农杆菌介导法进行转基因再生。[结果]最佳诱导培养基为4.10 g/L NB+2 mg/L 2,4-D,诱导率为89.3%;最佳分化培养基为MS+5.0 mg/L KT+0.5 mg/L NAA,分化率为81.1%,成苗率为52.1%;经PCR分子检测,再生幼苗100%为转基因阳性植株。[结论]该研究建立了金粳818成熟胚遗传转化体系,为品种定向改良奠定了技术基础。
关键词 金粳818;成熟胚;愈伤组织;遗传转化
中图分类号 S 511 文献标识码 A 文章编号 0517-6611(2022)09-0100-04
doi:10.3969/j.issn.0517-6611.2022.09.024
开放科学(资源服务)标识码(OSID):
Establishment of Genetic Transformation System of Mature Embryo of Direct Seeding Japonica Rice Variety Jingeng 818
LI Jun-ling, ZHANG Hong-lei, ZHANG Rong-xue et al
(Crop Research Institute, Tianjin Academy of Agricultural Sciences, Tianjin Key Laboratory of Crop Genetics and Breeding, Tianjin 300384)
Abstract [Objective]To establish an efficient genetic transformation system of Jingeng 818. [Method]Using the mature embryo of direct seeding rice variety Jingeng 818 as explant, four induction medium schemes were designed to obtain the suitable induction conditions of Jingeng 818;five kinds of differentiation medium were designed to obtain the suitable differentiation condition for Jingeng 818; and the obtained callus was used to establish the transgenic regeneration system by agrobacterium mediated method. [Result]The results showed that the best induction medium was 4.10 g/L NB+2 mg/L 2,4-D with the induction rate 89.3%. The best differentiation medium was MS+5.0 mg/L KT + 0.5 mg/L NAA with the differentiation rate 82.1% and the seedling rate 52.1%. By PCR molecular detection, 100% of the regenerated seedlings were transgenic positive plants.[Conclusion] In this study, the genetic transformation system of mature embryo of Jingeng 818 was established, which laid a technical foundation for directional improvement of varieties.
Key words Jingeng 818;Mature embryo;Callus;Genetic transformation
水稻是我國第一大口粮作物,水稻生产事关国家口粮安全。稻田杂草防除是生产中的棘手问题,由于禾本科杂草、杂草稻等与水稻亲缘关系较近,常规除草剂对其无效,培育具有除草剂抗性水稻品种能较好地解决稻田草害问题。金粳818是天津市水稻研究所选育的具有除草剂抗性的粳型常规水稻品种,为采用生物技术手段对金粳818进行改良而培育的新种质,可为除草剂抗性水稻提供新材料,其遗传转化体系的建立尤为重要。
利用愈伤组织再生体系进行水稻遗传转化是最广泛应用的方法之一,具有明显优点,如外植体来源广泛、周期短、易于转化、转化效率高等[1];农杆菌介导法是水稻遗传转化首选方法,具有易操作、低拷贝、基因沉默少、遗传稳定等诸多优势[2]。相比籼稻而言,粳稻愈伤诱导率和分化再生率较高,不少粳稻品种的组织培养再生体系已经建立且转基因体系成熟,如日本晴、中花11、秀水134等[3-7]。影响水稻愈伤组织诱导率、分化率和再生率的主要因素是基因型[8],而品种间基因型的差异导致尚缺乏统一的配方适合所有品种。笔者以成熟胚为外植体,设计了4种不同诱导培养基摸索适宜诱导条件,设计5种分化培养基,利用获得的愈伤组织以农杆菌介导法进行转基因再生,建立高效的金粳818成熟胚遗传转化体系,为利用生物技术定向改良奠定基础。
1 材料与方法
1.1 材料
以天津市水稻研究所自主育成的金粳818成熟胚为外植体。含有pCAMBIA1301质粒的EHA105农杆菌由天津市农作物遗传育种重点实验室保存。培养基NB(货号N492)和MS(货号M519)及激素均购自Phytotechnology。
1.2 培养基
1.2.1 诱导培养基。基础培养基+0.5 g/L L-脯氨酸+0.5 g/L谷氨酰胺+0.3 g/L水解酪蛋白+30 g/L蔗糖+3.5 g/L 植物凝胶+2,4-D(表1),调节pH为5.8。
1.2.2 筛选培养基。4.1 g/L NB+0.5 g/L L-脯氨酸+0.5 g/L谷氨酰胺+0.3 g/L 水解酪蛋白+30 g/L蔗糖+3.5 g/L 植物凝胶+2 mg/L 2,4-D+40 μg/L潮霉素+400 μg/L青霉素,调节pH为5.8。
1.2.3 分化培养基。4.43 g/L MS+0.5 g/L L-脯氨酸+0.5 g/L谷氨酰胺+0.3 g/L 水解酪蛋白+0.1 g/L 肌醇+30 g/L 山梨醇+30 g/L蔗糖+3.5 g/L 植物凝胶+30 μg/L潮霉素+300 μg/L青霉素+不同激素组合(表2),调节pH为5.8。
1.2.4 生根培养基。2.215 g/L MS+30 g/L蔗糖+3.5 g/L植物凝膠+20 μg/L潮霉素+200 μg/L青霉素,调节pH为5.8。
1.2.5 AAM侵染液。4.1 g/L NB+68 g/L蔗糖+36 g/L 葡萄糖+0.5 g/L水解酪蛋白+0.5 g/L L-脯氨酸+0.5 g/L L-谷氨酰胺+177 mg/L L-精氨酸+7.5 mg/L甘氨酸+300 mg/L L-天冬氨酸+2.5 mg/L 2,4-D,调节pH为5.2,使用前加入0.5 mL浓度为20 mg/L乙酰丁香酮。
1.3 方法
1.3.1 金粳818成熟胚愈伤组织诱导。收取当年新的金粳818成熟种子,剥离颖壳,取适量倒入50 mL离心管中,75%乙醇消毒1 min,30%次氯酸钠(有效氯3%)消毒15 min,无菌水冲洗5~6次,去除多余水分,倒入铺有3层灭菌滤纸的培养皿中,无菌风吹干15 min。最后接种到诱导培养基中,每皿25~35粒种子,28 ℃暗培养10 d,在水稻幼芽和成熟胚之间长出淡黄色、结构致密的胚性愈伤组织,掐芽剥离出愈伤后放入新的诱导培养基上3~5 d即可进行转化,诱导10 d后统计诱导率。
诱导率=出愈伤的成熟胚数量/总成熟胚数量×100%
1.3.2
农杆菌培养及浸染。将含有pCAMBIA1301质粒的农杆菌EHA105在YEP(含25 mg/L卡那霉素)固体平板上划线,28 ℃培养2 d。刮取平板上的农杆菌至AAM浸染液中,调整菌体浓度至OD600值为0.3~0.5,获得农杆菌悬浮液。挑取足够数量的愈伤组织放入无菌三角瓶中,加入农杆菌悬浮液,室温放置浸染20 min,并间隔晃动几次,倒掉菌液,将愈伤组织放置无菌滤纸上吸去多余菌液,转移至铺有一层无菌滤纸的固体培养基上,26 ℃黑暗培养3 d。
1.3.3 筛选培养。培养3 d后的愈伤组织,用无菌水清洗2次,用含有500 μg/mL羧苄青霉素的无菌水冲洗1次,吸去多余水分后将愈伤组织转移到无菌滤纸上,晾干,转移至筛选培养基上进行筛选培养,28 ℃,暗培养30 d。
1.3.4 分化再生。筛选30 d后,在原愈伤的底部可见颜色淡黄、结构致密、直径1~2 mm的阳性愈伤长出,挑取阳性愈伤到分化培养基上进行分化再生,培养条件为28 ℃,16 h光照/8 h黑暗培养。15~20 d统计分化率,25~35 d统计成苗率。
分化率=分化的愈伤组织数量/总愈伤组织数量×100%
成苗率=分化的幼苗数量/分化的愈伤组织数量×100%
1.3.5 生根培养及驯化。分化出的幼苗长到2~3 cm有明显根系时,转移到生根培养基上,培养条件28 ℃,16 h光照/8 h黑暗培养。7~10 d后,幼苗长出大量侧根,当小苗长至高10~15 cm时,打开盖子在室外炼苗2~3 d,取出小苗后洗去根部培养基,移栽至土中。
1.3.6 转基因植株鉴定。CTAB法提取幼苗DNA,并用潮霉素基因引物检测植株。
hygF:ACGGTGTCGTCCATCACAGTTTGCC
hygR:TTCCGGAAGTGCTTGACATTGGGGA
2 结果与分析
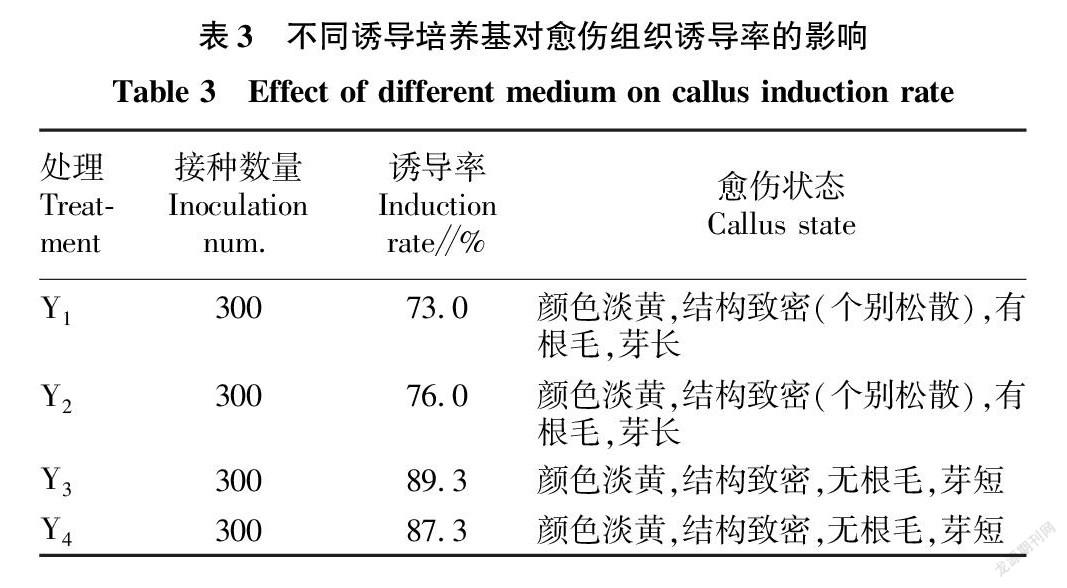
2.1 培养基和2,4-D浓度对愈伤组织诱导的影响
共设计4组诱导培养基,包含2种类型基础培养基和2种浓度2,4-D。试验结果表明,同一激素浓度下,NB培养基的诱导率高于MS培养基的诱导率,即Y3>Y1,Y4>Y2,且愈伤组织状态更好,无明显根毛,芽较短。同一基础培养基条件下,4和2 mg/L 2,4-D对愈伤诱导率差别不大。综上,适宜的诱导培养基为Y3( 4.10 g/L NB+2 mg/L 2,4-D),诱导率为89.3%,且愈伤状态良好(表3和图1)。
2.2 不同浓度KT对愈伤组织分化再生的影响
设计了5种不同KT浓度分化培养基,金粳818愈伤组织在不同KT浓度分化培养基中分化成苗差异明显。试验数据表明,同一浓度NAA条件下,一定范围内KT浓度越高,分化率和成苗率越高,表现为F4>F3>F2>F1,KT浓度升高至6 mg/L,其分化率和成苗率反而有所下降。分化21 d时,F4处理绿点数量最多,个别愈伤组织分化出小苗(图2)。因此,适宜分化培养基激素配比为F4处理,即5 mg/L KT+0.5 mg/L NAA,可使分化率和成苗率分别达到81.1%和52.1%(表4)。
2.3 转基因植株分子鉴定
提取24份再生幼苗基因组DNA作为模板,利用潮霉素基因特异引物进行PCR鉴定,结果表明,所有再生苗均为转基因植株(图3),农杆菌介导的遗传转化成功。
安徽农业科学2022年
2.4 金粳818成熟胚遗传转化完整过程
金粳818成熟胚诱导愈伤需10 d,愈伤继代5 d,转化共培养3 d,筛选30 d,分化30 d,生根约7 d,整体遗传转化过程共计约85 d完成(图4)。
3 结论与讨论
影响水稻愈伤分化和再生的主要因素有基因型、外植体来源、培养基、激素等[8]。水稻基因型是控制愈伤组织诱导率和再生率的主要因素,有研究表明,粳稻的愈伤组织诱导率及分化率明显优于籼稻[9-11]。水稻常用的外植体有花药、幼穗、幼胚及成熟胚,不同组织的愈伤诱导率和分化率不同,但由于花药、幼穗、幼胚等外植体受到生长季节限制,取材不便,从而制约了其可用于遗传转化的数量,而成熟胚则不受限制[12-13]。刘书梅等[14]研究结果表明,MS和NB培养基分别更适合籼稻种胚愈伤和粳稻种胚愈伤的诱导培养,这与该研究结果一致,对金粳818而言,NB培养基诱导的愈伤状态更好。激素種类、浓度和配比是影响愈伤组织诱导、分化再生的重要调控因子,其中2,4-D是诱导胚性愈伤组织必不可少的因子,该研究使用2 mg/L 2,4-D时,可达到较高诱导率;KT和6-BA是愈伤分化常用的细胞分裂素,沈秋平等[15]研究认为KT比6-BA分化效果要好。笔者研究了不同浓度KT对分化成苗率的影响,结果表明,一定范围内KT浓度越高,分化成苗率越高。
综上,该研究以金粳818成熟胚为外植体,设计4种激素配比不同的诱导培养基,将金粳818成熟胚外植体接种在诱导培养基中,10 d后观察愈伤状态并统计每组诱导率,得出适宜诱导培养基为4.10 g/L NB+2 mg/L 2,4-D,诱导率为89.3%;设计5种激素配比不同的分化培养基,将金粳818愈伤组织接种后进行分化培养,统计每组分化率和成苗率,得出适宜分化培养基为MS+5 mg/L KT+0.5 mg/L NAA,其分化率和成苗率分别是81.1%和52.1%;整个遗传转化体系从诱导到幼苗再生共需要85 d。金稻818成熟胚遗传转化体系的建立,为利用生物技术手段定向改良品种奠定了技术基础。
参考文献
[1] 佟清越.粳型水稻遗传转化体系的研究[D].哈尔滨:黑龙江大学,2010.
[2] 彭小群,王梦龙.水稻遗传转化研究进展[J].中国农学通报,2021,37(27):1-5.
[3] 毛建军,杨秀芬,曾洪梅,等.水稻品种日本晴粳稻组培培养基的筛选及转稻瘟菌蛋白激发子基因植株的获得[J].农业生物技术学报,2008,16(5):824-830.
[4] 何少海,姚盛存,丰宇凯,等.农杆菌介导bar基因转化水稻胚性愈伤组织的研究[J].浙江农林大学学报,2017,34(1):129-136.
[5] 曹含章,沈秋平,袁冰,等.3个粳稻品种成熟胚分化和再生适宜激素配比研究[J].杂交水稻,2020,35(4):86-91.
[6] 李素娟,樊秀霞,王华,等.水稻不同品种组培再生和转基因频率研究[J].核农学报,2013,27(12):1817-1827.
[7] 张秀香.水稻成熟种子组织培养体系的优化及建立[J].安徽农学通报,2012,18(12):39-40,42.
[8] 朱克明,陶慧敏,徐硕,等.水稻愈伤分化和再生研究进展[J].种子,2016,35(11):55-59.
[9] ABE T,FUTSUHARA Y.Genotypic variability for callus formation and plant regeneration in rice(Oryza sativa L.)[J].Theor Appl Genet,1986,72(1):3-10.
[10] 王萍,徐大勇,王罡,等.粳籼稻两个亚种成熟胚组织培养与再生能力的比较研究[J].种子,2007,26(10):66-67.
[11] YAN J Q,XUE Q Z,ZHU J.Genetic studies of anther culture ability in rice(Oryza sativa)[J].Plant Cell Tissue Organ Cult,1996,45(3):253-258.
[12] 王秀红,史向远,吴先军.水稻不同外植体培养效果及其相关性分析[J].中国水稻科学,2005,19(2):187-189.
[13] 郑文静,张燕之,王昌华,等.水稻不同外植体组织培养的差异性及其后代变异的研究[J].安徽农业科学,2008,36(4):1368-1370.
[14] 刘书梅,王姗姗,辛晓云,等.不同培养基对水稻胚性愈伤组织诱导及分化的影响[J].生物学杂志,2011,28(4):54-56.
[15] 沈秋平,严孙艺,薛宇彤,等.籼稻9311成熟胚高效再生体系的建立[J].杂交水稻,2019,34(2):49-52.

