脂多糖诱导C57BL/6J小鼠急性炎症对听力损失的影响
徐琪钧 刘秀珍 张肖林 尹晶晶 李长叶 刘雪华 王延飞
1 滨州医学院附属医院耳鼻咽喉头颈外科 山东 滨州 256603;2 滨州医学院附属医院临床医学实验室 山东 滨州 256603
听力损失是世界上排名第四位的致残性疾病[1],世界总人口的6%~8%都有不同程度的听力损失,老年人口中患有听力损失的比例高达70%[2]。听力损失不仅影响人们之间的沟通,而且会造成患者智力、认知水平的下降。有研究表明,年龄相关性听力损失与阿尔兹海默症相关[3]。大多数听力损失为感音神经性听力损失,其病因为耳蜗毛细胞及其神经细胞或血管纹及支持细胞的功能损伤,发病影响因素为耳聋基因的突变、衰老、耳毒性药物的使用、耳蜗慢性感染及噪音暴露等[4]。目前,听力损失具体的机制尚不完全清楚。已有研究表明,氧化应激、线粒体损伤、自噬、内质网应激等可能参与了听力损失的发生;另外,炎症也是听力损失的一种潜在机制,尤其是在年龄相关性、耳蜗慢性感染以及噪音暴露导致的听力损失中占有重要的地位。本研究通过向C57BL/6J 小鼠腹腔注射脂多糖(lipopolysaccharide,LPS)诱发急性炎症反应,观察小鼠的听力变化并分析其相关机制,以便为治疗耳聋提供一个新的思路。
1 材料与方法
1.1 材料
1.1.1 小鼠 30只2月龄C57BL/6J雄性小鼠,体质量为15~18 g,购自济南朋悦实验动物繁育有限公司,饲养于滨州医学院附属医院清洁级动物房,相对湿度为45%~55%,每天光照12 h。本研究所涉及动物实验均获滨州医学院附属医院实验动物伦理委员会批准(伦理编号为20210808-07)。
1.1.2 实验仪器及试剂 SmartEP&OAE听觉诱发电位系统(美国Intelligent Hearing Systems公司);低温高速离心机及高速离心机(德国Eppendorf公司);电子天平称【梅特勒-托利多仪器(上海)有限公司】;微量移液器(德国Eppendorf公司);CX21型普通光学微显镜(日本奥林巴斯公司);酶标仪(美国Thermo Scientific公司);粘附载玻片及显微镜盖玻片(江苏世泰实验器材有限公司);富勒姆超纯水机(青岛富勒姆科技有限公司);苏木素、伊红溶液【上海诺伦生物医药技术公司(IH-017A、IH018A)】;LPS(美国sigma公司,No.为L2880)
1.2 实验方法
1.2.1 小鼠分组及处理 将30只2月龄雄性C57BL/6J小鼠随机分为空白组、LPS组及对照组,每组10只。空白组不加处理,LPS组小鼠以腹腔注射的方式予以2.5 mg/kg的LPS,对照组以相同注射方法输注相等体积的生理盐水。各组的生活条件保持一致。
1.2.2 听性脑干反应(auditory stem response,ABR)测量 造模3、7、15 d后给予小鼠4%水合氯醛麻醉后置于恒温垫上维持体温为37~38℃,分别将记录电极、参考电极及接地电极插入小鼠测试耳后、头顶、对侧耳皮下。SmartEP&OAE听觉诱发电位系统对小鼠进行click、8、16、32 kHz频率刺激,扫描时程为10 ms,叠加1 024次。声强刺激先以80 dB SPL开始,逐渐以10 dB SPL递减,至无明显II波时向上递增5 dB SPL,以II波消失处为ABR阈值。
1.2.3 酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA) 造模3 d后,每组取4只小鼠,摘除眼球取血,室温下静置1 h,以3 000 rpm/min离心10 min备用。从4℃冰箱内取出欣博盛酶联免疫试剂盒在室温下复温20 min,按照说明书配置梯度标准品溶液,依次进行加样、孵育、生物素化抗体结合、孵育、酶结合物结合、孵育、显色、孵育、终止显色等步骤,使用酶标仪测量样本的OD值。
1.2.4 耳蜗冰冻切片HE染色 以上4只小鼠取血后处死,取其右侧耳蜗用4%多聚甲醛溶液(pH值为7.4)4℃固定24 h,EDTA脱钙液脱钙处理7 d后,经OCT包埋剂包埋,常规冰冻切片,切片厚度为5 μm,苏木素-伊红染色,光镜观察。
1.2.5 饮水饮食、体质量测定 在实验前测量小鼠体质量,注射LPS 3、7、15 d后进行体质量和饮水饮食测量,其中饮食饮水需要中间补充,称重。最后饮食饮水进行数量及体质量标准化。

2 结果
2.1 注射LPS(2.5 mg/kg)诱导C57BL/6J小鼠听力损失 空白组、LPS组及对照组实验前初始ABR阈值比较,差异无统计学意义。空白组与对照组在注射3、7、15 d后,在8、16和32 kHz频率下听力无明显变化,差异无统计学意义。与对照组比较,LPS组在注射3 d后在16和32 kHz频率下的听力阈值均明显升高,P<0.05。在注射7 d后两组听力阈值变化趋势和注射3 d后的趋势大致相同,LPS组的听力阈值均升高(16 kHz,P=0.038)和(32 kHz,P=0.046)。在注射15 d后,两组听力阈值比较差异无统计学意义,其余频率下阈值变化不明显(图1)。
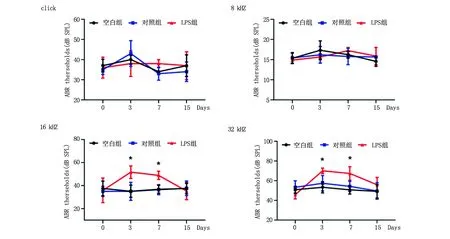
对照组与LPS组比较,*P<0.05。
2.2 注射LPS(2.5 mg/kg)诱发C57BL/6J小鼠急性炎症 LPS组在注射3 d后的听力阈值升高,P<0.05。然后,本研究探测其血清炎症因子变化。本研究运用ELASA方法检测到,LPS组TNF-α,IL-6及NF-κB血清水平均高于对照组,P<0.05,但IL-1β无明显变化(图2)。这说明,注射LPS诱发C57BL/6J小鼠急性炎症,体内炎症因子升高,这可能是造成听力损失的机制之一。

*P<0.05。
2.3 注射LPS(2.5 mg/kg)诱发耳蜗螺旋神经节及血管纹的形态学变化 LPS组在注射3 d后听力阈值升高,P<0.05,且体内血清炎症因子表达升高(图3)。本研究猜测,炎症因子的升高会通过血脑屏障进入耳蜗,从而造成耳蜗组织的某种变化,导致听力损失。于是,本研究对此进行形态学观察发现,LPS组的螺旋神经节细胞缺失,血管纹及螺旋神经节的形态破坏,这可能是急性炎症造成听力损失的原因之一。
2.4 注射LPS不影响小鼠的代谢过程 LPS组在注射3 d后的听力阈值升高。形态学观察发现,LPS组的螺旋神经节细胞缺失,血管纹及螺旋神经节的形态破坏,血管纹空泡化,所以有理由检测小鼠的基本代谢过程,以排除LPS造成机体副作用。本研究发现,LPS不能影响小鼠的饮食、饮水及体质量(图4)。LPS(2.5 mg/kg)剂量可以引发急性炎症,但因为ABR及代谢指标在注射15 d后都趋于正常,所以推断,小鼠在注射15 d后能很快恢复到原始状态。
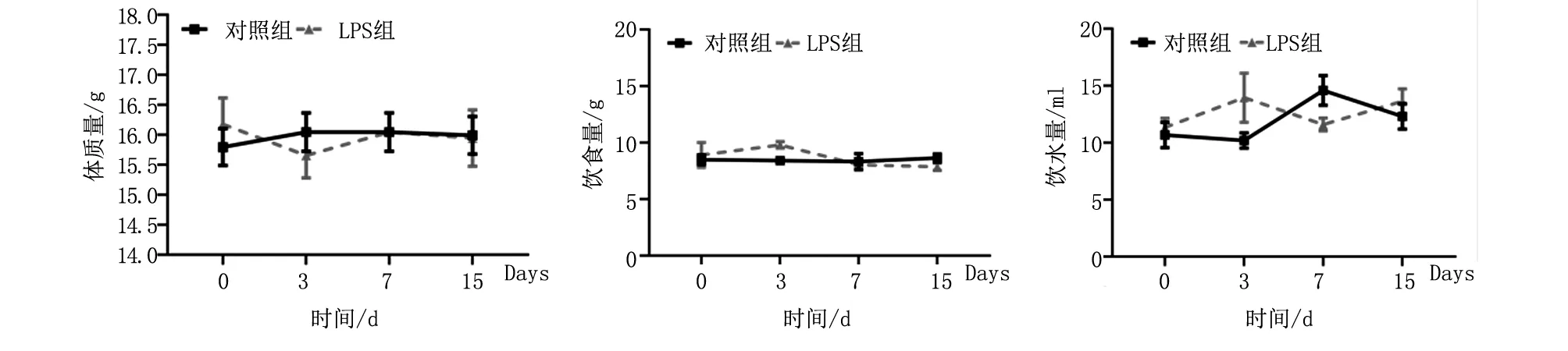
图4 两组在注射LPS 3、7、15 d后的饮水饮食及体质量变化

图3 两组在注射LPS 3 d后的耳蜗组织染色图像
3 讨论
听觉系统是生物体的重要感官之一,其在获得外界声音、语言和听觉技能方面至关重要。听力损失会让患者处于多年的致残状态,与外界交流不便,严重者甚至无法沟通。听力损失的发病率随着年龄的增加而增长[5-6]。其精确的作用机制尚不明确。多种炎性细胞,如巨噬细胞、单核细胞都可以浸润到耳蜗的螺旋韧带与血管纹处,其异常调节可导致听力损失[7-8]。
C57BL/6J近交系小鼠具有进行性感音神经性听力损失的特点,且具有与人类年龄相关性听力损失相似的表观现象,7月龄开始出现耳聋,12月龄可达到中度耳聋,是比较成熟的渐进性听力损失的动物模型之一[9]。2~3月龄是诱导C57BL/6J近交系小鼠炎症及其他模型的最佳时机。
LPS是一种在大多数革兰氏阴性菌的外膜中存在的与致病相关的分子,其可引起强烈的炎症反应,是理想的炎症模型制剂。在对小鼠炎症反应或氧化应激的研究中,LPS的注射剂量由1~100 mg/kg不等,其中使用较多的剂量为1~10 mg/kg,其中因副作用较少,2.5 mg/kg较为普遍[10-11]。这与本研究观察到小鼠的体质量及饮食饮水不受影响相一致。本研究选择C57BL/6J雄性小鼠作为研究对象,以腹腔注射LPS的给药方式,剂量为2.5 mg/kg,诱发雄性小鼠的机体炎症,来了解其对听力的影响。
注射LPS 3、7 d后可以明显造成小鼠听力损失,这可能和机体炎症的发生有很大关系。高频听力损失严重,但低频无明显差异,这与前人的报道[12]一致。高频听力损失治疗困难[13],一般治疗是扩血管,营养神经为主。高频听力损失严重,但低频无明显差异这一结论为临床工作者提供很好的治疗思路,也为聋病患者治疗提供理论依据。LPS组TNFα、IL-6及NF-κB的血清水平明显高于对照组。在众多炎症细胞因子中,起主要作用的是TNF-α 、IL-1β、IL-6等。TNF-α是炎症反应过程中出现最早、最重要的炎性介质,能激活中性粒细胞和淋巴细胞,使血管内皮细胞通透性增加,调节其他组织代谢活性,并促使其他细胞因子的合成和释放。IL-6能诱导B细胞分化和产生抗体,并诱导T细胞活化增殖、分化,参与机体的免疫应答,是炎性反应的促发剂[14]。在感音神经性听力损失患者的TNF-α水平与对照组比较差异无统计学意义,但在常规治疗后,疗效不佳的患者血清内的TNF-α明显高于治愈后的患者[15-16]。年龄相关性听力损失的患者血清中IL-6的升高可能通过激活NF-κB导致严重的突发性感音神经性听力损失[17]。IL-1β由活化的单核/巨噬细胞分泌,作为一种炎症放大因子在炎症中起着至关重要的作用[18]。本研究发现,在LPS注射后,NF-κB的表达水平升高,猜测耳蜗炎症的发生和NF-κB/TNF-α/IL-6通路密切相关,具体机制需要进一步探讨。
本研究还观察了小鼠组织形态学变化发现,LPS组可导致螺旋神经节丢失及血管纹的破坏,但
是毛细胞不受影响,这可能与急性炎症有关,但在注射15 d后听力恢复,可能与毛细胞无破坏有关。这说明,急性炎症可造成一过性损伤,但慢性炎症会不会造成永久性损伤有待进一步研究。下一步需要增加时间节点,观察相应的耳蜗形态变化,为耳聋的治疗提供依据。
综上所述,LPS可诱发小鼠耳蜗的急性炎症,造成听力损失,主要表现为高频听力损失。阻止急性炎症的发生可以在某种程度上降低听力损失,为临床工作者治疗耳聋提供新的思路。

