红外线疗法联合银离子抗菌敷料在骨科创伤后压力性损伤患者中的应用
(上海交通大学医学院附属苏州九龙医院 江苏苏州215000)
骨科患者术后短时间内难以拆除医疗器械,通常连续应用7~60 d,患肢长期应用医疗器械,局部受压,器械边缘及周边皮肤移位后发生摩擦,久之器械边缘与周边皮肤接触处形成剪切力,增加压力性损伤发生风险[1]。医疗器械与身体接触会增加创口位置的压力、剪切力或摩擦力,诱发皮肤或皮下组织局部损伤,多以骨突出部位多见[2]。既往为预防压力性损伤多以毛巾、棉垫包裹或聚酯泡沫敷料作为主要护理措施,仍无法避免压力性损伤发生。压力性损伤一旦形成,会伴随皮肤破溃、局部疼痛,增加了护理难度,延长了骨折愈合时间[3]。红外线疗法具有杀菌及抗感染作用,可改善局部血液循环,维持创面干燥,但无法单独应用于器械相关的压力性损伤治疗[4]。银离子抗菌敷料是重症监护室常用于压力性损伤的辅助治疗措施,可有效吸收渗出液,抑制创面细菌生长,促进肉芽组织形成。但单纯应用银离子抗菌敷料无法改善受压部位的血液循环[5]。本院将红外线疗法与银离子抗菌敷料联合应用于骨科创伤后压力性损伤患者,探讨其应用效果。现报告如下。
1 资料与方法
1.1 临床资料 选取2018年6月1日~2020年6月30日本院收治的85例骨科医疗器械所致创伤后压力性损伤患者作为研究对象。纳入标准:①年龄20~65岁;②本院骨科行下肢皮肤牵引带、颈托、四肢固定支具等与皮肤接触相关器械治疗者;③受压皮肤部位出现溃疡面,直径0.5~9.0 cm,压力性损伤分期为Ⅱ、Ⅲ期者。排除标准:①未应用器械治疗已有皮肤损伤者;②妊娠及哺乳期女性;③红外线治疗过敏者。随机分为对照组40例和观察组45例。对照组男26例、女14例,年龄20~65岁;医疗器械:下肢皮肤牵引带15例,颈托枕颌带牵引15例,四肢固定支具10例;压力性损伤分期:Ⅱ期25例,Ⅲ期15例;器械使用时间10~60(33.25±5.76)d。观察组男29例、女16例,年龄20~65岁;医疗器械:下肢皮肤牵引带16例,颈托枕颌带牵引18例,四肢固定支具11例;器械使用时间10~60(33.33±5.85)d;压力性损伤分期:Ⅱ期28例,Ⅲ期17例。两组一般资料比较差异无统计学意义(P>0.05)。本研究经医院医学伦理委员会审议并通过,纳入患者对本研究知情同意并签署知情同意书。
1.2 方法
1.2.1 对照组 采用常规护理干预。护理人员对患者及家属进行健康指导,告知其不当活动会导致医疗器械移位,增加摩擦力及剪切力,需注重保持器械干燥,维持器械周围皮肤清洁。于骨科器械下方放置毛巾、棉垫等避免器械与皮肤组织直接接触,缓解牵引带边缘皮肤受压,每2 h重新放置器械1次或将器械进行短期移除,避免受压部位持续受压。已发生压力性损伤部位应用1%碘伏对创面和周围皮肤进行消毒,以0.9%氯化钠注射液对压力性损伤创面进行冲洗,行外科清创处理,采用聚酯泡沫敷料在各骨科器械边缘直接压迫皮肤处或器械压迫的骨骼突起处加以粘贴。粘贴时需注意保持患者皮肤清洁、干燥、无褶皱,将聚酯泡沫敷料与皮肤紧密贴合,每3 d更换1次(若发生潮湿则立即更换),聚酯泡沫敷料依据患者肢体情况选择,肢体部位选择较为平整的聚酯泡沫,足跟、膝部等存在生理弧度的部位,选择轮辐状聚酯泡沫敷料,避免敷料卷边脱落。
1.2.2 观察组 采用红外线疗法联合银离子敷料。应用碘伏及生理盐水冲洗患者压力性损伤部位后,采用红外线治疗仪对创面进行照射,热量根据患者皮肤红斑、感觉及操作者手感温度确定,操作过程中注意调节皮肤与仪器间距离,通常以10~20 cm为宜,照射时间设置为15~30 min,应用测温枪测试皮肤表面温度在30~31 ℃,应用过程中需避免皮肤烫伤,观察患者皮损局部情况变化。红外线照射结束后,依据患者创面面积对银离子抗菌敷料进行剪裁,敷料直径需超过创面直径3 cm,覆盖于创面,每3 d更换1次,直至创面出现红色新鲜肉芽后改为普通纱布。每日定期评估两组压力性损伤愈合情况,一旦出现发热或感染症状,及时遵医嘱行抗生素治疗,连续监测1个月。
1.3 观察指标 ①比较两组临床疗效:于干预后1个月评估患者临床疗效,记录患者创面干燥程度、渗液、分泌物、腐烂组织清除情况、肉芽组织生长情况,分为痊愈(创面干燥无渗液,无腐烂组织且创面完全愈合)、显效(创面缩小至原有面积的1/4以下,肉芽组织25%处于黄色期,基本无腐烂组织,存在少量渗液)、有效(创面缩小至原有面积的1/2以上,肉芽组织50%处于黄色期,渗液有所减少)、无效(创面无缩小甚至增加,未见明显肉芽组织,仍存在大量渗液)。②比较两组创面愈合及炎症消失时间:每日定期评估患者创面愈合情况,以创面愈合时间计入统计,记录局部炎症消退时间、全身炎症反应综合征(SIRS)消退时间。创面愈合时间为肉眼所见创面完全上皮化所需时间[6];以创口周围无红、肿、热、痛作为局部炎症消退指标;SIRS消退以患者治疗后体温、心率、呼吸、外周白细胞计数完全恢复正常为准。③比较两组干预前后压力性损伤愈合情况:于干预前及干预后7、14、28 d采用压疮愈合计分量表(PUSH)对患者压力性损伤愈合情况进行评估。PUSH评分包括压力性损伤范围、渗出液量、组织类型3个项目,总分17分,分值越高表示患者压力性损伤程度越严重。
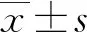
2 结果
2.1 两组临床疗效比较 见表1。

表1 两组临床疗效比较(例)
2.2 两组创面愈合时间、局部炎症消退时间、SIRS消退时间比较 见表2。
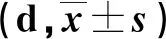
表2 两组创面愈合时间、局部炎症消退时间、SIRS消退时间比较
2.3 两组干预前后PUSH评分比较 见表3。
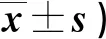
表3 两组干预前后PUSH评分比较(分,
3 讨论
目前压力性损伤在院内治疗过程中的发生率仍较高,其防控仍是护理领域的重点[7]。随着对压力性损伤成因及部位认知度的不断提高,医疗器械所致压力性损伤成为可有效控制的压力性损伤类型之一。早期实施压力性损伤防控能够减轻患者疼痛,提高患者舒适性、依从性,改善患者生存质量提升。因此,对骨科创伤患者实施有效的压力性损伤防控干预是骨科护理的关键。
有研究认为,骨科患者发生压力性损伤与相关器械所致局部皮肤受压时间长,导致组织缺血缺氧有关,骨科术后创口一旦出现溃疡,极易引发感染,导致SIRS,影响患者预后[8]。压力性损伤继发感染患者免疫功能降低,易出现大量内毒素,增加内源性“瀑布效应”风险,导致炎症反应失控[9]。因此,对器械相关压力性损伤患者应防控SIRS,缩短SIRS持续时间。红外线局部照射能杀灭细菌并分离坏死组织,促进血液循环,为创面保持干燥提供帮助[10-11]。有研究认为,红外线照射能使溃疡区酸性物质随血液循环转运至体外,促进病灶部位的pH值恢复[12]。随着创面愈合观念转变,多种新型湿性敷料得以应用于临床,银离子抗菌敷料可持续释放银离子,为创面愈合提供湿性环境,维持创面温湿度,有效促进上皮细胞形成[13]。与聚酯泡沫敷料相比,银离子抗菌敷料不仅可保持创面无菌,还可促进创面愈合。银离子抗菌敷料以其独有的三维原位吸收性能,在吸收创面渗液及分泌物同时,持续释放银离子,成倍提高杀菌活性[14-15]。因此,在红外线疗法基础上应用银离子抗菌敷料,有助于降低压力性损伤患者感染风险,促进创口愈合。
本研究结果显示,观察组临床疗效优于对照组(P<0.01);观察组创面愈合时间、局部炎症消退时间、SIRS消退时间均短于对照组(P<0.01),这一结果与王文华等[16]研究相似。同时,观察组干预后7、14、28 d的PUSH评分均低于对照组(P<0.05,P<0.01)。表明通过红外线局部照射的杀菌抗感染功效更好,可维持创面干燥,同时可持续性吸收银离子,增强杀菌活性,两者合用,既维持创口内部封闭,也促进渗出液引流。在湿润且无菌的外部环境下,银离子抗菌敷料起到促进肉芽组织生成及创面愈合效用,进一步软化硬痂、溶解坏死组织及胶原蛋白纤维,创面愈合时间及程度得以全面改善[17]。但本研究也存在一定不足,受骨科器械相关压力性损伤患者样本量不足影响,存在一定的数据偏倚风险,且仅就Ⅱ、Ⅲ期压力性损伤进行干预。未来将以Ⅵ期压力性损伤作为主要研究对象,进一步确认红外线疗法联合银离子抗菌敷料的临床效用。
综上所述,将红外线疗法联合银离子抗菌敷料应用于骨科创伤后压力性损伤患者,可有效改善患者临床疗效,促进患者创面愈合,缩短创面及全身炎症反应持续时间。

